
- •Міністерство охорони здоров'я України
- •Модуль 1 Хімічна термодинаміка. Фазові рівноваги. Колігативні властивості розбавлених розчинів. Електрохімія. Хімічна кінетика
- •Заняття 1
- •Застосування першого закону термодинаміки до хімічних процесів. Перший закон термодинаміки. Термохімія. Актуальність теми
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми: “Перший закон термодинаміки. Термохімія”
- •Джерела інформації
- •Орієнтовна основа дії Алгоритм рішення задач з фізичної хімії:
- •Набір завдань для перевірки досягнення конкретних цілей навчання
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми: “Другий закон термодинаміки. Термодинамічні потенціали і характеристичні функції”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання Перелік теоретичних питань
- •Граф логічної структури: “Термодинаміка хімічної рівноваги. Рівняння ізотерми, ізобари, ізохори реакцій”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури: “Термодинаміка фазової рівноваги”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Фазові рівноваги”
- •Джерела інформації
- •Орієнтовна основа дії
- •Орієнтовна основа дії
- •Джерела інформації
- •Короткі методичні вказівки до роботи на практичному занятті
- •Заняття 8
- •Колігативні властивості розбавлених розчинів. Ідеальні розчини Актуальність теми
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Колігативні властивості розбавлених розчинів”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Колігативні властивості розбавлених розчинів” Джерела інформації
- •Орієнтовна основа дії Алгоритм виконання досліду „Визначення температури замерзання речовини"
- •Алгоритм виконання досліду “Визначення молярної маси неелектроліту”
- •Алгоритм виконання досліду “Визначення ізотонічного коефіцієнта, ступеня електролітичної дисоціації і осмотичного тиску електроліту у водному розчині”
- •Набір завдань для перевірки досягнення конкретних цілей навчання
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Властивості розчинів електролітів. Електрична провідність”
- •Джерела інформації
- •Орієнтовна основа дії
- •Короткі методичні вказівки до роботи на практичному занятті
- •Заняття 11
- •Електродні потенціали та електрорушійні сили. Класифікація електродів. Потенціометрія Актуальність теми
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Потенціометрія”
- •Джерела інформації
- •Орієнтовна основа дії
- •Джерела інформації
- •Граф логічної структури теми
- •Цілі навчання
- •Зміст навчання
- •Джерела інформації
- •Граф логічної структури теми
- •Джерела інформації
- •Короткі методичні вказівки до роботи на практичному занятті
- •Джерела інформації
- •Короткі методичні вказівки до роботи на практичному занятті
Цілі навчання
Загальна мета:
УМІТИ: інтерпретувати фізичну суть фазової рівноваги для подальшого використання таких знань — умінь у фармації.
Конкретні цілі:
УМІТИ:
1. Будувати діаграми плавкості речовин за експериментальними даними.
2. Визначати склад суміші лікарських речовин за діаграмами плавкості.
Зміст навчання
Перелік теоретичних питань:
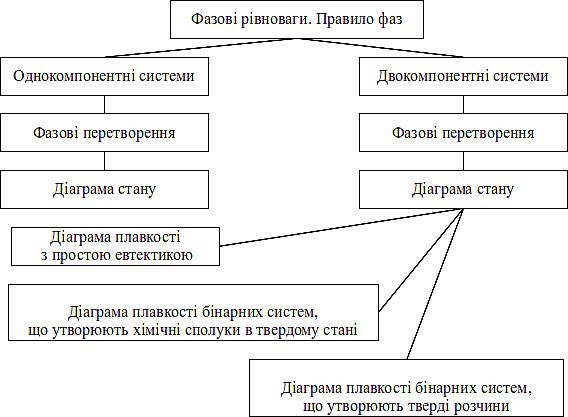
1. Фазові перетворення в двухкомпонентних системах.
2. Диаграма плавкості з простою евтектикою.
3. Застосування диаграм плавкості в фармації.
Граф логічної структури теми “Фазові рівноваги”
Джерела інформації
Основна література:
1. Фізична і колоїдна хімія/ В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; За заг. ред. В.І. Кабачного.- Харків.: Вид-во УкрФА «Прапор», 1999. -С. 67-79.
2. Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. -Харьків: Вид-во НФАУ „Золоті сторінки", 2001. -С. 39-41.
3. Лекція з теми.
Додаткова література:
1. Физическая и коллоидная химия/ В.И. Кабачный, Л.К. Осипенко, Л.Д. Грицан и др..: Под об.ред. В.И. Кабачного.-Харьков.: Издательство УкрФА «Прапор», 2005.- С.67-78.
Орієнтовна основа дії
Алгоритм виконання досліду “Визначення складу лікарських сумішей за діаграмами плавкості”
1. Включити водяну баню. Помістити в баню 2-3 пробірки з сумішшю лікарських речовин в різних співвідношеннях.
2. Визначити температуру плавлення в пробірках. Результати занести в таблицю.
3. Витягнути пробірки з бані та фіксувати температуру суміші кожні 30с. Результати досліджень занести до таблиці.
3. Визначити температуру появи перших кристалів. Результати досліджень занести до таблиці.
4. За результатами вимірів побудувати криві охолодження та диаграмму плавкості.
Набір завдань для перевірки досягнення конкретних цілей навчання
Тест 1
Обчислення температури фазових перетворень при різних тисках має важливе практичне значення для сучасного фармацевтичного виробництва і здійснюється відповідно до:
A. Рівняння Клапейрона-Клаузіуса
B. Правила Трутона
C. Правила фаз Гіббса
D. Рівняння Менделєєва-Клапейрона
E. Законів Коновалова
Тест 2
Точка максимуму на діаграмі плавкості, коли речовини утворюють стійку сполуку, зветься:
A.Сінгулярною
B. Евтектичною
C. Рівноважною
D. Максимальною
E. Критичною
Тест 3
На діаграмі плавкості двохкомпонентної системи з простою евтектикою выще лінії ліквідуса:
A. Обидва компоненти знаходяться в рідкому стані
B. Обидва компоненти знаходяться в твердому стані
C. Обидва компоненти знаходяться в газуватому стані
D. Кожний компонент знаходиться частково в різних агрегатних станах
E. Один з компонентів знаходиться в рідкому стані, іншої - в твердому
Тест 4
Більшість технологічних процесів в фармації протікає в гетерогених системах. Яка кількість фаз знаходиться в суміші евтектичного складу при евтектичній температурі двуохкомпонентної системи?
A. 3
B. 2
C. 5
D. 4
E. 1
Тест 5
В евтектичній точці двохкомпонентної системи з простою евтектикою в рівновазі знаходяться фази:
А. 2 твердих и розплав евтектичного складу
B. 3 твердих
C. 2 рідких і 1 тверда
D. 1 тверда, 1 рідка и 1 газувата
E. 3 рідких
Еталони відповідей до рішення цільових навчальних завдань: тест 1 — A, тест 2 — A.
Короткі методичні вказівки до роботи на практичному занятті
На початку заняття перевіряється підготовленність студентів до заняття шляхом усного опитування, або тестування. Далі студенти студенти працюють самостійно у відповідності до ООД, викладених у методичних вказівках. Рішення ситуаційних задач оформлюється в робочому журналі. Далі проводиться поточний контроль за темою (набори тестів). Потім розглядаються результати самостійної роботи, аналізуються помилки, підводяться підсумки заняття.
Заняття 6
Фазові рівноваги. Трьохкомпонентні системи. Закон розподілу. Екстракція
Актуальність теми
Найпоширеніший випадок застосування закону розподілу у фармацевтичній і токсикологічній хімії, технології ЛС - це екстракція. Широкому розповсюдженню методу екстракції розділу сприяє можливість поєднання розділення з одночасним розділенням. Екстракцію використовують в лабораторній і заводській практиці для виділення і очищення ефірних масел, алкалоїдів, антибіотиків і інших лікарських речовин.
Цілі навчання
Загальна мета:
УМІТИ: інтерпретувати фізичну суть фазової рівноваги для подальшого використання таких знань — умінь у фармації.
Конкретні цілі:
УМІТИ:
1. Провести екстракцію йода з водного розчину.
2. Розрахувати коефіцієнт розподілу.
3. Оцінити ефективність екстракції.
Зміст навчання
Перелік теоретичних питань:
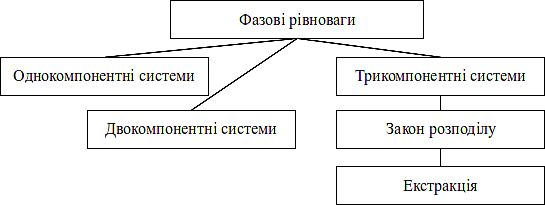
1. Трьохкомпонентні системи.
2. Розподіл речовини між двома рідкими фазами.
3. Закон розподілу Нернста.
4. Екстракція та її застосування в фармации.
Граф логічної структури теми
Джерела інформації
Основна література:
1. Фізична і колоїдна хімія/ В.І. Кабачний, Л.К. Осіиенко, Л.Д. Грицан та ін.; За заг. ред. В.І. Кабачного.- Харків.: Вид-во УкрФА «Прапор», 1999. -С. 80-88.
2. Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. -Харьків: Вид-во НФАУ „Золоті сторінки", 2001. -С. 39-41.
3. Лекція з теми.
Додаткова література:
1. Физическая и коллоидная химия/ В.И. Кабачный, Л.К. Осипенко, Л.Д. Грицан и др..: Под об.ред. В.И. Кабачного.-Харьков.: Издательство УкрФА «Прапор», 2005.- С.79-85.
