
- •Міністерство охорони здоров'я України
- •Модуль 1 Хімічна термодинаміка. Фазові рівноваги. Колігативні властивості розбавлених розчинів. Електрохімія. Хімічна кінетика
- •Заняття 1
- •Застосування першого закону термодинаміки до хімічних процесів. Перший закон термодинаміки. Термохімія. Актуальність теми
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми: “Перший закон термодинаміки. Термохімія”
- •Джерела інформації
- •Орієнтовна основа дії Алгоритм рішення задач з фізичної хімії:
- •Набір завдань для перевірки досягнення конкретних цілей навчання
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми: “Другий закон термодинаміки. Термодинамічні потенціали і характеристичні функції”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання Перелік теоретичних питань
- •Граф логічної структури: “Термодинаміка хімічної рівноваги. Рівняння ізотерми, ізобари, ізохори реакцій”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури: “Термодинаміка фазової рівноваги”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Фазові рівноваги”
- •Джерела інформації
- •Орієнтовна основа дії
- •Орієнтовна основа дії
- •Джерела інформації
- •Короткі методичні вказівки до роботи на практичному занятті
- •Заняття 8
- •Колігативні властивості розбавлених розчинів. Ідеальні розчини Актуальність теми
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Колігативні властивості розбавлених розчинів”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Колігативні властивості розбавлених розчинів” Джерела інформації
- •Орієнтовна основа дії Алгоритм виконання досліду „Визначення температури замерзання речовини"
- •Алгоритм виконання досліду “Визначення молярної маси неелектроліту”
- •Алгоритм виконання досліду “Визначення ізотонічного коефіцієнта, ступеня електролітичної дисоціації і осмотичного тиску електроліту у водному розчині”
- •Набір завдань для перевірки досягнення конкретних цілей навчання
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Властивості розчинів електролітів. Електрична провідність”
- •Джерела інформації
- •Орієнтовна основа дії
- •Короткі методичні вказівки до роботи на практичному занятті
- •Заняття 11
- •Електродні потенціали та електрорушійні сили. Класифікація електродів. Потенціометрія Актуальність теми
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Потенціометрія”
- •Джерела інформації
- •Орієнтовна основа дії
- •Джерела інформації
- •Граф логічної структури теми
- •Цілі навчання
- •Зміст навчання
- •Джерела інформації
- •Граф логічної структури теми
- •Джерела інформації
- •Короткі методичні вказівки до роботи на практичному занятті
- •Джерела інформації
- •Короткі методичні вказівки до роботи на практичному занятті
Джерела інформації
Основна література:
1. Фізична і колоїдна хімія/ В.І. Кабачний, Л.К. Осіпенко, Л.Д. Грицан та ін.; За заг. ред. В.І. Кабачного.-Харків.: Вид-во УкрФА «Прапор», 1999.-С. 151-174.
2. Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. - Харьків: Вид-во НФАУ „Золоті сторінки", 2001. - С. 88-109.
3. Лекція з теми.
Додаткова література:
1. Физическая и коллоидная химия/ В.И. Кабачный, Л.К. Осипенко, Л.Д. Грицан и др..: Под об.ред. В.И. Кабачного.- Харьков.: Издательство УкрФА «Прапор», 2005.- С.151-174.
Граф логічної структури теми
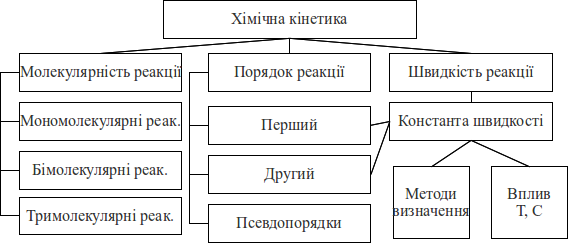
Орієнтовна основа дії
Алгоритм рішення задач. Див. Заняття 1.
Набір завдань для перевірки досягнення конкретних цілей навчання
Тест 1
Період напівперетворення деякої реакції А -> У обратно пропорційно залежить від початкової концентрації речовини А. Якого порядку дана реакція?
A. третього
B. першого
C. другого
D. нульового
E. дробового
Тест 2
Вкажіть порядок хімічної реакції, якщо експериментальні дослідження вказують на лінійну залежність величини зворотного концентрації реагентів від часу:
A.перший
B. другий
C. третій
D. нульовий
E. дробний
Тест 3
Для точного обчислення константи швидкості за величиною енергії активації застосовується стерічній | фактор, який враховує:
A. Хімічні властивості взаємодіючих сполук
B. Концентрацію реагуючих речовин
C. Температуру реакційної суміші
D. Взаємну орієнтацію реагують молекул
E. Будова молекул взаємодіючих сполук
Тест 4
Дослідження залежності швидкості реакцій від різних факторів дозволяє інтенсифікувати технологічні процеси фармацевтичних виробництв, визначати терміни придатності лікарських препаратів і т.п. Який з факторів не впливає на константу швидкості хімічної реакції?
A. Температура
B. Природа реагуючих речовин
C. природа розчинника
D. Концентрація реагуючих речовин
E. Ступінь дисперсності твердої речовини
Тест 5
Температурний коефіцієнт швидкості реакції дорівнює 3. У скільки разів зросте швидкість реакції при підвищенні температури на 30 ° С?
A. В 9 разів
B. У 18 разів
C. У 27 разів
D. В 36 раз
E. У 45 разів
Еталони відповідей до рішення цільових навчальних завдань:
тест 1-С, тест 2- B, тест 3-D, тест 4- D, тест 5-С.
Короткі методичні вказівки до роботи на практичному занятті
На початку заняття перевіряється підготовленність студентів до заняття шляхом усного опитування, або тестування. Далі студенти студенти працюють самостійно у відповідності до ООД, викладених у методичних вказівках. Рішення ситуаційних задач оформлюється в робочому журналі. Далі проводиться поточний контроль за темою (набори тестів). Потім розглядаються результати самостійної роботи, аналізуються помилки, підводяться підсумки заняття.
Заняття 13
Молекулярна кінетика. Каталіз
Актуальність теми
Каталіз - виборче прискорення одного з можливих термодинамічно дозволених напрямків хімічної реакції під дією каталізатора, який багаторазово вступає в проміжну хімічну взаємодію з учасниками реакції і відновлює свій хімічний склад після кожного циклу проміжних хімічних взаємодій. Каталізатор змінює механізм реакції на енергетично більш вигідний. Каталізатор утворює з молекулою одного з реагентів проміжну сполуку, в якій ослаблено хімічні зв'язки. Це полегшує його реакцію з другим реагентом. Важливо зазначити, що каталізатори прискорюють оборотні реакції, як в прямому, так і в зворотному напрямках. Явище каталізу поширене в природі (більшість процесів, що відбуваються в живих організмах, є каталітичними) і широко використовується в техніці, фармації.
