
- •Міністерство охорони здоров'я України
- •Модуль 1 Хімічна термодинаміка. Фазові рівноваги. Колігативні властивості розбавлених розчинів. Електрохімія. Хімічна кінетика
- •Заняття 1
- •Застосування першого закону термодинаміки до хімічних процесів. Перший закон термодинаміки. Термохімія. Актуальність теми
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми: “Перший закон термодинаміки. Термохімія”
- •Джерела інформації
- •Орієнтовна основа дії Алгоритм рішення задач з фізичної хімії:
- •Набір завдань для перевірки досягнення конкретних цілей навчання
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми: “Другий закон термодинаміки. Термодинамічні потенціали і характеристичні функції”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання Перелік теоретичних питань
- •Граф логічної структури: “Термодинаміка хімічної рівноваги. Рівняння ізотерми, ізобари, ізохори реакцій”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури: “Термодинаміка фазової рівноваги”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Фазові рівноваги”
- •Джерела інформації
- •Орієнтовна основа дії
- •Орієнтовна основа дії
- •Джерела інформації
- •Короткі методичні вказівки до роботи на практичному занятті
- •Заняття 8
- •Колігативні властивості розбавлених розчинів. Ідеальні розчини Актуальність теми
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Колігативні властивості розбавлених розчинів”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Колігативні властивості розбавлених розчинів” Джерела інформації
- •Орієнтовна основа дії Алгоритм виконання досліду „Визначення температури замерзання речовини"
- •Алгоритм виконання досліду “Визначення молярної маси неелектроліту”
- •Алгоритм виконання досліду “Визначення ізотонічного коефіцієнта, ступеня електролітичної дисоціації і осмотичного тиску електроліту у водному розчині”
- •Набір завдань для перевірки досягнення конкретних цілей навчання
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Властивості розчинів електролітів. Електрична провідність”
- •Джерела інформації
- •Орієнтовна основа дії
- •Короткі методичні вказівки до роботи на практичному занятті
- •Заняття 11
- •Електродні потенціали та електрорушійні сили. Класифікація електродів. Потенціометрія Актуальність теми
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Потенціометрія”
- •Джерела інформації
- •Орієнтовна основа дії
- •Джерела інформації
- •Граф логічної структури теми
- •Цілі навчання
- •Зміст навчання
- •Джерела інформації
- •Граф логічної структури теми
- •Джерела інформації
- •Короткі методичні вказівки до роботи на практичному занятті
- •Джерела інформації
- •Короткі методичні вказівки до роботи на практичному занятті
Цілі навчання
Загальна мета:
УМІТИ: інтерпретувати фізичну суть рівноваг в розчинах електролітів для подальшого використання таких знань - умінь у фармації.
Конкретні цілі:
УМІТИ:
1. Інтерпретувати властивості розчинів електролітів.
2. Інтерпретувати електричну провідність розчинів електролітів.
3. Розраховувати електричну провідність розчинів електролітів і оцінювати отримані результати.
Зміст навчання
Перелік теоретичних питань:
Поняття сили електроліту. Здатність молекул електролітів дисоціювати, оборотність дисоціації.
Ступінь дисоціації. Константа дисоціації.
Колигативні властивості розчинів електролітів.
Питома, молярна, іонна електропровідність електролітів.
Розрахунок електричної провідності розчинів електролітів.
Застосування даних електропроводності розчинів електролітів у фармації.
Граф логічної структури теми “Властивості розчинів електролітів. Електрична провідність”
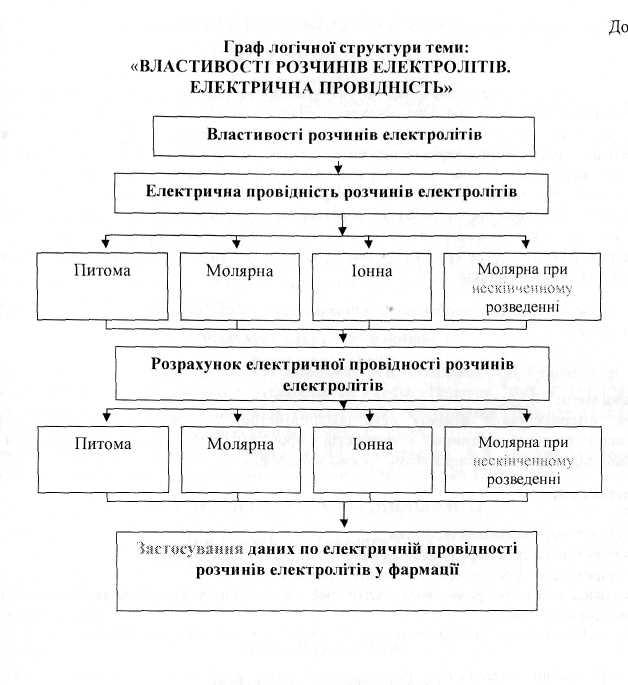
Джерела інформації
Основна література:
1. Фізична і колоїдна хімія/ В.І. Кабачний, Л.К. Осіпенко, Л.Д. Грицан та ін.; За заг. ред. В.І. Кабачного.- Харків.: Вид-во УкрФА «Прапор», 1999. - С. 111-150.
2. Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. - Харьків: Вид-во НФАУ „Золоті сторінки", 2001. - С. 80-84.
3. Лекція з теми.
Додаткова література:
1. Физическая и коллоидная химия/ В.И. Кабачньш, Л.К. Осипенко, Л.Д. Грицан и др..: Под об.ред. В.И. Кабачного- Харьков.: Издательство УкрФА «Прапор», 2005.- С. 111-150.
Орієнтовна основа дії
Алгоритм рішення задач. Див. Заняття 1.
Набір завдань для перевірки досягнення конкретних цілей навчання
Тест 1
Для визначення ступеня дисоціації слабкого електроліту методом кондуктометрії, експериментально потрібно вимірювати:
А. Константу дисоціації електроліту
В. Добуток розчинності електроліту
С. Граничну молярну електропровідність електроліту
D. Електрорушійну силу
Е. Опір розчину
Тест 2
рН середовища інструментальним методом можна зміряти використовуючи прилад:
А. Хроматограф
В. Кондуктометр
С. Іонометр
D. Полярограф
Е. Поляриметр
Тест 3
Для кількісного визначення Со2+ в суміші з Мn2+ полярографічним методом вимірюють:
А. Потенціал полуволни
В. Силу струму
С. Час утримання
О. Висоту полярографічної хвилі
Е, Об'єм утримання
Тест 4
Ідентифікація аналізованих компонентів методом газорідинної хроматографії проводиться з використанням фізіко-хімічного параметра:
А. Час утримування
В. Швидкість руху іонів
С. Потенціал напівхвилі
D. Питоме поглинання
Е. Екстінкція
Тест 5
Визначте граничну молярну електричну провідність для NH4ОН при 25°С, якщо граничні молярні електричні провідності КС1, КОН та NН4СІ при цій температурі дорівнюють відповідно 14,99; 27,18 та 14,99 См-м2/кмоль.
А. 27,18 См-м2/кмоль.
B. 7,18 См-м2/кмоль.
C.2700,18 См-м2/кмоль.
D.207,18 См-м2/кмоль.
E. 2 См-м2/кмоль.
Тест 6
Питома електрична провідність водного розчину з массовою часткою КI 5% (р = 1.035 г/мл). який використовується при гіпертиреозі, при 18°С дорівнює 3,38 См/м. Розрахуйте молярну електричну провідність цього розчину і ступінь дисоціації КІ, якщо граничні молярні електричні провідності іонів К+ і Cl- дорівнюють відповідно 6,39 і 6,65 См-м2/кмоль.
А. 10,83 См-м2/кмоль; 0,83.
B. 100,83 См-м2/кмоль; 0,83.
C.10,83 См-м2/кмоль; 1.
D.10 См-м2/кмоль; 0.
E. 0,83 См-м2/кмоль; 0,83.
Еталони відповідей до рішення цільових навчальних завдань: тест 5-А, тест 6-А.
