
- •Міністерство охорони здоров'я України
- •Модуль 1 Хімічна термодинаміка. Фазові рівноваги. Колігативні властивості розбавлених розчинів. Електрохімія. Хімічна кінетика
- •Заняття 1
- •Застосування першого закону термодинаміки до хімічних процесів. Перший закон термодинаміки. Термохімія. Актуальність теми
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми: “Перший закон термодинаміки. Термохімія”
- •Джерела інформації
- •Орієнтовна основа дії Алгоритм рішення задач з фізичної хімії:
- •Набір завдань для перевірки досягнення конкретних цілей навчання
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми: “Другий закон термодинаміки. Термодинамічні потенціали і характеристичні функції”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання Перелік теоретичних питань
- •Граф логічної структури: “Термодинаміка хімічної рівноваги. Рівняння ізотерми, ізобари, ізохори реакцій”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури: “Термодинаміка фазової рівноваги”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Фазові рівноваги”
- •Джерела інформації
- •Орієнтовна основа дії
- •Орієнтовна основа дії
- •Джерела інформації
- •Короткі методичні вказівки до роботи на практичному занятті
- •Заняття 8
- •Колігативні властивості розбавлених розчинів. Ідеальні розчини Актуальність теми
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Колігативні властивості розбавлених розчинів”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Колігативні властивості розбавлених розчинів” Джерела інформації
- •Орієнтовна основа дії Алгоритм виконання досліду „Визначення температури замерзання речовини"
- •Алгоритм виконання досліду “Визначення молярної маси неелектроліту”
- •Алгоритм виконання досліду “Визначення ізотонічного коефіцієнта, ступеня електролітичної дисоціації і осмотичного тиску електроліту у водному розчині”
- •Набір завдань для перевірки досягнення конкретних цілей навчання
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Властивості розчинів електролітів. Електрична провідність”
- •Джерела інформації
- •Орієнтовна основа дії
- •Короткі методичні вказівки до роботи на практичному занятті
- •Заняття 11
- •Електродні потенціали та електрорушійні сили. Класифікація електродів. Потенціометрія Актуальність теми
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Потенціометрія”
- •Джерела інформації
- •Орієнтовна основа дії
- •Джерела інформації
- •Граф логічної структури теми
- •Цілі навчання
- •Зміст навчання
- •Джерела інформації
- •Граф логічної структури теми
- •Джерела інформації
- •Короткі методичні вказівки до роботи на практичному занятті
- •Джерела інформації
- •Короткі методичні вказівки до роботи на практичному занятті
Цілі навчання
Загальна мета:
УМІТИ: інтерпретувати фізичну суть хімічної рівноваги для подальшого використання таких знань - умінь у фармації.
Конкретні цілі:
УМІТИ:
1 Інтерпретувати суть хімічної рівноваги і константи рівноваги.
2. Інтерпретувати зміну константи рівноваги при зміні температури.
3. Розраховувати зміну ізобарно-ізотермічного потенціалу і константи рівноваги в хімічних і фізіко-хімічних процесах, вихід продуктів реакцій і оцінювати отримані результати.
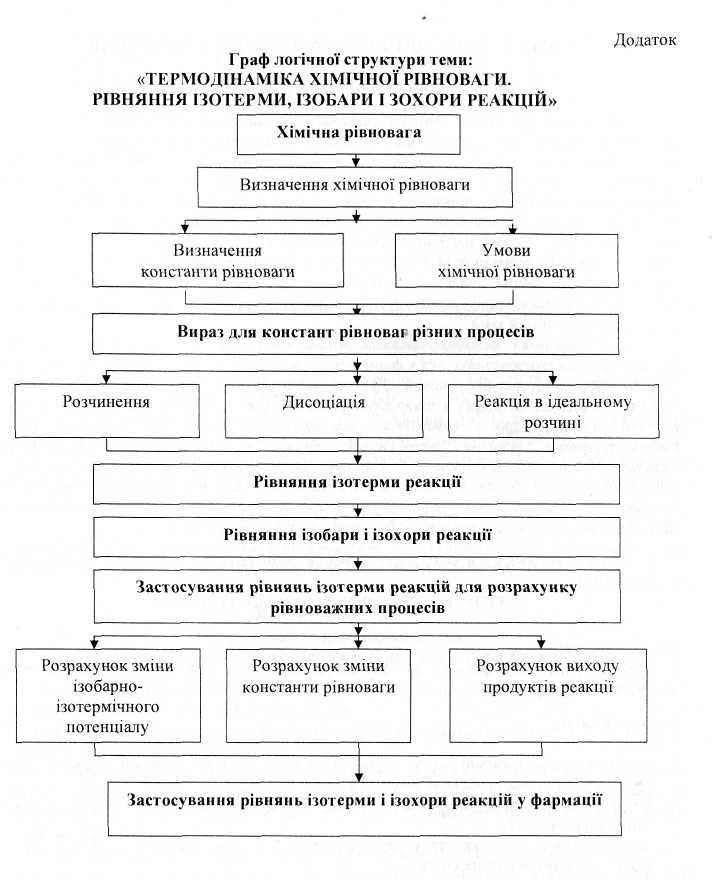
Зміст навчання Перелік теоретичних питань
Хімічна рівновага. Визначення хімічної рівноваги. Визначення константи рівноваги. Умови хімічної рівноваги. Вираз для константи рівноваги різних процесів.
Розчинення. Дисоціація.
Реакція в ідеальному розчині.
Рівняння ізотерми реакцій.
Вплив температури на хімічну рівновагу. Залежність константи рівноваги від температури. Рівняння ізобари і ізохори реакцій.
Застосування рівнянь ізотерми і ізобари реакцій для розрахунків рівноважних процесів.
Розрахунок зміни ізобарно-ізотермічного потенціалу.
Розрахунок зміни константи рівноваги.
Розрахунок виходу продуктів реакцій.
Застосування рівнянь ізотерми і ізобари реакцій у фармації.
Граф логічної структури: “Термодинаміка хімічної рівноваги. Рівняння ізотерми, ізобари, ізохори реакцій”
Джерела інформації
Основна література:
1. Фізична і колоїдна хімія/ В.І. Кабачний, Л.К. Осіпенко, Л.Д. Грицан та ін.; За заг. ред. В.І. Кабачного,- Харків.: Вид-во УкрФЛ «Прапор», 1999. -С. 42-51.
2. Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного.-Харьків: Вид-во НФАУ „Золоті сторінки", 2001. -С. 25-26.
3. Лекція з теми.
Додаткова література:
1. Физическая и коллоидная химия/ В.И. Кабачный, Л.К. Осипенко, Л.Д. Грицан и др..: Под об.ред. В.И. Кабачного.-Харьков.: Издательство УкрФА «Прапор», 2005.- С.42-51.
Орієнтовна основа дії
Алгоритм рішення задач — див. Заняття 1.
Набір завдань для перевірки досягнення конкретних цілей навчання
Тест 1
У виробництві лікарських речовин головним є встановлення хімічної рівноваги, що є:
А. Кількість речовин, що утворюються хімічну систему, які залишаються незмінними в часі за незмінних зовнішніх умов
В. Кількість речовин що вступили в реакцію
С. Кількість продуктів реакції
D. Кількість речовин, які змінюються в часі за незмінних зовнішніх умов
Е. Кількість речовин, які залишаються незмінними в часі за змінних зовнішніх умов
Тест 2
Вираз для залежності константи рівноваги від температури можна отримати, скориставшись рівнянням
А. Смолуховського
В. Гібса-Гельмгольца
С. Гібса
D. Ленгмюра
Е. Фрейндліха
Тест 3
За допомогою рівняння ізотерми можна характеризувати здатність різних речовин вступати в хімічну взаємодію, тобто можна визначити
А. Хімічний потенціал
В. Кінетичний потенціал
С. Хімічну спорідненість
D. Концентрацію речовин
Е. Енергію Гіббса
Тест 4
Хімічні процеси супроводжуються тепловими ефектами, які підкоряються такому закону: «Тепловий ефект реакції не залежить від шляху, по якому протікає процес, а визначається початковим і кінцевим етапом системи».
А. Закон Геса
В. Закон Генрі
С. Закон мас
О. Закон Нернста
Е. Закон Авогадро
Тест 5
Стандартними умовами визначаються наступні значення тиску і температури (параметрами стану):
А. 50 кПа, 298 К
В. 50кПа,273К
С. 101,3 кПа,
D.101,3 кПа, 273 К
Е. 101,3 кПа, 298 К
Еталони відповідей до рішення цільових навчальних завдань:
тест 1-А, тест 5-Е.
Короткі методичні вказівки до роботи на практичному занятті
На початку заняття перевіряється підготовленість студентів до заняття шляхом усного опитування, або тестування. Далі студенти студенти працюють самостійно у відповідності до ООД, викладених у методичних вказівках. Рішення ситуаційних задач оформлюється в робочому журналі. Далі проводиться поточний контроль за темою (набори тестів). Потім розглядаються результати самостійної роботи, аналізуються помилки, підводяться підсумки заняття.
Заняття 4
Фазові рівноваги. Правило фаз Гібсса. Фазові перетворення в однокомпонентних системах. Рівняння Клапейрона-Клаузіуса
Актуальність теми
Відповідно до закону фазової рівноваги (правило фаз Гібса), термодинамічні системи поділяють: а) за характером фазової будови на гетерогенні, гомогенні і такі, що конденсують; б) за числом ступенів свободи на безваріантні, одно-, двух-, трьох- і багатоваріантні; в) за числом незалежних компонентів на одно-, двух-, трьох-, багато компонентні. Графічне зображення експериментальних співвідношень між параметрами стану термодинамічних систем і величинами їх вимірюваних фізичних властивостей називають діаграмами стану. За цими діаграмами встановлюють характер взаємодії компонентів, склад і межі існування фаз постійного і змінного складу, що утворюються, без ізолювання цих фаз та їх хімічного аналізу. Це пояснює широке застосування діаграм стану в фармацевтичній хімії.
