
Тройные диаграммы
.pdf
Куполобразные поверхности kab и kcd изображают соответственно температуры начала и конца упорядочения α→α′ сплавов области kab, а так же составы неупорядоченного α и упорядоченного α′растворов в интервале температур между этими поверхностями. Упорядочение в рассматриваемой системе происходит как фазовый переход первого рода, т.е. подчиняется пра вилу фаз Гиббса.
Рисунок 2.19 Диаграмма состояния тройной системы АВС с упорядочен ными твердыми растворами
В единственном двойном сплаве стехиометрического состава BmCn упорядочение α→α′ происходит при постоянной температуре Tk. В осталь ных двойных и тройных сплавах области, расположенной между стороной двойной системы ВС и кривой ab, упорядочение α→α′ протекает в интерва ле температур между поверхностями kab и kcd.
Рассмотрим кристаллизацию сплавов K и D (рисунок 2.20,а). Сплав К имеет четыре критические точки, а сплав D – три критические точки.
Сплав К становится полностью упорядоченным при температуре Т4, которая выше комнатной. В сплаве D упорядочение при комнатной темпера туре не заканчивается, в нем сохраняется некоторое количество неупорядо ченного αраствора. Кривые охлаждения сплавов приведены на рисунке
2.20,б.
40

а |
б |
Рисунок 2.20 – Проекция диаграммы состояния системы с упорядоченными твердыми растворами (а) и кривые охлаждения сплавов (б)
Необходимо заметить, что если упорядочение протекает как фазовый переход второго рода, то диаграмма состояния будет похожа на рассмотрен ную выше диаграмму состояния системы с бинодальной поверхностью (ри сунок 2.17). Отличие диаграммы будет состоять в том, что куполообразная поверхность ak′k1b будет изображать не температуры начала расслоения и составы α1 и α2растворов, а зависимость точки Курнакова от состава спла вов в области аk1b. При температурах ниже этой поверхности сплавы области аk1b состоят не из двух α1 и α2растворов, а из одного частично упорядочен ного α′раствора.
2.5. Реальные системы NbMoW и AuNiPd
Неограниченная растворимость компонентов встречается в системах, образованных чистыми металлами, например NbMoW с решеткой ОЦК, AuNiPd с решеткой ГЦК, а также в системах с полупроводниковыми и ион ными соединениями.
На рисунке 2.21 приведены проекции изотерм солидуса на плоскость концентрационного треугольника системы NbWMo. Видно, что точка соли дуса тройного сплава понижается от 3200 до 2400 оС с уменьшением содер жания вольфрама.
41
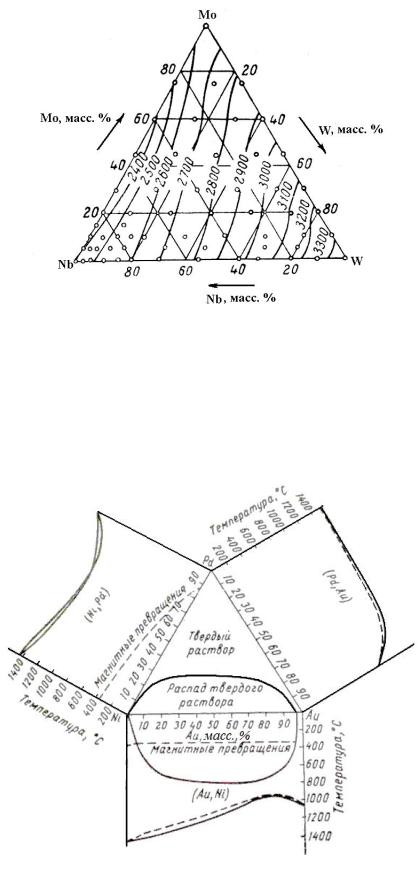
Рисунок 2.21 Проекции изотерм солидуса на плоскость концентрационного треугольника системы NbWMo (экспериментальные данные Савицкого Е.М. и др.)
Диаграмма распределения фазовых областей в системе золотоникель палладий при комнатной температуре и политермические разрезы простран ственной диаграммы состояния при постоянном содержании палладия пока заны на рисунках 2.212.22.
Рисунок 2.22 – Диаграмма распределения фазовых областей в системе AuNiPd
42

Рисунок 2.23 – Политермические разрезы системы AuNiPd при постоянном содержании Pd (экспериментальные данные Григорьева А.Т. и др.)
При постоянном содержании 10 и 20 % Pd происходит распад твердого раствора.
Контрольные вопросы к разделу 2
1.Постройте пространственную диаграмму состояния тройной системы с непрерывными рядами жидких и твердых растворов. Укажите поверхности, характерные для этого типа диаграммы состояния.
2.Объясните, что показывают поверхности ликвидуса и солидуса.
3.В чем отличие состояний жидкой фазы выше и ниже поверхности ликвидуса?
4.В чем отличие состояний выше и ниже поверхности солидуса?
5.Сформулируйте правило Коновалова для двойных и тройных систем. 6.В чем отличие в изменении составов жидких и твердых растворов при кристаллизации сплавов тройных систем по сравнению с двойными
сплавами?
43
7.Какие разрезы тройных систем называют политермическими? Можно ли по линиям таких разрезов определять химические составы фаз, находя щиеся в равновесии при определенной температуре? Дайте пояснения.
8.Какие разрезы тройных систем называют изотермическими? Как можно использовать такие разрезы в практической деятельности? Приведите пример.
9.Назовите основные типы разновидностей диаграмм состояния с экс тремальными точками на поверхностях ликвидуса и солидуса.
10.Какое фазовое равновесие характерно для тройной системы с бино дальной поверхностью?
11.Какое фазовое равновесие характерно для тройной системы с упо рядоченными твердыми растворами?
12.Назовите реальные системы с неограниченной растворимостью компонентов в твердом и жидком состояниях.
44
РАЗДЕЛ 3. ДИАГРАММЫ СОСТОЯНИЯ СИСТЕМ С МОНОВАРИАНТНЫМИ РАВНОВЕСИЯМИ
Лекция 7
План лекции
Эвтектический разрыв растворимости в одной из двойных систем. Поверхности ликвидуса и солидуса. Поверхности растворимости. Области превращений.
Тройная система AuAgCu.
Моновариантные равновесия в тройных системах это трехфазные равновесия разных типов (с = 3 – Ф +1= 1; Ф = 3, см. раздел 1).
В тройных системах с би и моновариантными равновесиями обычно имеет место неограниченная растворимость компонентов в жидком состоя нии и ограниченная их растворимость в твердом состоянии, обычно умень шающаяся при понижении температуры. В связи с этим трехкомпонентные системы с граничными растворами переменного состава служат основой многочисленных промышленных сплавов, упрочняемых термической обра боткой.
3.1 Диаграммы состояния систем с моновариантным эвтектическим равновесием
3.3.1. Эвтектический разрыв растворимости в одной их двойных систем
Рассмотрим вначале случай, когда в одной из двухкомпонентных сис тем, образующих тройную систему АВС, возникает эвтектический разрыв растворимости. В двух других двойных системах компоненты образуют не прерывный ряд твердых растворов.
Диаграмма состояния тройной системы для подобного случая показана в объеме на рисунке 3.1,а, а в виде проекции на плоскость концентрационно го треугольника – на рисунке 3.1,б.
Примем, что ТА > TB > TC. Буквами a′, e′ и b′обозначим точки, характе ризующие нонвариантное трехфазное равновесие Ж α+β в двойной системе ВС. Они являются конечными точками трех моновариантных кривых a′k′, b′k′ и e′e′1, характеризующих то же равновесие в тройной системе.
45

Поскольку компоненты А и В, так же как А и С неограниченно смеши ваются в твердом состоянии, эвтектический разрыв растворимости замыкает ся внутри диаграммы состояния. Эвтектическая кривая, идущая из точки e′, прерывается внутри тройной диаграммы в некоторой точке e1′, лежащей при той же температуре, что и точка k′. Поэтому кривые a′k′ и b′k′, идущие из то чек a′ и b′, ограничивающих разрыв растворимости в двойной системе, обра зуют одну непрерывную кривую с точкой их встречи k′. Точка e′1 может на ходиться как выше, так и ниже ТС. На рисунке 3.1,а она принята выше точки плавления компонента С, т.е. выше С′.
Рассмотренные точки на проекции диаграммы состояния (рисунок 3.1,б) обозначены без знака « ′ ». Стрелки на моновариантных кривых и их проекциях показывают направление понижения температуры.
а |
б |
Рисунок 3.1 – Диаграмма состояния системы АВС с эвтектическим разрывом рас творимости в одной из двойных систем (случай с максимальной критической точкой на моновариантных кривых) (а) и проекция этой диаграммы на плоскость концентрационно го треугольника (б)
Таким образом, кривая двойной эвтектики e'e1' имеет ограниченное распространение. Она оканчивается на поверхности ликвидуса. Характер пе ресекающихся поверхностей ликвидуса на кривой двойной эвтектики можно представить путем изгиба листа бумаги в ограниченных пределах. Модель такой системы приведена на рисунке 3.2.
46
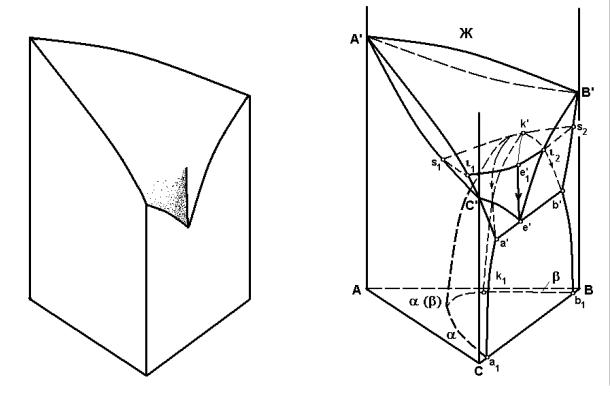
Если диаграмму состояния тройной системы пересечь горизонтальной плоскостью, соответствующей температуре критической точки k′ (или точки e1'), то получим изотермы ликвидуса ι1ι2 и солидуса s1s2 (рисунок 3.3). В се чение попадает плоскость s1k′s2ι2e1'ι1s1.
Рассмотрим поверхности диаграммы состояния.
Ликвидус системы состоит из трех поверхностей. С'e'e'1ι1С' – это по верхность ликвидуса αраствора, ι2e'e'1ι2 – поверхность ликвидуса βраствора (рисунок 3.3). Кривая e′e′1 является общей для этих двух поверхностей. На эвтектической кривой e′e′1 жидкость насыщена как α, так и βкристаллами.
Рисунок 3.2 Модель поверхности ликвидуса |
Рисунок 3.3 – Диаграмма состояния |
тройной системы с выклиненной гетерогенной |
тройной системы с изотермами |
областью |
при Т=Те1′ |
Часть поверхности ликвидуса системы A'B'ι2e'1ι1A', находящаяся за изотермой ι1e'1ι2, проходящей через точку e'1, отвечает непрерывному ряду твердых растворов и может быть названа как поверхностью ликвидуса α раствора, так и поверхностью ликвидуса βраствора.
Поверхность солидуса A's1С′a′k′b′s2B'A' непрерывна на всем протяже нии (рисунок 3.3). Часть этой поверхности С′s1k′a′С′, лежащая влево от кри вой a′k′, является поверхностью солидуса αраствора, а часть k′s2b′k′ по верхностью солидуса βраствора. За изотермой s1k's2, проходящей через точ ку k', поверхность солидуса отвечает непрерывному ряду твердых растворов и может быть названа как поверхностью солидуса α, так и поверхностью со лидуса βраствора.
47

На изотермическом сечении ι1e'1ι2s2k′s1ι1 лежит двухфазная область, от вечающая первичной кристаллизации непрерывного ряда твердых растворов, которую можно назвать как областью Ж+α, так и областью Ж+β.
Кривая a′k′ является общей кривой поверхности солидуса С′s1k′a′С′ и поверхности растворимости a′k′k1а1a′, а кривая b'k' – общей кривой поверхно сти солидуса k′s2b′k′ и поверхности растворимости b′k′k1b1b′. Изотерма a1k1b1 ограничивает поверхности растворимости при Ткомн.. Общую кривую k′k1 на поверхностях растворимости называют критической кривой.
В пересечении с любой изотермической плоскостью (от Те1′ до Те′) кри вые a′k′, b'k' и e′e′1 дают три сопряженные точки фаз, участвующих в трех фазном равновесии Ж α + β. В общем случае эти три точки (триада точек) не лежат на одной прямой, как в двойной системе ВС. Сторонами треуголь ника являются коноды, относящиеся к двухфазным превращениям, предше ствующим трехфазному (Ж α и Ж β) или идущему вслед за ним (α β). Трехфазный треугольник может быть назван поэтому конодным т реугольни ком.
Соединяя конодами каждую триаду сопряженных точек кривых a′k′, b'k' и e′e′1, можно получить серию конодных треугольников. Проекции трех таких конодных треугольников на плоскость концентрационного треуголь ника показаны на рисунке 3.4.
Рисунок 3.4 – Образование линейчатых поверхностей диаграммы состояния
Нижним конодным «треугольником» является эвтектическая горизон таль a′e′b′ (в двойной системе ВС, рисунок 3.3), которую следует рассматри вать как вырожденный в прямую линию треугольник с вершинами a′, e′ и b′
48

(линия aeb на рисунке 3.4). В тройной системе этот вырожденный в прямую треугольник переходит в нормальный. Его вершина y3 не совпадает более с основанием x3z3. По мере удаления треугольника от стороны ВС основание его будет все более удаляться от вершины (см. положение точек y3, y2 и y1 на рисунке 3.4). Вместе с тем вершины x3 и z3, x2 и z2, x1 и z1 конодного тре угольника, прилежащие к его основанию, будут постепенно сближаться, пока не сольются в одну при достижении точки k, где оба твердых раствора α и β становятся идентичными. Следовательно, точка k′ (см. рисунок 3.3), является критической точкой, отвечающей верхней температуре трехфазного равнове сия. При критической температуре конодный треугольник вырождается в прямую линию, концевыми точками которой является критическая точка k′ и верхняя точка e′1 эвтектической кривой e′e′1 (прямая e1k на рисунке 3.4).
Коноды x1z1, x2z2, x3z3 и т.д. образуют линейчатую поверхность конца кристаллизации двойной эвтектики α+β. Эта же поверхность является частью солидуса системы.
Коноды x1y1, x2y2, x3y3 и z1y1, z2y2, z3y3 и т.д. образуют две линейчатые поверхности начала кристаллизации двойной эвтектики α+β.
Конечная структура в том или ином тройном сплаве определяется со ставом сплава. Например, тройные сплавы, фигуративная точка которых на ходится в области ABb1k1a1CA (рисунок 3.5), имеют по две критические точ ки, отвечающие температурам начала и конца кристаллизации твердого рас твора. После затвердевания они имеют одну структурную составляющую кристаллы тройного твердого раствора α (или β).
Рисунок 3.5 – Положение фигура тивных точек сплавов
Сплав М (рисунок 3.5) имеет три критические точки. Первая точка принадлежит поверхности ликвидуса αраствора, вторая точка – поверхности
49
