
Тройные диаграммы
.pdf
температуре Tk соответствует отрезку d′n′ (или dn в проекции). Количества фаз в сплаве при данной температуре, согласно правилу рычага, равны
|
|
kn |
¢ |
|
|
¢ |
|
|
||
m |
= |
|
|
× m |
; m |
= |
d k |
× m |
. |
|
|
|
¢ |
|
|||||||
Жd′ |
¢ |
|
сплава |
αn′ |
¢ ¢ |
сплава |
|
|||
|
|
d n |
|
|
|
|
d n |
|
|
|
При дальнейшем понижении температуры от Тk до Т2 состав α изменя ется по кривой n′2′ (nN в проекции), а состав жидкой фазы – по кривой d′4′ (d4 в проекции). В процессе кристаллизации сплава конода скользит по фи гуративной линии сплава и при этом поворачивается в сторону более легко плавкого компонента. Кристаллизация сплава N закончится при температуре T2, когда все кристаллы α будут иметь состав исходного сплава. При этом последнее положение коноды соответствует отрезку 2′4′ (или N4 в проекции).
Рисунок 2.7 Изменение составов жидкой и твердой фаз при кристаллизации
Вторую стадию кристаллизации сплава можно записать в виде реакции:
T1−T2
Ж1′−4′ ® α3′−2′,
30

или в проекциях
T1−T2
Ж3−N → αN4.
При дальнейшем охлаждении до комнатной температуры Тком в сплаве N не происходит фазовых превращений.
Кривая охлаждения сплава N и структура его после равновесной кри сталлизации представлены на рисунке 2.8,а и б. При реальных скоростях кристаллизации отливок или слитков выравнивающая диффузия в твердой фазе протекает не полностью и в образующихся кристаллах αтвердого рас твора возникает внутрикристаллитная ликвация, которую можно выявить травлением шлифа (рисунок 2.8,в). Для устранения ликвации проводят от жиггомогенизацию при температурах, близких к солидусу сплава. В резуль тате этого отжига состав во всех участках αкристаллов выравнивается и со ответствует составу сплава. Структура после гомогенизационного отжига аналогична структуре сплава после равновесной кристаллизации (рисунок
2.8,б).
Рисунок 2.8 – Кривая охлаждения сплава N (а) и его структура после равновесной кристаллизации или гомогенизационного отжига (б) и после литья (в)
Аналогично сплаву N кристаллизуются другие сплавы этой системы. Необходимо отметить, что все сплавы, фигуративная точка которых
расположена на одной изотерме ликвидуса, начинают кристаллизоваться при одной и той же температуре. Так, кристаллизация сплавов, находящихся на изотерме ликвидуса аb (см. рисунок 2.3,а), начинается при 950оС.
Все сплавы, расположенные на одной изотерме солидуса, заканчивают кристаллизацию так же при одной и той же температуре. Например, кристал лизация сплавов, фигуративная точка которых расположена на изотерме со лидуса cd (см. рисунок 2.3,б), заканчивается при 700оС.
Имея экспериментально построенные или теоретически рассчитанные изотермы ликвидуса и солидуса системы, можно определить температуры
31

начала и конца кристаллизации любого тройного сплава. Например, сплав N начинает кристаллизоваться при 935 оС (см. рисунок 2.3,а), а заканчивает при 840 оС (см. рисунок 2.3,б).
Изотермические сечения диаграммы состояния тройной системы по зволяют получать все необходимые сведения о составах вступающих в рав новесия фаз и об их относительных количествах при данной температуре.
Диаграмма состояния в настоящее время – это продукт эксперимен тальной работы, теоретическое построение ее еще недостижимо.
Построение тройных систем обычно осуществляют путем исследова ния процессов, происходящих при нагреве и охлаждении сплавов, фигура тивные точки состава которых находятся на определенной прямой, прове денной внутри концентрационного треугольника (например, на прямой pq на рисунке 2.9 или Bk на рисунке 2.10). В результате исследований, проведен ных, например, методом термического анализа, определяют температуры фа зовых превращений в сплавах и строят политермические разрезы диаграмм состояния.
На политермических разрезах имеются линии температур фазовых пре вращений, которые делят разрез на определенные фазовые области. На пред ставленных разрезах (рисунки 2.9 и 2.10) верхняя линия – линия ликвидуса твердого раствора α, а нижняя – линия солидуса. Между этими линиями на ходится область двухфазного состояния сплавов. Выше линии ликвидуса и ниже линии солидуса расположены области жидкого или твердого раствора соответственно.
По политермическому разрезу нельзя определить количество равновес ных фаз в сплаве в определенный момент кристаллизации или плавлении, так как коноды, соединяющие фигуративные точки равновесных фаз, в общем случае не находятся в плоскости разреза.
Рисунок 2.9 Построение политермического разреза pq
32
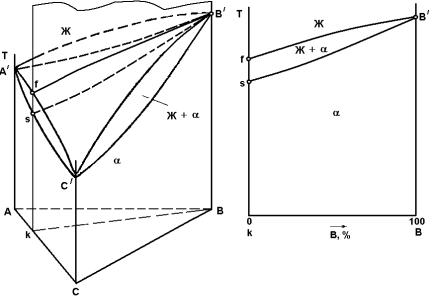
Рисунок 2.10 Построение политермического разреза kB
На политермическом разрезе можно определить только температуры начала и конца кристаллизации сплавов. Эти сведения являются очень важ ными при выборе оптимальных режимов плавки, литья, горячей деформации и термической обработки.
Лекция 6
План лекции
Диаграммы состояния систем с экстремальными складками и точками на поверхностях ликвидуса и солидуса.
Диаграмма состояния системы с бинодальной поверхностью. Системы с упорядоченными твердыми растворами. Реальные системы NbMoW и AuNiPd.
2.2. Диаграммы состояния систем с экстремальными складками и точками на поверхностях ликвидуса и солидуса
Образованию непрерывного ряда тройных твердых растворов удовле творяет не только рассмотренный нами тип диаграммы состояния (лекции 4 и
33
5). Число возможных простейших их разновидностей при трех компонентах значительно больше, чем для двойной системы.
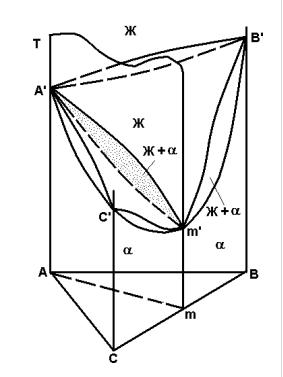
Если в одной из двойных систем (например, ВС, рисунок 2.11) на кри вых ликвидуса и солидуса имеется точка минимума m′, то на поверхностях ликвидуса и солидуса в пространственной диаграмме состояния появляется соответствующая складка.
Рисунок 2.11 – Диаграмма состояния тройной системы с экстремальными складками
О характере поверхностей ликвидуса и солидуса в области этой склад ки можно судить по политермическому разрезу Аm, на котором кривые лик видуса и солидуса не касаются. Все тройные сплавы, в том числе и разреза Аm (за исключением двойного сплава, фигуративная точка которого m), кри сталлизуются в интервале температур между поверхностями ликвидуса и со лидуса и на кривых охлаждения имеют по две критические точки.
Рассмотрим три основных типа разновидностей диаграмм состояния с экстремальными точками на поверхностях ликвидуса и солидуса:
а) с максимальной точкой; б) с минимальной точкой; в) с седловидной точкой.
Остальные разновидности диаграмм состояния не представляют ничего принципиально нового.
Диаграмма состояния типа а, с максимальными точками на поверхно стях ликвидуса и солидуса в самой тройной системе АВС и на кривых лик видуса и солидуса двойных систем АВ, ВС и АС показана на рисунке 2.12 в пространстве и проекциях.
34

Поверхности ликвидуса и солидуса тройной системы имеют семь об щих точек: A′, B′, C′, m1′, m2′, m3′ и M′ (на проекции диаграммы состояния точки A, B, C, m1, m2, m3 и M). Жидкая и твердая α фазы, находящиеся в равновесии при температуре максимума ТМ′, являются одинаковыми по со ставу. При температуре ТМ′ система ведет себя как однокомпонентная. Сплав, отвечающий по составу точке М′ (точка М на рисунке 2.12,б), затвердевает при постоянной температуре. При всех прочих температурах двухфазного равновесия Ж α составы сосуществующих фаз в тройной системе различа ются.
а |
б |
Рисунок 2.12 – Пространственная диаграмма состояния тройной системы с непрерывным рядом твердых растворов с максимальной точкой на поверхностях ликвидуса и солидуса (а) и проекция диаграммы состояния на плоскость концентрационного треугольника (б)
Представление об изотермических сечениях рассматриваемой диа граммы состояния дает рисунок 2.12,б, на котором показаны сечения, отве чающие температурам максимумов M′, m1′, m2′ и m3′. Изотермы ликвидуса изображены на рисунке сплошными кривыми, а изотермы солидуса – пунк тирными. Изотермическое сечение, отвечающее температуре максимума ТМ′, вырождается в точку М. В точках, отвечающих максимумам в двойных сис темах m1, m2 и m3, изотермы ликвидуса и солидуса имеют общую точку, в ко торой они касаются друг друга.
Политермические разрезы диаграммы состояния представлены на ри сунке 2.13. Положение вертикальных плоскостей показано в виде линий Аm3
и kg.
35

На поверхностях ликвидуса и солидуса тройной системы может также встречаться точка минимума М′ (рисунок 2.14). Сплав М, отвечающий по со ставу этой точке, на кривой охлаждения имеет одну критическую точку. Эта диаграмма принципиально не отличается от рассмотренной выше.
Диаграмма состояния системы с седловидной точкой на поверхностях ликвидуса и солидуса изображена на рисунке 2.15. Седловидная точка М′ это общая точка обеих поверхностей. В одних направлениях она является минимальной точкой поверхностей, в других – максимальной. В аналитиче ской геометрии ее поэтому называют также точкой минимакса. В этой точке, как и в точках максимума и минимума (см. рисунки 2.122.14), система ведет себя как однокомпонентная.
Рисунок 2.13 Изотермические разрезы Аm3 и kg диаграммы состояния, представленной на рисунке 2.12.
Рисунок 2.14 – Диаграмма состояния с не прерывным рядом твердых растворов и с минимальной точкой на поверхностях лик видуса и солидуса
36

Рисунок 2.15 – Диаграмма состояния с непрерывным рядом твердых растворов и с седловидной точкой на поверхностях ликвидуса и солидуса
Изотермический разрез, проходящий в диаграмме состояния через сед ловидную точку М′, показан на рисунке 2.16,б.
а |
б |
Рисунок 2.16 – Построение изотермического разреза при температуре седловидной точки М′(а) и изотермический разрез (б)
37

Кривые ι1М′, ι2М′, ι3М′ и ι4М′ являются изотермами ликвидуса, а кри вые s1M′, s2M′, s3M′ и s4M′ изотермами солидуса. Эти же изотермы показаны на поверхностях ликвидуса и солидуса (рисунок 2.16,а). Видно, что часть по верхности ликвидуса и часть поверхности солидуса системы находятся выше горизонтальной плоскости. Другие их части лежат ниже этой плоскости.
2.3. Диаграмма состояния системы с бинодальной поверхностью
Диаграмма состояния тройной системы АВС с бинодальной поверх ностью ak′k1b представлена на рисунке 2.17. Для этой системы помимо би вариантного равновесия Ж α характерно равновесие двух твердых раство ров α1α2 (расслоение в твердом состоянии). Точка k′ критическая точка в двойной системе АВ.
Кривая k′k1 делит поверхность ak′k1b на две части: ak′k1 и bk′k1. Каждая из этих меньших поверхностей изображает составы насыщенных один отно сительно другого твердых α1 и α2растворов в сплавах области аk1b при тем пературах от Тk′ до комнатной Ткомн.. Растворы α1 и α2 имеют одинаковую кристаллическую структуру и отличаются один от другого только составом.
Рассмотрим фазовые превращения, протекающие в сплавах при пони жении температуры, используя проекцию диаграммы состояния на плоскость концентрационного треугольника (рисунок 2.18,а). Сплав М принадлежит области akk1. Он имеет три критические точки. Точка 1 находится на поверх ности ликвидус, точка 2 – на поверхности солидуса αраствора. Точка 3 при надлежит бинодальной поверхности. Кривая охлаждения сплава М приведе на на рисунке 2.18,б.
Рисунок 2.17 – Диаграмма состояния тройной системы с бинодальной поверхностью
38

а |
б |
Рисунок 2.18 – Проекция диаграммы состояния системы с бинодальной поверхностью (а) и кривые охлаждения сплавов (б)
При температуре ниже Т3 из α1кристаллов, богатых компонентом А, начинают выделяться α2кристаллы, богатые компонентом В. При пониже
нии температуры от Т3 до Ткомн. Составы α1 и α2 изменяются.
Сплав N (рисунок 2.18,а), фигуративная точка которого расположена на кривой kk1, также имеет три критические точки. При температуре ниже Т6 αкристаллы расслаиваются на микрообъемы разного состава, обогащенные соответственно компонентами А и В. Чем ниже температура (относительно бинодальной поверхности ak′k1b), тем больше разница в составах α1 и α2 кристаллов (микрообъемов).
2.4. Диаграмма состояния тройной системы с упорядоченными твердыми растворами
Диаграмма состояния тройной системы АВС с упорядоченными твер дыми α′растворами изображена на рисунке 2.19. Наряду с равновесием Ж α в этой системе наблюдается равновесие неупорядоченного α и упоря доченного α′ растворов, т.е. α α′.
В неупорядоченном твердом растворе атомы компонентов А, В и С беспорядочно располагаются по узлам кристаллической решетки. Упорядо ченный раствор характеризуется закономерным расположением атомов ком понентов в узлах кристаллической решетки. Максимальную степень дальнего порядка в двойной системе ВС имеет сплав стехиометрического состава
BmCn.
39
