
- •Часть I. Введение в предмет 9
- •2.1. Организация хирургической помощи
- •Часть I I
- •Глава 3. Общий уход
- •4.6. Отделение реанимации и интенсивной терапии
- •Глава 5. Асептика
- •5.1. Виды и распространенность хирургической инфекции
- •Глава 6. Антисептика
- •Глава 7. Боль и обезболивание
- •I. Оценка общего состояния больных
- •II. Оценка объема и характера операции
- •III. Оценка характера анестезии
- •Глава 8. Переливание крови и ее компонентов
- •0(1)Ар а(н)в в(ш)а ab(IV)0
- •8.4. Трансфузионные средства
- •I. Прямое (непосредственное) переливание крови
- •II. Непрямое (опосредованное) переливание крови
- •III. Обратное переливание (реинфузия) крови
- •Глава 9. Водно-электролитные нарушения
- •9.1. Основные причины нарушений водно-электролитного баланса
- •Глава 10. Нарушения свертывания крови у хирургических больных и методы их коррекции
- •10.1. Коагуляционная система
- •Глава 11. Кровотечение
- •II. Вид кровоточащего сосуда:
- •III. Клинические проявления:
- •Глава 12. Питание хирургических больных
- •12.4.1.1. Зондовое питание
- •Глава 13. Эндогенная интоксикация в хирургии и принципы ее коррекции
- •13.1. Основные виды эндотоксикоза у хирургических больных
- •Глава 14. Неоперативная хирургическая техника
- •14.1. Десмургия
- •14.1.1. Основные перевязочные материалы
- •14.13, Б).
- •14.3.2.6. Пункция плевральной полости
- •Глава 15. Обследование хирургических больных
- •Глава 16. Критические нарушения жизнедеятельности у хирургических больных
- •Глава 17. Основы гнойно-септической хирургии
- •17.2.1. Фурункул
- •17.2.4. Рожа
- •17.4.2. Паротит
- •18.4. Травма груди
- •Повреждения живота
- •18.10.3. Электротравма
- •19.2.2. Лечение и профилактика тромбоэмболии венозных сосудов
- •19.4. Некроз
- •20.1. Общая характеристика опухолей
- •20.4. Клиническая диагностика опухолей
- •20.5. Лечение онкологических больных
- •22.1. Эхинококкоз
- •22.3. Аскаридоз
- •23.1. Пороки развития костей черепа
- •23.2. Пороки развития головного мозга
- •23.3. Пороки развития лица
- •26.1. Предоперационный период
17.4.2. Паротит
Паротит (parotitis) — гнойное воспаление околоушной железы. Возбудителями чаще являются стафилококки; проникают чаще из полости рта. Благоприятным условием для восходящей инфекции в железу по протоку околоушной железы (стенонов проток) является уменьшение или прекращение выделения слюны. Микроорганизмы могут проникнуть в околоушную железу также лимфогенным или гематогенным путем. Развиваются воспаление выводного протока железы, отек его слизистой оболочки, нарушение оттока слюны. Застой секрета усугубляет развитие воспаления, которое с протоков переходит на железистую ткань. Вначале воспаление носит характер серозного, затем наступает гнойная инфильтрация долек железы. Образовавшиеся мелкие гнойные очаги сливаются между собой с образованием абсцесса. Развившийся тромбоз сосудов железы приводит к образованию участков некроза. Гнойный процесс может обусловить расплавление капсулы железы и образование гнойных затеков в области шеи, виска, наружного слухового прохода.
Клиническая картина. В области околоушной железы рано появляется болезненная, увеличивающаяся припухлость, при пальпации которой боли
451

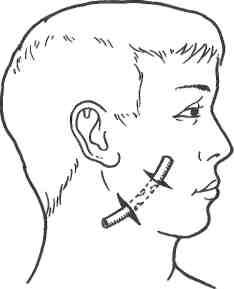
Рис. 17.13. Вскрытие абсцесса околоушной железы у ее нижнего полюса одним разрезом (а); двумя разрезами и дренирование трубкой (б) [Гостищев В. К., 2002].
усиливаются. Темпе ратура тела повышает ся до 39-40 °С. Из-за болей затрудняются жевание и глотание. Напряжение тканей с каждым днем увели- а чивается, кожа истон-
чается, краснеет; в глубине ощущается нечеткая флюктуация. Общее состояние больного непрерывно ухудшается, отечность тканей распространяется на шею, щеку, подчелюстную область. При особенно тяжелом течении отмечается также отечность мягкого неба и боковой стенки глотки. Открывание рта резко затруднено вследствие сведения челюстей в результате распространения воспаления и отека на жевательные мышцы. У некоторых больных отмечается парез лицевого нерва. Исследование крови в этот период указывает на нарастание количества лейкоцитов за счет нейтрофильных форм. При дальнейшем развитии паротита, если не предпринято эффективное консервативное или оперативное лечение, гной расплавляет часть капсулы железы, выходит в подкожную клетчатку с образованием флегмоны, прорывается наружу через кожу, и образуются свищи. Кроме обильного гнойного отделяемого, через свищи выходят секвестры омертвевшей паренхимы и капсулы железы.
В зависимости от формы паротита лечение может быть консервативным или оперативным. Основой консервативного лечения является антибиотико-терапия. Необходимо ограничить движения нижней челюсти (протертая пища, ограничение разговоров).
Если консервативные меры оказываются безуспешными и развивается гнойный паротит, показано оперативное лечение, цель которого — вскрытие гнойных очагов в железе и создание хорошего оттока гноя (рис. 17.13).
При наличии флюктуации разрез обычно делают в месте наибольшего размягчения. Производя разрез, необходимо учитывать направление основных ветвей лицевого нерва. Разрез должен идти параллельно, но ни в коем случае не перпендикулярно к ним. Рассекают кожу, подкожную клетчатку и обнажают капсулу околоушной железы. После надсечения капсулы тупо пальцем или пинцетом осторожно проникают в гнойник, удаляют гной, секвестры и дренируют полость. При этом вмешательстве всегда велика опасность пареза ветвей лицевого нерва, который может быть вызван растяжением их при тупом расширении раны.
В послеоперационном периоде назначают антибиотики, обезвоженным больным — инфузионную терапию и жидкую высококалорийную пищу.
Прогноз при рано диагностированном и рациональной антибиотикотера-пии паротита благоприятный. Гнойный паротит при своевременном и радикальном оперативном лечении в сочетании с антибиотикотерапией обычно не сопровождается тяжелыми осложнениями.
452
17.5. Гнойные заболевания серозных полостей 17.5.1. Перитонит
Перитонит (peritonitis; греч. peritonain — брюшина + -itis) — воспаление брюшины, сопровождающееся тяжелой эндогенной интоксикацией.
Классификация перитонита. Существует несколько классификаций перитонита. Согласно одной из них (Межведомственный научный совет по хирургии РАМН и Минздрава РФ, 1999), перитонит классифицируют по следующим признакам.
По распространенности процесса:
местный;
распространенный: а) диффузный (выходит за пределы зоны воспаления и охватывает рядом расположенные зоны); б) разлитой (охватывает значительную или всю зону брюшной полости).
По характеру экссудата:
серозный;
серозно-фибринозный;
гнойный.
Распространенность перитонита определяется количеством вовлеченных в воспалительный процесс областей брюшной полости. Для этого переднюю брюшную стенку делят на 9 областей четырьмя условно проведенными линиями: двумя вертикальными — по наружным краям прямых мышц живота, двумя горизонтальными — соединяющими нижние края реберных дуг и передне верхние ости подвздошных костей (рис. 17.14).
Местный перитонит:

в воспалительный процесс вовлечено не более 2 из 9 анатомических областей;
очаг воспаления отграничен от остальной брюшной полости за счет сальника, петель кишечника, фибрина;
локализация очага воспаления различна: связанная с непосредственным источником инфекции в брюшной полости (червеобразным отростком, желчным пузырем, зоной перфорации полого органа или его повреждении) либо вдали от источника инфекции (между петлями кишечника, в малом тазе, под диафрагмой);
гнойно-воспалительные процессы захватывают более двух анатомических областей, если имеется четко выраженная граница воспаления;
зона воспаления вокруг источника инфекции в брюшной полости не имеет демаркации, и процесс в результате лечения может
Рис. 17.14. Условное деление брюшной полости на 9 анатомических областей [Чернышев В. Н., 2000].
453

Рис. 17.15. Масштабно-координатная схема (скица).
1 — селезенка; 2 — печень; 3 — желудок; 4 — двенадцатиперстная кишка; 5 — корень брыжейки тонкой кишки; 6 — мыс крестца; 7, 8 — восходящая и нисходящая ободочная кишка.
регрессировать или (без лечения) распространяться на остальные области брюшной полости.
Распространенный перитонит:
зона воспаления брюшины захватывает более двух анатомических областей без четкого отграничения процесса;
диффузный перитонит — зона воспаления брюшины не имеет четких границ и захватывает от 2 до 5 анатомических областей брюшной полости;
• разлитой перитонит — воспали тельный процесс захватывает бо лее 5 анатомических областей, а нередко и всю брюшную полость.
Применяют и другие способы объективизации распространенности перитонита.
Графический метод [Павлов О. И., 1981] (рис. 17.15) основан на измерении площади проекции зоны распространения экссудата на уменьшенный (1:3) контур брюшной полости. Контур является проекцией всех внутренних органов с учетом их топографоанатомических взаимоотношений. Определенный участок поражения брюшины пропорционален соответствующему участку на контуре. Границы распространения процесса определяют визуально во время операции при ревизии брюшной полости. При составлении протокола операции хирург заштриховывает на масштабно-координатной схеме участок, соответствующий зоне поражения, отражающий локализацию процесса. После подсчета общего количества заштрихованных клеток, каждая из которых соответствует 1 % площади брюшины, схему подклеивают вместе с протоколом операции в историю болезни, а процент поражения выносят в диагноз.
У многих больных клиническое течение перитонита зависит не только от степени поражения брюшины (что, безусловно, является главным), но и от многих других факторов — возраста, сопутствующих заболеваний, состоянием иммунитета.
Для оценки степени тяжести перитонита разработаны несколько шкальных систем, включающих различные факторы риска, например Мангейм-ский перитонеальный индекс (МИП) (табл. 17.3).
МИП предусматривает три степени тяжести перитонита. При индексе менее 20 баллов (I степень тяжести) летальность составляет 0 %, от 20 до 30 баллов (11 степень тяжести) — 29 %, более 30 баллов (III степень тяжести) - 100 %.
Этиология и патогенез. Воспаление брюшины может быть вызвано механическим, термическим или химическим воздействиями при закрытых по-
454
|
Фактор риска |
Оценка тяжести, баллы | |
|
Возраст старше 50 лет Женский пол |
5 5 | |
|
Наличие органной недостаточности Наличие злокачествен- |
7 4 | |
|
ной опухоли Продолжительность перитонита более 24 ч Толстая кишка как ис- |
4 4 | |
|
точник перитонита Перитонит диффузный Экссудат Прозрач-(только ный |
6 0 | |
|
один ответ): |
Мутно- |
6 |
|
|
гнойный Калово- гнилостный |
12 |
Перитонит — инфекционное заболевание преимущественно полимикробной этиологии — доминирующими являются грамотрица-тельные бактерии (в основном Еп-terobacteriaceae), как правило, в сочетании с анаэробными микроорганизмами (Bacteroides fragilis, Bacteroides spp., Fusobacterium spp., Clostridium spp.). Реже выделяются стафилококки. Энтерококки часто выделяются в ассоциации с другими бактериями из перитоне-альной жидкости у больных с перитонитом, однако их этиологическая роль остается неясной. P. aeruginosa редко является первичным этиологическим агентом при перитоните вследствие перфорации органа, однако ее значение существенно возрастает при послеоперационных перитонитах.
Основные патогенетические механизмы перитонита:
попавшая в брюшную полость инфекция;
нарушения нейроэндокринной регуляции и нейрогуморального равновесия: повышение активности симпатико-адреналовой системы приводит к нарастанию концентрации катехоламинов в крови, что сопровождается угнетением холинергических реакций и торможением перистальтической активности желудочно-кишечного тракта;
гиповолемия и расстройства центральной гемодинамики, нарушения обмена жидкости, а также депонирование крови в системе воротной вены приводят к снижению ОЦК. Это в свою очередь обусловливает артериальную гипотензию и падение ЦВД до нуля и ниже;
расстройства кровообращения в виде нарушений органной и тканевой микро- и макрогемодинамики, что в большой степени зависит от изменений реологических свойств крови. Возникшие в результате и на
Схема 17.2. Факторы, способствующие развитию перитонита
|
Этиология перитонита | |||
|
|
|
|
|
|
При деструктивных процессах и перфорациях органов |
|
|
Послеоперационный |
|
|
' |
' |
|
|
1' |
|
1 | |
|
Травматический |
|
Огнестрельный | |
455
фоне тяжелой
гипоксии изменения в тканях и органах
еще больше способствуют прогрессированию
перитонита и развитию полиорганной
недостаточности;
депонирование
белков крови в тканях и межклеточном
пространстве, расстройства
белоксинтезирующей функции печени,
усиленный распад белка вследствие
интоксикации и алиментарное голодание,
приводящие в выраженной гипопротеинемии;
нарушения
водно-электролитного и кислотно-основного
состояния в результате массивной
потери жидкости и электролитов, что
приводит к усугублению гиповолемии и
развитию метаболического ацидоза.
Большие потери ионов калия (до 100
ммоль/л) с мочой и с жидкостью,
«секвестрированной» в просвете
желудочно-кишечного тракта, а также
снижение содержания хлоридов (от 100 до
300 ммоль/л) способствуют нарастанию
ацидоза;
|
Симптом пери- |
Характеристи- |
Частота наблюде- |
|
тонита |
ка симптомов |
ний, % |
|
Жалобы на |
Локальные |
31,7 |
|
боли в животе |
Разлитые |
31,0 |
|
|
Нет |
37,3 |
|
Положение |
Вынужденное |
90,5 |
|
больного |
|
|
|
|
Свободное |
9,5 |
|
Рвота |
Есть |
8,3 |
|
Жажда |
Есть |
95,1 |
|
Напряжение |
Разлитое |
63,3 |
|
передней |
Локальное |
19,7 |
|
брюшной |
Нет |
17,0 |
|
стенки при |
|
|
|
пальпации |
|
|
|
Выявляются |
Щеткина— |
54,9 |
|
симптомы |
Блюмберга |
|
|
|
Розанова |
53,7 |
|
|
Мондора |
22,5 |
|
|
Роздольского |
19,7 |
|
|
Бартомье— Михельсона |
19,0 |
|
|
Образцова |
20,4 |
|
|
Воскресенского |
14,8 |
|
|
Ситковского |
17,3 |
|
|
Элекера |
14,1 |
|
|
Гейнеке |
21,8 |
|
|
Хендри |
16,2 |
|
|
Питса |
19,4 |
|
|
Белленса |
18,3 |
|
|
«Пупка» |
19,7 |
|
|
«Френикус»- симптом |
49,3 |
|
|
«Ваньки-встаньки» симптом |
40,8 |
• гипоксия, развивающаяся как вследствие тотальных нарушений микроциркуляции, так и вследствие нарушений функции легких.
Клиническая картина. Клинические проявления перитонита многообразны и меняются в зависимости от распространенности процесса, исходного состояния пациента, особенностей течения заболевания, возраста больного, наличия тяжелого сопутствующего заболевания, истощения, алкогольной и другой интоксикации, предшествующей антибактериальной терапии, приема обезболивающих средств.
Практически все известные симптомы перитонита можно обнаружить при обследовании больных, но в разные периоды развития воспаления их набор и преобладание тех или других различны (табл. 17.4).
В первые часы заболевания ведущими симптомами являются резкие постоянные боли, усиливающиеся при перемене положения тела, кашле, движениях — болевой синдром соответствует клинической картине острого хирургического заболевания какого-либо органа брюшной полости. Впоследствии характер болевого синдрома существенно меняется. Боли из области первоисточника перитонита распространяются на другие отделы брюшной полости, а при распространенном перитоните определяются при пальпации всей
456
Продолжение
|
Симптом перитонита |
Характеристика симптомов |
Частота наблюдений, % |
|
Притупление |
Есть |
69,0 |
|
в отлогих мес- |
|
|
|
тах живота |
|
|
|
Выявляется |
Разлитая |
59,9 |
|
болезнен- |
Локальная |
22,5 |
|
ность при |
Нет |
17,6 |
|
пальпации |
|
|
|
Задержка сту- |
Есть |
33,8 |
|
ла и газов |
|
|
|
Сухой обло- |
Есть |
95,1 |
|
женный язык |
|
|
брюшной полости. Иначе говоря, болевой синдром из ведущего проявления перитонита в первые часы и сутки заболевания уходит на второй план, уступая место другим симптомам, обусловленным развитием интоксикации.
Примечание.
Симптомы:
«Ваньки-встаньки»
(вынужденное положение больного,
при перемене которого боли усиливаются);
Кера
(«френикус»-симптом);
Элекера (иррадиация
боли в ключицу);
Гейнеке (развитие
раннего метеоризма);
Куленкампфа
(несоответствие болезненности и
напряжения брюшной стенки);
Хедри (иррадиация
боли в правое или левое подреберье, в
зависимости от повреждения печени
или селезенки, при надавливании на
мечевидный отросток грудины);
«пупка» (болезненность
в правом подреберье, появляющаяся
при надавливании и смещении пупка
вниз);
признаки Вейнерта
(ригидность левой боковой области
живота, выявляемая при одновременном
схватывании боковых областей обеими
руками);
Питса и Белленса
(перкуторно определяемое притупление
в левой половине живота при изменении
положения тела).
Рвота желудочным содержимым обычно не приносит облегчения. Вначале рвотные массы представляют собой содержимое желудка. По мере прогрессирования пареза кишечника в рвотных массах появляется примесь желчи и содержимого тонкой кишки.
Больной обычно лежит на спине или на боку с приведенными к животу ногами, щадит живот, избегает лишних движений.
При исследовании брюшной полости отмечаются отсутствие брюшного дыхания, вздутие живота. Пальпаторно определяются болезненность, напряжение мышц передней брюшной стенки, выявляются симптомы раздражения брюшины. Этот устойчивый симптомоком-плекс, объединяемый в синдром воспаления брюшины, является наиболее постоянным и достоверным клиническим признаком перитонита. Локализация болезненности и мышечного напряжения обычно соответствуют локализации и размерам очага воспаления брюшины.
У некоторых больных выявляется притупление в отлогих отделах
живота (выпот в брюшной полости), однако это поздний симптом, отражающий запущенную стадию болезни, когда в брюшной полости имеется не менее 500 мл экссудата. При аускультации живота выслушиваются ослабленные, редкие перистальтические шумы, а при тяжелом парезе они вообще отсутствуют.
Обращают на себя внимание заостренные черты лица, запавшие глаза, бледность кожи с серо-землистым и несколько синюшным оттенком, сухие губы, акроцианоз. Желтушная окраска кожи и склер свидетельствует о запущенном перитоните (печеночная недостаточность). Сознание сохранено, отмечаются беспокойство, чувство страха, которые сменяются заторможенностью, апатией; возможны возбуждение, эйфория. Температура тела повышается до 38—39 °С, но по мере прогрессирования болезни иногда снижается до 36 °С и менее. Разница между кожной и внутриректальной температурой достигает 2—4 °С (у здорового человека она не превышает 1 °С). Постоянно выявляется тахикардия до 120—140 уд/мин, пульс низкий, слабый. Тоны сердца приглушены, АД снижено.
457
Диагностика. При клиническом исследовании крови выявляются анемия, увеличение СОЭ, лейкоцитоз (до 14—30 • 109/л), сдвиг лейкоцитарной формулы влево. При тяжелом течении перитонита нередко определяется лейкопения, что является неблагоприятным признаком.
Естественной реакцией организма на проявления интоксикации являются изменения лейкоцитарной формулы крови, поэтому в 1941 г. врач-терапевт Я. Я. Кальф-Калиф предложил лейкоцитарный индекс интоксикации (ЛИИ), основанный на учете различных клеточных группировок лейкоцитарного ряда крови. Определяют ЛИИ по следующей формуле:
— (4 мц + Зю + 2п + с) • (пл.кл. + 1) J,J/lJ/l (мон. + лимф.) • (э + 1) '
где мц. — миелоциты, ю. — юные, п. — палочкоядерные, с. — сегментоядерные, пл.кл. — плазматические клетки, мон. — моноциты, лимф. — лимфоциты, э. — эози-нофилы. В норме ЛИИ 0,3—1,5. Увеличение индекса до 3,0 у.е. свидетельствует о преимущественно ограниченном характере воспалительного процесса в брюшной полости. Повышение ЛИИ до 4,0 у.е. и более указывает на распространенный характер воспаления брюшины и выраженную эндогенную интоксикацию организма.
Нетрудно заметить, что повышение ЛИИ связано с исчезновением эозинофилов, увеличением количества сегментоядерных, палочкоядерных, снижением числа лимфоцитов и моноцитов, появлением плазматических клеток, что свидетельствует об угнетении иммунных защитных сил, а появление в циркуляции молодых и незрелых форм свидетельствует о напряженности компенсаторных механизмов, обеспечивающих дезактивацию токсинов.
Лейкоцитоз крови не всегда является достаточным критерием тяжести перитонита, поэтому следует обращать внимание на морфологическое и биохимическое исследования лейкоцитов, которые позволяют правильнее оценить состояние больного. К этим методам относится определение степени регенеративного сдвига форм нейтрофилов (ГСН), который рассчитывают по формуле:
_ миелоциты + юные + палочкоядерные сегментоядерные
В норме этот показатель равен 0,05—0,08. При тяжелых формах перитонита индекс достигает 1—2.
При стертой клинической симптоматике, затруднениях клинической диагностики перитонита могут быть предприняты дополнительные исследования.
При обзорном рентгенологическом исследовании в вертикальном положении больных с распространенным перитонитом обнаруживают признаки функциональной кишечной непроходимости: выраженное вздутие всех отделов желудочно-кишечного тракта и скопление жидкого содержимого в просвете желудка и кишечника и др.
Важным признаком распространенного перитонита является наличие свободной жидкости в брюшной полости, которая выявляется на снимках, выполненных в горизонтальном положении больного, и характеризуется появлением однородных полигональных теней разных размеров, располагающихся между кишечными петлями, затемнением и расширением латеральных каналов.
Рентгенологическое исследование органов грудной клетки выявляет смещение кверху и ограничение подвижности диафрагмы, дисковидные ателектазы в базальных отделах легких, особенно при распространении воспалительного процесса на верхний этаж брюшной полости.
Эхографическое исследование позволяет объективно оценить динамику развития воспалительного процесса в брюшной полости
В особо сложных случаях, особенно на ранних этапах развития перитонита, предпринимают диагностическую лапароскопию {рис. 17.16). Получае-
458

мая при видеолапароскопия информация позволяет во всех случаях правильно поставить диагноз перитонита: выявляются экссудат и его характер (серозный, серозно-фибринозный, гнойный), а также изменения париетальной и висцеральной брюшины (гиперемия, отек, наложения фибрина) {рис. 17.17).
Лечение. Основывается на применении комплекса мероприятий патогенетического воздействия: хирургическом вмешательстве; антибактериальной терапии; интенсивной инфузионной терапии, направленной на дезинтоксикацию, улучшение микроциркуляции, компенсацию водно-электролитных, белковых и энергетических потерь; гипербарической оксигенации; афферентных методах активной гемокоррекции; борьбе с парезами и кишечной недостаточностью; лечении послеоперационных осложнений.
Оперативное лечение больных с перитонитом включает радикальное устранение источника перитонита, декомпрессию желудочно-кишечного тракта, тщательную санацию и рациональное дренирование брюшной полости.
Операцию проводят под общим обезболиванием или перидуральной анестезией как на этапе самой операции, так и в послеоперационном периоде.
Адекватным оперативным доступом является только срединная лапарото-мия.
После вскрытия брюшной полости выполняют новокаиновую блокаду рефлексогенных зон 0,25 % раствором новокаина в корень брыжейки тонкой, поперечной ободочной и сигмовидной кишки. Если операцию проводят под перидуральной анестезией, новокаиновую блокаду не проводят.
После вскрытия брюшной полости проводят предварительную санацию: с помощью электроотсоса максимально удаляют патологическую жидкость, оценивая характер и количество экссудата.
Для удаления гноя в брюшную полость вливают большое количество изотонического раствора хлорида натрия или фурацилина 1:5000. Брюшную полость осушают и уточняют особенности источника инфекции. В начале операции забирают патологическую жидкость из брюшной полости в стерильную пробирку для последующего исследования на характер находящейся в ней микрофлоры и ее чувствительность к антибиотикам.
459

Рис. 17.17. Диагностическая видеолапароскопия (распространенный перитонит). Одновременное обнаружение экссудата в подпеченочном пространстве (а); правом боковом канале (б); малом тазе (в); левом боковом канале (г).
При ревизии в первую очередь необходимо исключить наиболее частые причины возникновения перитонита, а именно прободную язву желудка или двенадцатиперстной кишки, острый деструктивный аппендицит, холецистит и панкреатит, повреждения полых органов. Для этого сначала поэтапно тщательно осматривают все органы верхнего этажа брюшной полости, а затем — нижнего. У женщин ревизию следует начинать с органов малого таза, осматривая матку и ее придатки, мочевой пузырь, сигмовидную кишку. Это позволяет подтвердить или исключить перитонит на почве гнойных гинекологических и онкологических заболеваний.
После выявления источника распространенного перитонита приступают к его устранению с помощью наименее травматичного и технически легко исполнимого хирургического пособия. В случае если удалить источник перитонита не представляется возможным, его следует надежно отграничить тампонами, локализовав таким образом от свободной брюшной полости. Третьим вариантом ликвидации источника перитонита является его дренирование, показанием к которому служат неудалимый гнойно-некротический очаг в брюшной полости, распространение гнойно-некротического процесса на забрюшинную клетчатку.
Заключительную санацию брюшной полости осуществляют одномоментно или методами «продленной санации». Она преследует двойную цель: механическое очищение с максимальным удалением инфицированного и ток-
460
сичного содержимого и лечебное (медикаментозное) воздействие. Для решения первой задачи применяют 6—12 л слабогипертонических растворов солей (раствор Рингера—Локка) и антисептиков (фурацилин 1:5000, 0,01— 0,02 % раствор хлоргексидина). Для усиления эффекта механического очищения в состав санирующих жидкостей включают раствор перекиси водорода (на 1,0 л жидкости добавляют 100,0 мл 3 % раствора перекиси водорода). На заключительном этапе санации брюшную полость орошают растворами антибиотиков (с учетом вида микрофлоры экссудата) в комбинации с препаратами группы метронидазола.
В настоящее время достаточно широко применяют метод электрохимической детоксикации — брюшную полость после промывания растворами антисептиков тщательно осушают, после чего в нее однократно вливают 400—600 мл раствора гипохлорита натрия в концентрации 900—1200 мг/л. Брюшную полость дренируют полихлорвиниловыми трубками, которые перед вливанием раствора гипохлорита пережимают. Дренажи открывают через 1,5—2 ч после операции; в среднем требуются 2—3 таких сеанса.
Непрямое электрохимическое окисление (НЭХО) крови относится к альтернативным, немедикаментозным методам лечения. Внутривенное введение 0,004 % гипохлорита натрия в количестве 10 мл на 1 кг массы тела больного оказывает выраженный детоксикационный эффект, способствует быстрому (в течение 3—7 сут) купированию воспалительного процесса в брюшной полости и симптомов вторичного иммунодефицита.
Местное лечение перитонита осуществляют также сочетанным применением раствора гипохлорита натрия с лазеротерапией.
Обязательным компонентом санации является удаление «обсемененных» микроорганизмами напластований фибрина с петель кишечника и брюшины. Применяют иммобилизованные ферменты (профезим, иммозимаза) с экспозицией на 6—8 ч для усиления протеолиза фибринных наложений, плотно фиксированных к брюшине.
Качественной механической очистке париетальной и висцеральной брюшины от фибринозных наложений способствует применение низкочастотного ультразвука, пульсирующей струи антисептиков. В качестве озвучиваемой среды используют раствор фурацилина, водный раствор хлоргексидина, раствор фурагина или антибиотиков широкого спектра действия; озвучиванию подвергают все анатомические пространства брюшной полости поочередно, в течение 7—10 мин.
Озонотерапия играет значительную роль в комплексном лечении перитонита. Механизм местного действия озонотерапии связан с активацией метаболизма и энергетики клеточных структур кишечника, усилением гликолиза, позволяющим сохранить жизнеспособность и структурную целостность энтероцитов.
Однако даже самое тщательное интраоперационное промывание брюшной полости озонированными растворами не всегда достигает цели полной санации, так как между складками брюшины и петлями кишечника может остаться патогенная микрофлора. Поэтому санацию брюшной полости следует проводить и в послеоперационном периоде.
Пролонгированный перитонеальный лаваж применяют, когда после первичного промывания в брюшной полости на петлях кишечника остаются фибринозные наложения, являющиеся хорошим адсорбентом токсинов и микроорганизмов. В послеоперационном периоде они могут вызвать про-грессирование перитонита и другие осложнения. Основными целями процедуры являются радикальное удаление источника перитонита и создание надежного герметизма брюшной полости.
461
Существуют две принципиальные схемы перитонеального лаважа: проточный (непрерывный) и фракционный (периодическое введение в брюшную полость определенных дозированных объемов раствора, который удаляют также через определенный промежуток времени).
Диализирующий раствор готовят следующим образом: на 1000 мл дистиллированной воды берут один из антибиотиков (в соответствии с видовым составом микрофлоры), террилитин 10 мг, хлорофиллипт 10 % раствор 10 мг, диоксидин 1 % раствор 10 мл, трипсин или химотрипсин или химопсин 50 мг, 10 000 ЕД гепарина, 30 000—60 000 ЕД контрикала или 400 000 ЕД гордокса, а также хлорида натрия 12,2, хлорида калия 0,6, хлорида кальция 0,6, хлорида магния 0,2, гидрокарбоната натрия 0,6, глюкозы 12.
Состав диализата может быть и другим.
На 3—4-е сутки выводимый из брюшной полости раствор становится прозрачным, объем его совпадает с вводимым. Верхние (ирригационные) трубки удаляют на 5—6-е сутки, нижние (дренажные) трубки удаляют через 2—3 сут после удаления верхних.
На сегодняшний день в арсенале хирурга находится несколько вариантов завершения оперативного вмешательства.
Ушивание лапаротомной раны с дренированием — наиболее часто используемый вариант завершения операции при перитоните.
Дренирование брюшной полости при распространенном перитоните является обязательным звеном оперативного вмешательства.
Метод программированных релапаротомий осуществляется в послеоперационном периоде в определенные установленные сроки (чаще с перерывами в 1—3 дня), когда выполняют релапаротомию, тщательную санацию брюшной полости с последующим ее ушиванием с помощью особых швов.
С целью повторных санаций брюшной полости при перитоните используют и малоинвазивные методы — санацию с помощью видеолапароскопической техники.
Через наложенную гильзу при необходимости повторно вводят лапароскоп, накладывают пневмоперитонеум, промывают брюшную полость ги-похлоритом натрия и т. д.
При открытом ведении брюшной полости при перитоните (лапаростомия) после основных этапов оперативного вмешательства лапаротомную рану не ушивают наглухо, чтобы в послеоперационный период проводить ее систематическую ревизию и повторную санацию. Брюшную полость окончательно закрывают и ушивают лапаротомную рану только после полного купирования перитонита.
После завершения основных этапов операции по поводу перитонита петли кишечника защищают салфеткой с мазью или антисептиком, поролоном, а края раны только частично сводят редкими швами через все слои передней брюшной стенки или накладывают кольцевые швы, либо используются специальные сводящие рану приспособления: наложение кольцевидных швов; использование спиц Киршнера; вшивание «замка-молнии».
Одним из важнейших этапов оперативного вмешательства при распространенном перитоните является декомпрессия желудочно-кишечного тракта. Оптимальным вариантом интубации кишечника является трансназальный способ.
Принципы инфузионной терапии распространенного перитонита в послеоперационный период включают:
• восполнение дефицита ОЦК, регуляция волемии и нормализация центральной гемодинамики;
462
Таблица 17.5. Специфическая антибактериальная терапия
|
Наиболее значимые возбудители |
Режим монотерапии |
Режим комбинированной терапии |
|
Перитонит вследствие деструкции или перфорации органа | ||
|
Enterobacteriaceae |
Тикарциллин/клавуланат |
Цефалоспорин III—IV + метрони- |
|
Bacteroides spp. |
Пиперациллин/тазобактам |
дазол (линкозамид); |
|
|
Цефоперазон/сульбактам |
Фторхинолон* + метронидазол; |
|
|
Имипенем |
Амоксициллин/клавуланат + ген- |
|
|
Меропенем |
тамицин; |
|
|
Эртапенем |
Цефуроксим + гентамицин + метронидазол |
|
|
Послеоперационный перитонит | |
|
Enterobacteriaceae |
Имипенем |
Цефалоспорин III—IV + линко- |
|
Bacteroides spp. |
Меропенем |
мицин (клиндамицин); |
|
Enterococcus spp. |
Пиперациллин/тазобактам Цефоперазон/сульбактам |
Фторхинолон* + метронидазол |
* Фторхинолон (левофлоксацин, офлоксацин, пефлоксацин, ципрофлоксацин).
борьба с обезвоживанием посредством массивного введения солевых растворов (изотонический раствор хлорида натрия);
коррекция гипопротеинемии путем введения 5—10 % раствора альбумина, свежезамороженной плазмы, препаратов донорской крови — протеина. Общий объем инфузии альбумина и других белковых препаратов в сутки 600—1000 мл;
нормализация электролитного состава крови за счет вливания сложных солевых растворов (Рингера, хлосоль, трисоль, дисоль), которые содержат в определенных соотношениях все необходимые микроэлементы;
нейтрализация метаболического ацидоза введением 4,5 % раствора гидрокарбоната натрия, в том числе и в сочетании с хлоридом натрия, калия, кальция. Более мощным средством является лактосол, содержащий буферные добавки, активность. В среднем суточная доза препаратов для коррекции метаболического ацидоза составляет 400—600 мл;
восполнение энергозатрат из расчета суточной потребности организма 3000 ккал; 2/3 этой потребности восполняют за счет введения концентрированных растворов глюкозы, а Уз — жировых эмульсий (20 % раствор интралипида, липофундина). Объем инфузии препаратов, содержащих углеводы и жиры, может достигать 1000—1500 мл в сутки.
Специфическая антибактериальная терапия, не подменяя хирургическую санацию и другие компоненты медикаментозной терапии, существенно влияет на эффективность лечения перитонита (табл. 17.5).
Основные принципы детоксикационной терапии и иммунокоррекции распространенного перитонита приведены в разделе «Эндогенная интоксикация в хирургии и принципы ее коррекции».
17.5.2. Эмпиема
Эмпиема (греч. — гнойник) — скопление гноя в естественных, т. е. в анатомических и существующих полостях — плевральной, желчном пузыре, суставе.
463
Эмпиема плевры (empiema pleurae) (гнойный плеврит — pleuritis purulen-ta) — частный случай эмпием, воспаление висцеральной и париетальной плевры с накоплением гнойного экссудата или гнойно-фибринозных масс в образовавшейся между ними полости.
Эмпиема плевры развивается как осложнение гнойно-деструктивных заболеваний легких (абсцессы, гангрена и др.), паразитарных или врожденных кист легкого, при распаде злокачественной опухоли легкого, кавернозном туберкулезе легких в случае прорыва каверны в плевральную полость, ранений и травм груди, после оперативных вмешательств на органах грудной клетки, сопровождавшихся массивной кровопотерей. Инфицирование плевральной полости может произойти лимфогенным или гематогенным путем из внелегочных очагов гнойной инфекции (деструктивный панкреатит, подциафрагмальный абсцесс и др.). Особенно часто это осложнение развивается у ослабленных больных, страдающих сахарным диабетом, хроническим алкоголизмом.
Эмпиема плевры — полиэтиологическое заболевание. Различают неспецифическую, специфическую и смешанную эмпиему.
Основными возбудителями эмпиемы, ассоциируемой с абсцессом легкого, являются анаэробы. Эмпиема как осложнение после хирургического вмешательства вызывается преимущественно аэробными грамотрицатель-ными бактериями или S. aureus.
Специфические эмпиемы плевры вызываются туберкулезными палочками, реже грибковой флорой. Смешанной эмпиему считают в тех случаях, когда в экссудате находят и туберкулезные палочки, и другие микроорганизмы (S. aureus, S. pneumonie, S. pyogenes).
Изменения в плевре могут нарастать остро или постепенно с развитием экссудативного, фибринозного или гнойно-фибринозного плеврита. При гнойно-деструктивных заболеваниях легких эмпиема чаще начинается с прорыва абсцесса в плевральную полость и протекает по типу пиопневмо-торакса с тяжелой клинической картиной вследствие раздражения огромного рецепторного поля плевры и значительного всасывания токсинов. При ранениях и травмах груди микробное загрязнение плевры из окружающей среды происходит в момент ранения (осколки, инородные тела, обрывки одежды) или в последующем через рану грудной стенки или поврежденные отделы бронхиального дерева. Чаще эмпиема развивается у раненых с открытым пневмотораксом, свернувшимся гемотораксом. После торакальных операций развитию эмпиемы плевры способствуют замедленное расправление легкого из-за негерметичности легочной паренхимы, ателектаза или наличия активного воспалительного процесса в оставшейся части легкого. Нередко эмпиема развивается как следствие первичной несостоятельности культи бронха, нагноения свернувшегося гемоторакса или раны грудной стенки.
Эмпиемы классифицируют в зависимости от степени деструкции легкого; по характеру сообщения с внешней средой: закрытые и открытые эмпиемы; по распространенности гнойного процесса: отграниченные и распространенные; по длительности течения: острую и хроническую.
Отграниченные эмпиемы могут иметь самую разную локализацию. Нередко встречаются многокамерные эмпиемы плевры.
Диагностика эмпиемы плевры основывается на анализе общих и местных клинических проявлений заболевания, результатов лучевых и лабораторных исследований, а также пункции плевры.
Клиническая картина. Признаки острой эмпиемы плевры зависят от вида и распространенности гнойного процесса, степени деструкции легкого,
464
вирулентности возбудителей и реактивности больного. Общие проявления в клинике различных форм эмпиемы можно объединить в несколько сим-птомокомплексов: болевой синдром; синдром гнойной интоксикации; синдром дыхательной недостаточности.
А Болевой синдром отчетливо выражен в начальной стадии эмпиемы, что обусловлено раздражением огромного рецепторного поля висцеральной и париетальной плевры. Больные стремятся лежать на больном боку, чтобы уменьшить объем дыхательных экскурсий грудной клетки. В последующем в связи с накоплением экссудата уменьшается трение листков плевры и сохраняются лишь ноющие боли в груди. При прорыве абсцесса легкого в плевральную полость и развитии пиопневмоторакса боль бывает весьма значительной и может сопровождаться плевропульмональным шоком. С распространением гнойного процесса на диафрагмальную плевру у больных отмечаются боли в верхних отделах живота и ригидность брюшных мышц в этой области. Распространение воспалительных изменений на ме-диастинальную плевру с вовлечением диафрагмального и блуждающего нервов проявляется «френикус-симптомом», брадикардией, аритмией. При переходе гнойного процесса на ткани грудной стенки болевые ощущения усиливаются, особенно при пальпации межреберных промежутков в проекции гнойного очага.
А Синдром гнойной интоксикации имеет различную выраженность. В большинстве случаев заболевание начинается с повышения температуры, недомогания, познабливания, ухудшения аппетита. При гнилостной эмпиеме лихорадка часто гектического характера, сопровождается резкими ознобами, потливостью, тяжелым общим состоянием, рвотой. У многих больных гнойная интоксикация проявляется нервно-психическими расстройствами — от головных болей, раздражительности, бессонницы, быстрой утомляемости до психического возбуждения, делириозного состояния, комы.
А Синдром дыхательной недостаточности обусловлен накоплением жидкости в плевральной полости и сдавлением легкого, а также воспалительным или гнойно-деструктивным процессом в легких. У всех больных более или менее выраженная одышка, кашель, нередко с большим количеством мокроты. У пациентов с острой эмпиемой в начале заболевания кашель сухой. При эмпиеме, развившейся как осложнение гнойно-деструктивных заболеваний легких, кашель сопровождается выделением большого количества мокроты с гноем. При наличии бронхоплеврального свища особенно много мокроты откашливается в постуральном положении больного.
При общем осмотре больного отмечаются бледность кожных покровов, одышка, вынужденное полусидячее или на больном боку положение в постели. Иногда больной сдавливает бок рукой, что уменьшает боль при вдохе. Число дыханий увеличивается до 20—25, в тяжелых случаях — до 30—40 в 1 мин.
При осмотре грудной клетки определяется ограничение ее дыхательных движений, больная сторона отстает при дыхании от здоровой или не участвует в дыхании. При скоплении большого количества экссудата в плевральной полости грудная клетка выбухает в задненижних отделах, межреберные промежутки сглажены. При пальпации грудной клетки, межреберных промежутков умеренная болезненность; голосовое дрожание на стороне поражения ослаблено или вовсе не определяется.
Над скоплением жидкости в плевральной полости отмечается притупление перкуторного звука (по линии Эллиса—Дамуазо—Соколова) и ослабление везикулярного дыхания до полного отсутствия дыхательных шумов
465
(при большом количестве экссудата в полости), усиление бронхофонии. Над зоной поджатого легкого может выслушиваться бронхиальное дыхание, иногда разнокалиберные влажные хрипы, свидетельствующие о воспалительном или гнойно-деструктивном процессе в легких. Если имеется брон-хоплевральный свищ и полость хорошо дренируется через бронх, может выслушиваться амфорическое дыхание.
Рентгенологическое исследование (рентгеноскопия, рентгенография грудной клетки) показывает скопление жидкости в плевральной полости. При отграниченных эмпиемах выявляются тени различной формы в зависимости от скопления гноя, гнойно-фибринозных масс и характера сращений в плевральной полости. Контуры тени изменяются при изменении положения тела, дыхательных движениях. Интенсивность тени изменяется при дыхании — это первый функциональный признак наличия экссудата в полости. При большом количестве жидкости в плевральной полости средостение смещается в здоровую сторону, что особенно заметно при вдохе (второй функциональный признак).
Для оценки характера и распространенности деструктивного процесса в легком показана КТ. При эмпиеме с плеврокожным свищом важную информацию можно получить с помощью фистулографии.
Во время бронхоскопии проводят санацию бронхов, оценивают степень воспалительных изменений слизистой, а по количеству гноя, аспирируемо-го из доли (сегмента), ориентировочно определяют локализацию бронхо-плеврального сообщения.
Торакоскопия позволяет оценить внутреннюю поверхность эмпиемной полости, ее границы, характер плевральных напластований, а также способность подлежащих отделов легкого к расправлению (по подвижности легкого при дыхании). Наличие и локализацию бронхоплевральных свищей определяют по пузырькам воздуха, поступающим через дефекты висцеральной плевры при вдохе. Маленькие свищи можно коагулировать; как правило, торакоскопия заканчивается дренированием полости.
Особое значение в диагностике острой эмпиемы имеет пункция плевры при подозрении на наличие жидкости и исследование пунктата (вид экссудата, число лейкоцитов и лейкоцитарная формула, посев). Точку для пункции выбирают с учетом клинических данных и результатов многоосевой рентгеноскопии. Первое суждение о характере процесса в плевре делают по виду плевральной жидкости: прозрачный слегка опалесцирующий желтоватый экссудат бывает при серозном плеврите; геморрагический экссудат часто свидетельствует о карциноматозе плевры, инфаркт-пневмонии или посттравматическом плеврите; мутный экссудат — об эмпиеме плевры. Грязно-серый гной с резким запахом, иногда с геморрагическим оттенком, чаще наблюдается при гнилостной, а зловонный — при анаэробной эмпиеме плевры. При хронической эмпиеме гной чаще густой, особенно в нижних отделах полости, с множественными хлопьями. Необходимы специальные исследования пунктата: посев на микрофлору и определение ее чувствительности к антибактериальным препаратам, бактериоскопия мазка, па-томорфологические и биохимические исследования.
Лечение
А Общее лечение включает:
детоксикационную терапию;
коррекцию белковых, волемических и электролитных расстройств;
антибактериальную терапию;
коррекцию иммунных нарушений;
466
лечение дыхательной недостаточности;
общеукрепляющее и симптоматическое лечение.
В зависимости от чувствительности микрофлоры назначают оксациллин по 2,0 г каждые 6 ч или ванкомицин по 1,0 г каждые 12 ч. Если выпот из плевральной полости оказывается «стерильным», назначают антибиотики или их комбинации, обладающие активностью в отношении анаэробов и аэробных грамотрицательных эн-теробактерий: ингибиторозащищенные пенициллины (амоксициллин/клавуланат или ампициллин/сульбактам по 1,0—2,0 г каждые 6—8 ч); цефалоспорины III—IV поколения (цефотаксим по 1,0—2,0 г каждые 4—6 ч или цефепим по 2,0 г каждые 12 ч) + метронидазол по 0,5—1,0 г каждые 8—12 ч; линкосамиды (линкомицин по 0,6—1,2 г каждые 12 ч или клиндамицин по 0,15—0,6 г каждые 6—8 ч + аминогли-козиды II—III поколения (гентамицин по 3—5 мг/кг/сут на 1 введение или амика-цин по 15 мг/кг/сут на 1 введение). Основной путь введения антибиотиков при эмпиеме — внутривенный.
Местное лечение включает:
постоянную или систематическую эвакуацию гноя;
борьбу с инфекционным процессом в плевре;
ликвидацию остаточной плевральной полости.
Д Показаниями к оперативному лечению являются:
тотальная или распространенная эмпиема с выраженной гнойной интоксикацией;
эмпиема с деструкцией легкого и бронхоплевральными свищами;
эмпиема с обширным нагноением раны грудной стенки, остеомиелитом ребер или гнойным хондритом;
безуспешная пункционная санация эмпиемной полости в течение 5—7 сут.
Первостепенное значение в лечебном процессе придают санации полости эмпиемы. Небольшие по объему полости (200—300 мл) санируют ежедневными пункциями с максимальной эвакуацией воспалительного экссудата и фракционным промыванием растворами антисептиков, ферментативных препаратов и антибиотиков.
Показаниями к дренированию плевральной полости с осуществлением проточно-промывного диализа и активной аспирации является значительный объем гнойной полости (более 300 мл), наличие гнойного экссудата при повторных пункциях, сохраняющаяся общая интоксикация с прогрес-сированием внутриплеврального процесса. Дренирование осуществляют двухпросветными трубками с подключением к аспиратору. В промывочную жидкость вводят антибактериальные препараты (ампициллин, линкомицин) и протеолитические ферменты (стрептаза, террилитин).
Для дренирования и санации эмпиемы плевры все чаще используют видео-торакоскопическую технику. Торакоскопию осуществляют через торакопорт, введенный в четвертое — пятое межреберье по переднеподключичной линии. После обзорной торакоскопии в плевральную полость вводят второй, а при необходимости и третий торакопорт (для инструментария). Вмешательство в плевральной полости зависит от характера поражения ее. Завершающими этапами являются санация и направленное дренирование плевральной полости с формированием проточно-аспирационной системы. Как правило, гнойный процесс в плевральной полости купируется после 3—5 торакоскопии.
Из других методов «закрытого» лечения эмпиемы плевры применяют дренирующие операции через троакар, а при отсутствии его — с помощью длинного кровоостанавливающего зажима или корнцанга.
467
Санация плевральной полости при открытых (с бронхоплевральным сообщением) эмпиемах имеет ряд особенностей. Дренажную трубку вводят в самый нижний отдел полости, чтобы избежать скопления жидкости ниже дренажной трубки. Промывание полости осуществляют так, чтобы не вызвать аспирационной пневмонии при попадании раствора в легкое через бронхиальный свищ. Для этого объем промывного раствора подбирают индивидуально (не вызывать кашля), а промывание проводят при наклоне больного в сторону поражения.
17.5.3. Перикардит
Перикардит (pericarditis purulenta) — воспаление серозных оболочек околосердечной сумки (перикарда), развивающееся вследствие различных причин.
Гнойный перикардит — заболевание в основном вторичное — развивается как осложнение гнойного медиастинита, абсцесса печени, гнойного плеврита, перитонита, рожи, остеомиелита, флегмон различной локализации. Основной путь распространения инфекции лимфогенный, реже — гематогенный; возможен и контактный путь — с соседних органов. Гнойный перикардит встречается как осложнение внутригрудных операций. Перикардит, возникающий после ранений сердца, перикарда, называют первичным.
Возбудителями гнойного перикардита являются стафилококки, энтеро-бактерии, гонококк, туберкулезная палочка и др.
Острые перикардиты классифицируют по характеру экссудата и его количеству, а также возможности тампонады сердца. Хронические перикардиты делят в зависимости от наличия жидкого выпота в перикардиальной полости на выпотные и слипчивые. В обеих подгруппах выделяют заболевания, протекающие с признаками сдавления сердца или без них.
Воспаление перикарда развивается по общим правилам и начинается с гиперемии, отека, образования внутриперикардиального экссудата, который вначале бывает серозным, а затем становится гнойным. Выпот в перикарде может быть геморрагического характера вследствие микротравмы расширенных сосудов при работе сердца. Количество экссудата может достигать 0,5—1,5 л. В воспалительный процесс вовлекаются эпикард, миокард (вторичный миокардит). Отложение фибрина на эпи- и перикарде приводит к склеиванию их между собой с последующим образованием в этих местах сращений — внутриперикардиальных спаек, массивное развитие которых приводит к облитерации полости перикарда.
Клиническая картина острого перикардита обусловлена нарушениями гемодинамики, имеющими экстракардиальную (тампонада сердца) или мио-кардиальную (изменения самой сердечной мышцы) природу, раздражением нервных окончаний обоих листков околосердечной сумки и общими проявлениями воспалительного процесса (гнойной интоксикацией).
При небольшом количестве воспалительного экссудата в сердечной сорочке явления сдавления сердца незначительны; скопление же больших количеств экссудата приводит к развитию субъективных и объективных признаков. Отмечаются приступы сердцебиения, боли в области сердца, появляются ощущение сдавления сердца, страх. Боли часто иррадиируют в левую руку, подобно боли при стенокардии. Пульс становится мягким, неравномерным, с перебоями. Развиваются одышка, цианоз и набухание вен шеи. При дальнейшем скоплении жидкости в перикарде появляются кашель, затруднение глотания, что связано со сдавлением трахеи и пищевода.
468
Мучительная одышка заставляет больного искать положение, облегчающее дыхание, и он обычно полусидит, используя при вдохе вспомогательные дыхательные мышцы. В связи с резким затруднением венозного кровообращения отмечаются не только цианоз, но и похолодание верхней части туловища, шеи, головы.
Перкуторно при перикардите выявляется расширение границ сердечной тупости, которая принимает характерную треугольную форму в связи с заполнением экссудатом сердечной сорочки и обоих наддиафрагмальных и передневерхнего ее заворотов.
Аускулыпативно в ранних фазах перикардита отмечается шум трения перикарда, который исчезает после накопления экссудата в перикарде. К этому времени нарастает и становится выраженной глухость сердечных тонов. Сердечный толчок не определяется или смещается кнутри от левой границы сердечной тупости.
Развиваются симптомы общего характера, вызванные гнойной интоксикацией: высокая температура тела, нередко с ознобом, лейкоцитоз с преобладанием нейтрофилов, слабость, отсутствие аппетита.
Тампонада сердца может наступить и при относительно небольшом выпоте (до 400 мл), когда клинические признаки скопления жидкости в перикарде отсутствуют. В основе ее патогенеза лежит быстрое возрастание внут-риперикардиального давления; при постепенном растяжении перикарда существенного повышения внутриперкардиального давления не возникает вследствие эластических свойств околосердечной сумки.
Характерные признаки тампонады сердца — падение артериального и быстрое нарастание венозного кровяного давления. У таких больных наряду с давящими болями в области сердца появляется чувство страха смерти. Иногда больной отмечает боли в эпигастральной области. Для облегчения состояния больной занимает положение сидя с наклоном туловища вперед или полулежа. Кожа бледная, покрыта холодным потом. Нарастает цианоз губ и лица, вены шеи расширены, но не пульсируют. Пульс малый, едва прощупывается, частый, отчетливо парадоксальный, АД систолическое и пульсовое снижено. Печень увеличена, резко болезненна вследствие напряжения глиссоновой капсулы. В результате критического падения сердечного выброса нарушается мозговое кровообращение, и лишь неотложные мероприятия с разгрузкой полости перикарда от выпота позволяют спасти жизнь больного.
Лабораторная и инструментальная диагностика. Результаты лабораторных исследований крови позволяют оценить остроту воспалительного процесса.
Данные простых инструментальных исследований (измерение ВД, запись ФКГ и ЭКГ) дают достаточно оснований для постановки диагноза: шум трения перикарда находит свое отражение на ФКГ в виде среднечас-тотного шума, недостаточно четко связанного с фазами сердечного цикла, изменяющегося в амплитуде и продолжительности.
При рентгенологическом исследовании определяется увеличение размеров сердечной тени в поперечнике больше, чем по оси тела больного, сосудистый пучок укорачивается. Изменяется силуэт сердца: симметричность, сглаживание талии, начальное расширение границ вправо. В целом сердечная тень закруглена и чаще имеет вид не усеченной трапеции или «дома с трубой», а напоминает кисет или напряженный мешок, форма которого приближается к шаровидной.
Применение ультразвуковой эхокардиографии значительно облегчает диагностику и позволяет определить даже 50— 100 мл выпота в околосердечной сумке (симптом «плавающего сердца»).
469
В настоящее время наряду с ультразвуковой эхокардиографией весьма информативными методами исследования являются КТ и МРТ, позволяющие не только выявить увеличение размеров тени сердца и наличие жидкости в полости перикарда, но и уточнить характер содержимого полости (жидкость или ткань), толщину и плотность сдавливающих оболочек.
Важным методом, подтверждающим диагноз экссудативного перикардита и позволяющим определить характер экссудата, произвести бактериологическое исследование, является пункция перикарда. Пункция позволяет получить экссудат для макроскопического, микроскопического и бактериологического исследования и в случае необходимости полностью удалить жидкость из сердечной сумки.
Диагностическая пункция перикарда в случае получения гноя сразу же превращается в лечебную, т. е. из перикарда полностью отсасывают гной и через ту же иглу вводят антибиотики в 20—30 мл 0,25 % раствора новокаина (необходим учет данных антибиотикограммы!). Пункцию перикарда повторяют через 3—5 сут в зависимости от состояния больного и быстроты накопления гноя. При отсутствии успеха после 3—4 лечебных пункций перикарда прибегают к перикардиотомии.
При значительном скоплении гноя в околосердечной сумке, тяжелой гнойной интоксикации показана экстраплевральная перикардиостомия с последующей санацией сумки. Операционный метод лечения является частью комплексной терапии — антибактериальной, дезинтоксикационной, включающей лечение первичного заболевания, послужившего причиной гнойного перикардита.
17.6. Гнойные заболевания кисти и стопы
Гнойные заболевания кисти — распространенные заболевания в амбулаторной практике, отличающиеся различными клиническими проявлениями, обусловленными локализацией и стадией воспалительного процесса (табл. 17.6).
Таблица 17.6. Классификация гнойных заболеваний кисти

Поражение
ткани и анатомические структуры
Нозологические формы
Кожа
Подкожная клетчатка Сухожильные влагалища и сумки
Кость Сустав
Гнойные заболевания пальцев
Кожный панариций
Ногтевой панариций: а) паронихия; б) подногте-
вой панариций
Лимфатический панариций. Лимфангит
Эризипелоид
Подкожный панариций
Сухожильный панариций (гнойный тендовагинит
средних (II—III—IV) пальцев
Сухожильный панариций (гнойный тендовагинит
IиIIпальцев, лучевой и локтевой тенобурсит
Костный панариций
Суставной панариций
Костно-суставной панариций
470
Продолжение
Поражение
ткани и анатомические структуры
Нозологические формы
Кожа и подкожная клетчатка тыльной поверхности
Фурункул
Карбункул
Подкожная (надапоневротическая) флегмона
Подапоневротическая флегмона
Гнойные заболевания кисти
Кожа ладони
Кожный абсцесс
Комиссуральная флегмона (мозольный абсцесс, намин)
Подкожная клетчатка ладони Фасциальные пространства ладони
Межпальцевая флегмона
Флегмона латерального пространства (ложе те-нара)
Флегмона ложа гипотенара Флегмона срединного пространства (над- и под-сухожильная, над- и подапоневротическая Перекрестная — U-образная флегмона
Стадии развития воспалительного процесса: начальная — серозно-инфильтратив-ная; гнойная — гнойно-некротическая
17.6.1. Панариций
Панариций (лат. panaricium) — острое воспаление тканей пальцев, возникающее обычно в результате инфицирования мелких его повреждений. Варианты расположения гнойно-некротического очага при различных видах панариция представлены на рис. 17. IS.
Наиболее распространенный возбудитель панариция — золотистый стафилококк (в монокультуре либо в ассоциации); реже выделяют стрептококк, кишечную палочку, протей. Иногда причиной заболевания служит грибковая инфекция.
Входными воротами инфекции служат различные повреждения, чаще всего микротравмы. Вероятность развития инфекционного процесса повышается при внедрении в ткани инородных тел — заноз, металлических стружек, мелких осколков стекла и др.). Крайне редко инфицирование происходит гематогенным путем.
К факторам, способствующим возникновению гнойных заболеваний кисти, относятся местные, нарушающие гемоциркуляцию и трофику тканей (длительное воздействие на кожу рук холода, повышенной влажности, раздражающих и загрязняющих веществ, вибрации), и общие, понижающие реактивность организма (истощение, гиповитаминоз, сахарный диабет).
Клиническая картина. В ходе диагностики необходимо детально выяснить жалобы и анамнез заболевания. Постоянным признаком является сильная боль пульсирующего характера, резче выраженная в центре гнойного очага и при локализации его на ладонной поверхности пальца, где ткани неподатливы и обильно снабжены нервными окончаниями. Боль усиливается при движениях пальца, находящегося обычно в полусогнутом положении. Как правило, выраженные (в разной мере) припухлость и отечность пальца, гиперемия кожи, наиболее четко определяющиеся на тыльной его поверхности, местное повышение температуры. Общие нарушения в организме больных выражены меньше, чем местные.
471
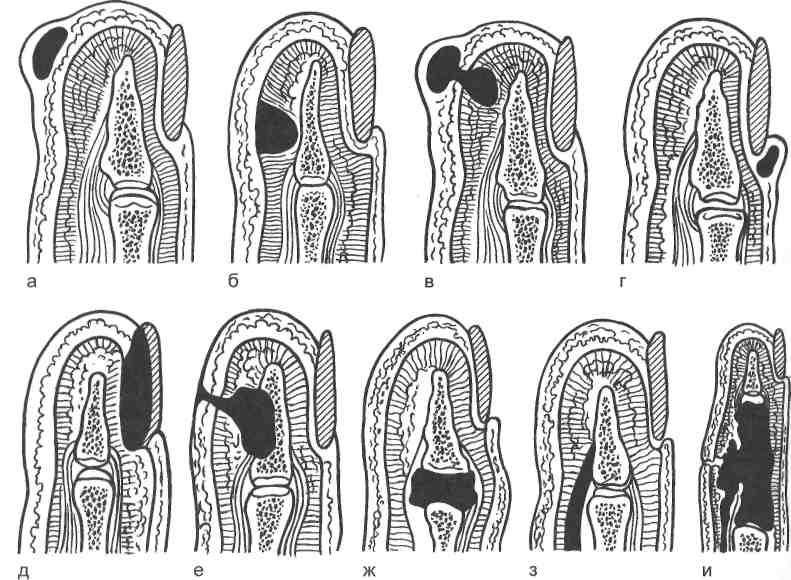
Рис. 17.18. Виды панариция.
а — кожный; б — подкожный; в — в виде «запонки»; г — паронихия; д — подногтевой; е — костный; ж — суставной; з — сухожильный; и — пандактилит.
Для стадии серозного воспаления характерны умеренная боль, чувство жжения и распирания, а переход в гнойно-некротическую стадию сопровождается появлением нестерпимой боли, лишающей больного сна. Так как опускание руки вниз усиливает боль (повышение внутритканевого давления), больные предпочитают удерживать руку в возвышенном положении.
Усиление болевых ощущений свидетельствует о распространении и нарастании воспалительного процесса, их стихание обычно связано со вскрытием гнойного очага (спонтанное, оперативным путем). Место наибольшей болезненности, определенное максимально точно с помощью пуговчатого зонда, в подавляющем большинстве случаев соответствует центру гнойно-воспалительного очага; следует помнить, что при его определении нельзя ориентироваться на красноту или припухлость.
Гиперемия кожи над воспалительным очагом не имеет четкой границы, переходя постепенно в нормальную окраску кожи по мере удаления от фокуса воспаления. Она, как правило, более выражена на тыльной поверхности кисти даже при локализации гнойного очага в тканях ладонной поверхности. При глубоких панарициях (костном, сухожильном) этот симптом менее выражен, но отекает весь палец. Если гнойный процесс локализован в межпальцевых промежутках, то выраженный отек тканей «раздвигает» пястные кости, затрудняя смыкание пальцев.
472
Повышение температуры в зоне воспаления определяется при пальпации и может быть подтверждено электротермометрией.
Кроме определения локализации и формы гнойного заболевания, важна диагностика стадии воспаления. Для серозной фазы воспаления характерны щадящее положение руки, чувство жжения и распирания в пальце, разлитый отек и яркая гиперемия кожи. Критериями гнойно-некротической стадии являются следующие признаки: длительность заболеваний превышает 2—3 сут, вынужденное оберегающее положение конечности, пульсирующая дергающая боль, ограничение воспалительной припухлости тканей на пальце; появление в центре воспалительного очага зоны побледнения, расширение вен на тыле пораженного пальца и нарушение его функций, развитие регионарных лимфангита, лимфаденита, на рентгенограммах — понижение дифференцированности мягких тканей в зоне очага.
Рентгенологическое исследование менее ценно: понижение дифференцированности мягких тканей в зоне очага выявляется не всегда, а признаки деструкции костной ткани определяются поздно (к концу первой недели от начала заболевания).
Лечение. Основной метод лечения панариция — оперативный. Однако на стадии серозно-инфильтративного воспаления применяют комплекс консервативных мер: тепловые процедуры в виде УВЧ, УФО. Не допускается наложение согревающих компрессов, тем более с мазями на жировой основе! Применяют полуспиртовые повязки либо повязки с антисептиками или антибиотиками с добавлением препаратов, проникающих через кожный барьер (например, диметилсульфоксид). Эффективен электрофорез с трипсином и антибиотиками. После завершения любой консервативной процедуры на стадии серозно-инфильтративного воспаления обязательно наложение гипсовой лонгеты по ладонной поверхности пальца и кисти до средней трети предплечья.
Обратному развитию воспаления более всего способствует внутривенное регионарное (под жгутом) введение антибиотиков, эффективных против стафилококков. В этом случае в выключенном из кровообращения участке конечности депонируется антибиотик за счет связывания его тканевыми белками и создается концентрация, во много раз превосходящая минимальную ингибирующую даже для резистентных штаммов. В связи с этим достаточно введения антибиотиков 1 раз в сутки.
Раствор антибиотика вводят в вену под жгутом, наложенным на нижнюю треть плеча. Еще лучше пользоваться двумя манжетами (от тонометра). Первую манжету накладывают на нижней трети плеча; после измерения АД ее оставляют на месте. Вторую манжету помещают на нижней трети предплечья; поднимают давление в проксимальной манжете до уровня, превышающего диастолическое на 10—15 мм рт. ст. (контурируются вены). Вводят иглу в вену и присоединяют к ней резиновый переходник (для облегчения техники смены шприцев, введения растворов). Перед вливанием антибиотика давление в проксимальной манжете поднимают на 30—40 мм рт. ст. (выключают из кровообращения дистальный отдел конечности). После инфузии появляется мраморное окрашивание кожи выключенного сегмента, свидетельствующее о ретроградном проникновении антибиотика в кожные сосуды. Сразу после окончания вливания давление в дистальной манжете (на предплечье) поднимают до того же уровня, что и в проксимальной (на плече), в которой после этого давление сбрасывают. Таким способом удается выключить из кровообращения минимальный участок конечности, что уменьшает болевую реакцию и сохраняет венозный сосуд для последующих инъекций.
Констатация гнойно-некротической стадии служит абсолютным показанием к хирургическому лечению панариция.
473
Цели операции:
эвакуация гнойного экссудата;
иссечение нежизнеспособных тканей;
снижение интоксикации и предупреждение генерализации инфекции.
Оперативное вмешательство обычно выполняют в объеме вскрытия, хирургической обработки и дренирования гнойного очага. Это довольно тонкая операция, для выполнения которой необходимы глазные скальпели, пинцеты, крючки, ножницы. Оперативный доступ следует планировать с учетом самого короткого пути для дренирования, функциональных особенностей пораженной зоны, последствий производимых разрезов. На пути к очагу недопустимо вскрывать интактное сухожильное влагалище. Разрезы по ладонной поверхности пальцев впоследствии ограничивают их функцию в связи с образованием грубого чувствительного рубца. Калечащие функциональные последствия возникают после переднебоковых разрезов, проходящих через межфаланговые суставы, а также после разрезов вдоль всего пальца. Оптимальными и наиболее щадящими признаны среднебоковые разрезы (по так называемой нейтральной линии пальца). Этот доступ позволяет без особых затруднений обследовать любую структуру пальца, практически безопасен с точки зрения случайного повреждения нервов и сосудов пальца.
Перед операцией вскрытия панариция целесообразна 15-минутная теплая ванна с дезинфицирующим раствором для всей кисти. Больного укладывают горизонтально, руку на подставке отводят под углом 90°. Подготовка операционного поля включает обработку всей кисти и предплечья и завершается отграничением стерильным бельем. В операции должен участвовать ассистент, чтобы обеспечить полноценное обследование, вскрытие и дренирование глубоких очагов.
А При панарициях ногтевой и средней фаланг применяют проводниковую анестезию по Оберсту—Лукашевичу: у тыльных краев основания пальца вводят по 4—6 мл 1—2 % раствора новокаина (тримекаина, лидокаина), постепенно продвигая иглу по направлению к ладонной поверхности; после окончания инъекции накладывают стерильный жгут (из ниппельной резины), затем выжидают 4—5 мин для полного проявления действия анестетика.
А Операции по поводу панариция проксимальной фаланги, суставного, сухожильного и костного панариция проводят под проводниковой анестезией по Брауну—Усольцевой (раствор анестетика вводят в межпальцевые промежутки с тыльной стороны кисти по линии, соединяющей I пястно-фаланговый сустав с серединой V пястной кости) либо под внутривенной регионарной анестезией, сочетая ее с одновременным введением антибиотика по описанной выше методике.
А При тяжелых панарициях, особенно при повторных вмешательствах, операцию выполняют под проводниковой анестезией плечевого сплетения либо под внутривенным наркозом.
После выполнения операции накладывают гипсовую лонгету в функционально выгодном положении: для кисти — тыльное сгибание в лучезапяст-ном суставе (35°); для I пальца — полное отведение и сгибание в запястно-пястном (25°) и межфаланговом (30°) суставах; для II, III, V пальцев — сгибание под углом соответственно 35°, 60°, 25° (начиная от пястно-фаланго-вого сустава); для IV пальца эти углы составляют 45°, 60°, 25°.
Послеоперационный период. В ближайшее после операции время перевязки выполняют ежедневно; предварительно назначают теплые ванны с мою-
474
щими средствами, антисептиками. После высушивания кисть и предплечье обрабатывают йодной настойкой.
После исчезновения признаков острого воспаления и прекращения гнойной экссудации рекомендуются мазевые повязки с интервалом 2 сут, показаны небольшие движения в межфаланговых и пястно-фаланговых суставах. В эти же сроки прекращают введение антибиотиков. В комплекс ЛФК постепенно включают активные произвольные движения, пассивную разработку суставов. Предварительно назначают УВЧ, горячие ванны, компрессы. Для восстановления важной отводящей функции большого пальца применяют специальные аппараты.
При кожном панариции гнойный очаг располагается в толще кожи под эпидермисом. Образуется пузырь с серозным, гнойным или геморрагическим содержимым, который может располагаться на ладонной, тыльной поверхности любой из фаланг, иногда занимая почти всю поверхность пальца. Пузырь окружен узким воспалительным валиком. Боль вначале незначительная, но по мере накопления гноя усиливается, становится постоянной, пульсирующей. Иногда очаг гиперемии вокруг пузыря расширяется, присоединяется лимфангит и регионарный лимфаденит, сопровождающийся повышением температуры тела до высоких цифр. Ранее подобное поражение называли лимфатическим панарицием. При кожном панариции гнойный очаг в толще кожи может сообщаться с очагом в подкожной клетчатке — так называемый панариций в форме запонки.
Оперативное пособие сводится к рассечению отслоенного выпотом эпи-дермального пузыря и иссечению отслоившегося эпидермиса. На образующуюся раневую поверхность накладывают повязку с раствором антисептика. При обнаружении свищевого хода, идущего в глубину, необходимо вскрыть запонкообразный подкожный панариций.
При околоногтевом панариции — паронихии — гнойное воспаление локализуется в толще валика ногтя: в боковом его участке, над корнем ногтя или на всем протяжении валика. Кожа валика краснеет, припухает, из-под валика при надавливании появляются капли гноя.
Довольно сильная боль быстро ведет к утрате трудоспособности. Пальпация воспаленной ткани болезненна. В отдельных случаях гной проникает под ноготь и отслаивает его в проксимальной или боковой части. Операция необходима даже после самостоятельного вскрытия очага, поскольку гнойная полость не может опорожниться полностью через небольшое отверстие в истонченной коже.
При паронихии в зависимости от локализации гнойного фокуса применяют клиновидные, П-образные, парные боковые разрезы тыльной поверхности ногтевой фаланги.
Во всех случаях, когда имеется распространение гноя под ногтевую пластинку не на всем протяжении, а только в боковом или дистальном отделах, одновременно со вскрытием паронихии необходимо резецировать лишь отслоенный гноем край ногтя вплоть до зоны его прочной фиксации к ложу.
При подногтевом панариции гнойный экссудат накапливается под ногтевой пластинкой, отслаивает ее и виден на глаз. При пальпации определяется зыбление ее, и прочным остается лишь место прикрепления ногтя у мат-рикса (в проксимальном отделе). По мере развития воспалительного процесса интенсивность боли нарастает; пальпация ногтя резко болезненна. Лечение оперативное — под местной анестезией иссекают ногтевую пластинку в виде клина, при этом часто обнаруживают инородное тело (занозу), явившуюся причиной панариция. При отслойке ногтя на значительном
475
протяжении производят полное его удаление. Регенерация ногтя наступает спустя 2—4 мес.
При подкожном панариции под воздействием инфекции быстрее разрушается жировая и рыхлая соединительная ткань. Плотная, волокнистая, выполняя преимущественно опорную функцию, наиболее устойчива к про-теолитическим ферментам гноя, поэтому гнойный очаг при подкожном панариции формируется преимущественно в глубоком слое.
Оперативное вмешательство проводят под местной проводниковой анестезией, вскрывают гнойник. При овальном или клюшкообразном (полулунном) доступе сохраняется чувствительность кончика пальца. Разрез проводят не дальше 2—3 мм от свободного края ногтя, чтобы не образовался впоследствии раздвоенный палец (так называемая рыбья пасть). Для его профилактики прибегают к вытяжению ладонного лоскута фаланги липким пластырем или к наложению наводящих швов. Подкожный панариций средней и проксимальной фаланг вскрывают двумя ладонно-боковыми разрезами, проведенными через всю длину фаланги. Далее край раны захватывают лапчатым пинцетом и выворачивают наружу. Дольки жировой клетчатки поверхностного слоя поэтапно захватывают кончиком зажима «москит», слегка подтягивают и остроконечными ножницами иссекают у основания.
Удаление инфицированной клетчатки при панариции должно быть радикальным. С этой целью в глубине раны удаляют только внешне пораженную ткань. На уровне поверхностного слоя в пределах воспалительного очага иссекают всю клетчатку вплоть до дермы кожи независимо от внешнего ее состояния по визуальной оценке. В противном случае в ячеистой структуре клетчатки обычно сохраняются рассеянные гнойные очажки, длительно поддерживающие раневую инфекцию. Именно в этом кроется «секрет» осложнений подкожного панариция костным, сухожильным, суставным.
Костный панариций в большинстве случаев развивается вследствие перехода гнойно-воспалительного процесса с мягких тканей на кость при запущенном и нерадикально леченном подкожном панариции. Первичное поражение кости встречается редко (перенос инфекции из отдаленных воспалительных очагов, травма, достигающая кости). Для поражения кости характерно затяжное течение процесса, боли постоянного характера, тусклые, серые и вялые грануляции, продолжительное отделение гнойного экссудата, иногда содержащего мелкие костные секвестры. Фаланга булавовидно утолщается, становится болезненной, функция кисти нарушается. Рентгенологически костные изменения проявляются достаточно поздно — через 2—3 нед. Оперативное вмешательство проводят под полноценным обезболиванием и при достаточном доступе для тщательной ревизии костных структур. Наилучшие функциональные, косметические результаты получают при радикальной санации очага деструкции (удаление секвестров, размягченных участков кости при максимально бережном отношении к надкостнице как источнику регенерации пораженной фаланги) с наложением первичного шва. После полного удаления некротизированных тканей проводят антибактериальную терапию либо по внутривенной регионарной методике, либо путем внутрикостного лаважа в пораженную фалангу ставят специальную иглу.
Суставной панариций чаще является следствием ранения межфаланговых областей, где суставы покрывает тонкий слой мягких тканей, и воспаление по раневому каналу легко проникает в суставную щель. Реже возникают вторичные (метастатические) суставные панариции с аналогичной симптоматикой. Пораженный сустав веретенообразно утолщается, межфаланговые
476
борозды сглаживаются, попытки к движениям вызывают сильную боль. Местно определяются отек, гиперемия, повышение температуры; с помощью пункции сустава получают небольшое количество мутного экссудата. При вовлечении в патологический процесс связочного, хрящевого и костного аппарата пальца возникает его патологическая подвижность и крепитация суставных поверхностей; «разболтанность» сустава свидетельствует о значительных изменениях костно-суставного аппарата. Для лечения на ранней стадии показана пункция сустава с введением антибиотиков, в том числе регионарное (под жгутом). Если консервативное лечение в течение 2—3 сут не приносит заметного облегчения, показано оперативное вмешательство.
Лучшие исходы получают при своевременном хирургическом лечении, когда в процесс еще не вовлечены хрящевые и костные структуры. При деструкции суставных концов костей предпринимают их экономную резекцию, но тогда процесс заканчивается анкилозом пораженного сустава.
Костно-суставной панариций, как правило, имеет своим исходом туго-подвижность или анкилоз сустава из-за образования мощных спаек — Рубцовых (фиброзный анкилоз) и костных (костный анкилоз) сращений. При значительном разрушении суставных концов, капсулы и связочного аппарата может развиться патологическая подвижность дистальных отделов пальца («болтающийся палец»).
Рентгенография крайне важна для исключения или подтверждения наличия костного или костно-суставного панариция. При костном панариции уже через 5— 8 сут после начала болезни определяется остеопороз костной фаланги и обнаруживаются мелкие деструктивные очаги, к которым присоединяются мелкие секвестры. По краям пораженной фаланги вырисовывается узкая полоска отслоенного периостита. Очаги деструкции развиваются главным образом у мест прикрепления суставной капсулы, отчего процесс нередко переходит на межфаланговый сустав. Щель его суживается, а в другом суставном конце также появляются очаги разрушения костной ткани.
Оперативное вмешательство при костно-суставном панариции — традиционная резекция сустава с различными видами дренирования или без него — практически не оставляет шансов на восстановление функции пораженной кисти. Ампутации и экзартикуляции пальцев, процент которых достаточно высок, нередко приводят к инвалидизации больного.
Поэтому при костно-суставном панариции лучше использовать методику, разработанную А. П. Чадаевым и соавт. (1996).
После артротомии с помощью острой ложечки осторожно выскабливают полость сустава, удаляя пораженную костную ткань. Полость сустава промывают антисептиками, аспирируют с помощью вакуума содержимое гнойной раны и обрабатывают ультразвуком низкой частоты через раствор антибиотиков. Далее из отдельных проколов кожи проводят через сустав пункционную иглу диаметром 2 мм, а через нее — леску-проводник. Иглу удаляют, а по проводнику дренируют сустав перфорированным микроирригатором (подключичный катетер). Дренаж в межфаланговые суставы устанавливают перпендикулярно оси пальца, а в пястно-фаланговые суставы — под углом и выводят в ближайший межпальцевый промежуток во избежание повреждения важных анатомических структур, в частности сухожильного влагалища. На рану накладывают первичные П-образные швы. Из шовного материала предпочитают синтетические нити на атравматичной игле.
При лечении костно-суставного панариция большое значение для восстановления функции сустава имеет его дистракция. Дозированная дист-ракция в суставе препятствует образованию грубых Рубцовых сращений,
477
соединительнотканные элементы при этом формируются в продольном направлении и не препятствуют движениям в суставе, образуя в конечном итоге как бы новую капсулу, предотвращает прогрессирование костной деструкции, создает благоприятные условия регенерации суставных концов, позволяет быстро купировать болевой синдром.
Дренаж из сустава удаляют на 7—9-е сутки в зависимости от степени регресса воспалительного процесса, швы снимают в амбулаторных условиях не ранее 11 —12-х суток, так как при ранних движениях в суставе могут разойтись края раны.
Сухожильный панариций в большинстве случаев является следствием неадекватного лечения тендовагинита. Гнойное воспаление распространяется на сухожильное влагалище и сухожилие сгибателей пальцев, в то время как сухожилия разгибателей более устойчивы к инфекции. Общее состояние больного ухудшается — появляются дергающие либо пульсирующие боли вдоль всего пальца, отек сглаживает межфаланговые борозды, палец приобретает вид «сосиски». Палец спонтанно приобретает состояние легкого сгибания, что уменьшает остроту болевых ощущений; попытка к разгибанию вызывает резкую боль. Промедление с операцией опасно, так как сдавленное экссудатом сухожилие лишается кровоснабжения и быстро погибает. Запоздалая операция ликвидирует воспалительный очаг, но сгибательная функция пальца безвозвратно утрачивается. Длительное «выгнаивание» из раны секвестрированных участков вынуждает хирурга прибегать к удалению тусклого безжизненного сухожилия. После такой операции палец выключается из активной функции, превращается в помеху, и больные настаивают на его удалении.
Для оперативного вскрытия сухожильного панариция на средней, проксимальной фалангах применяют одно- или двусторонние разрезы по нейтральной линии пальца на каждой пораженной фаланге.
Слепой мешок проксимального отдела влагалища вскрывают двумя отдельными разрезами на ладони у основания пальца. Если в процесс вовлечено сухожилие по всей длине, оправдано продольное проведение перфорированного дренажа (кпереди от сухожилия во избежание травмы брыже-ечки) для постоянного орошения полости влагалища раствором антибиотиков и протеолитических ферментов. Влагалище сухожилия дренируют резиновой полоской на период не более 2 сут.
Пандактилит — тотальное поражение тканевых структур пальца с клинической картиной, объединяющей признаки всех видов его гнойного воспаления. Течение тяжелое, сопровождается регионарным лимфангитом и лимфаденитом, выраженными признаками общей интоксикации. Причиной поражения в большинстве случаев являются осложнения простых форм панариция, иногда — особая вирулентность микрофлоры, внедряющейся через узкий длинный раневой канал. Боли, постепенно усиливаясь, приобретают мучительный распирающий характер. Отечный палец становится сине-багровым и болезненным при пальпации во всех отделах; малейшие попытки к движениям в суставах вызывают резкую боль. Воспалительный процесс может развиваться по типу влажного или сухого некроза. Из свищей, послеоперационных ран выделяется скудное отделяемое, грануляции приобретают серый безжизненный вид. При недостаточном лечении создаются условия для распространения инфекции на кисть, о чем свидетельствуют усиление боли, распространение отека и гиперемии тканей. Своевременная операция, рациональное дренирование, интенсивная комплексная терапия в ряде случаев приостанавливают гнойное воспаление. Для предупреждения генерализации инфекционного процесса (сепсис
478
с метастазами) при пандактилите часто приходится прибегать к экзартику-ляции пальца в пястно-фаланговом суставе с удалением головки пястной кости. Эту тактику нельзя распространять на I палец, поскольку даже при полной утрате подвижности I палец сохраняет функциональную пригодность за счет движений пястной кости.
Профилактика. Предупреждению панариция способствуют регулярное мытье рук, в том числе горячей водой, осмотры рук после окончания работ на технических объектах с целью выявления ссадин, царапин, порезов и своевременная их первичная обработка.
17.6.2. Флегмона кисти
Флегмоны кисти имеют различную локализацию (рис. 17.19).
Флегмона возвышения мышц I пальца (тенара) проявляется сильными болями и резким отеком тенара и лучевого края тыльной поверхности кисти. При пальпации выраженная болезненность, напряжение тканей, ограничение подвижности отечных тканей тенара, сглаженность ладонной кожной складки. Нередко гнойный экссудат распространяется по краю первой тыльной межкостной мышцы на дорсальную поверхность кисти. В некоторых случаях наблюдается гнойное расплавление соединительнотканной перегородки, разделяющей щель тенара и срединное ладонное пространство, с образованием флегмоны срединного ладонного пространства.
Для флегмоны возвышения мышц V пальца (гипотенара) характерны умеренно выраженный отек, гиперемия и напряжение тканей, болезненность при пальпации в области гипотенара, усиление боли при движениях V пальца. Явления интоксикации выражены меньше, чем при поражении тенара.
Комиссуральная флегмона «мозольный абсцесс», «намин» локализуется в дистальной части ладони. Входными воротами инфекции являются трещины грубой, омозолелой кожи ладони в области II—IV пястно-фаланговых сочленений. Сопровождается значительной болью, отеком дистальной части обеих поверхностей кисти. Пальцы по соседству с гнойным очагом несколько разведены и согнуты в межфаланговых суставах, разгибание их болезненно из-за натяжения воспаленного ладонного апоневроза. Гной может

образования флегмон ладонной и тыльной поверхностей кисти. 1,6 — подкожной; 2 —ладонной надсухожильной; 3 — подсухожильной; 4 — тенара; 5 — гипотенара; 7 — подфас-циальной тыла кисти [Гости-щев В. К., 1996].
распространяться через овальные щели апоневроза с ладонной на тыльную поверхность кисти, вовлекать в процесс сухожилия глубокого сгибателя пальца, находящегося в непосредственном близости. Инфекция может распространяться по каналам червеобразных мышц в проксимальном направлении с присоединением воспаления срединного ладонного пространства.
При флегмоне срединного ладонного пространства гнойный экссудат расположен между ладонным апоневрозом и тонкой фасциальной пластинкой, прикрывающей сухожилия сгибателей пальцев, или между фасцией, выстилающей с ладонной стороны межкостные мышцы, и задней поверхностью сухожилий сгибателей пальцев. Заболевание сопровождается выраженными проявлениями интоксикации (повышение температуры тела, головная боль, изменения в периферической крови). При осмотре кисти центральная часть ладони выбухает, кожа напряжена, складки сглажены. Пальпация очага воспаления вызывает сильную боль; определить флюктуацию обычно не удается. Значительно выражен отек тыла кисти, II—V пальцы слегка согнуты в межфаланговых суставах, попытка активного или пассивного разгибания их приводит к натяжению инфильтрированного апоневроза, что усиливает боль. Запущенные флегмоны срединного ладонного пространства осложняются прорывом гноя в щель тенара, а также распространением его по каналам червеобразных мышц на тыл кисти либо проксимально в пространство Пароны—Пирогова.
Перекрестная, или U-образная, флегмона — наиболее тяжелая форма гнойного воспаления кисти. Заболевание является следствием гнойного тендовагинита I или V пальца с распространением экссудата на лучевую или локтевую синовиальную сумку. Это серьезное осложнение может возникать при позднем обращении больного к врачу, нерадикальном хирургическом вмешательстве или развитии вирулентной микрофлоры. Течение U-образных флегмон сопровождается выраженной интоксикацией. Кисть отечна, сине-багрового цвета, пальпация ее крайне болезненна. Пальцы несколько приведены к ладони, активные движения в них отсутствуют. Попытка к пассивному разгибанию значительно усиливает боль. При прорыве гноя в пространство Пароны—Пирогова появляются разлитая болезненность и отек в дистальной части предплечья. Гнойно-воспалительный процесс может распространиться в срединное ладонное пространство, щель тенара или гипотенара. В последующем гной по каналам червеобразных мышц переходит на тыльную поверхность кисти, образуя здесь обширный гнойно-некротический очаг. В отдаленном послеоперационном периоде функция кисти нередко оказывается значительно сниженной.
Подкожная флегмона тыльной поверхности кисти развивается после повреждения кожных покровов. Отек и гиперемия тканей тыла кисти носят разлитой характер, значительно превышая размеры гнойного очага.
Подапоневротическая флегмона тыльной поверхности кисти возникает в результате проникновения инфекции под апоневроз при колотых ранениях. Определяется плотный инфильтрат, который сопровождается отеком и гиперемией тыльной поверхности кисти. При распространении инфекции на тыл кисти по лимфатическим сосудам или по каналам червеобразных мышц к отеку присоединяются гиперемия кожи, разлитая болезненность при пальпации тыла кисти.
Лечение. Выполняют операции в объеме вскрытия и дренирования флегмоны. Обширные некрэктомии опасны потерей функции кисти. Операция должна быть своевременной, проводиться с учетом топографии синовиальных влагалищ ладонной поверхности кисти, с последующей комплексной терапией.
480
Флегмоны кисти вскрывают линейными разрезами в месте наиболее выраженной припухлости, гиперемии и флюктуации.
Активное дренирование раны как этап завершения операции обеспечивает удаление оставшихся некротизированных тканей и экссудата, позволяет осуществлять длительный антибактериальный лаваж раны и энзимотера-пию. После стихания процесса острого воспаления трубку удаляют и дальнейшее заживление раны происходит под повязкой. В послеоперационном периоде до момента очищения раны перевязки выполняют ежедневно. Им могут предшествовать теплые ванны с моющими средствами, антисептиками. Для туалета раны применяют современные поверхностно-активные антисептики. Непременный элемент перевязки — оценка динамики воспалительного процесса (стабилизация или нарастание явлений гнойного воспаления), решение вопроса о необходимости повторного вмешательства, поэтому перевязку должен выполнять оперировавший хирург. Запрещается перепоручать перевязки среднему медицинскому персоналу.
17.6.3. Диабетическая стопа
Синдром диабетической стопы является тяжелым осложнением сахарного диабета, связанным с комплексом анатомо-функциональных изменений, приводящих к язвенно-некротическим процессам стопы, вплоть до диабетической гангрены (рис. 17.20).
Диабетическая ангиопатия — специфический генерализованный процесс в артериолах, капиллярах и венулах.
У больных сахарным диабетом встречаются различные гнойные хирургические инфекции: посттравматические гнойные раны, флегмона, абсцесс, карбункул, трофические язвы, сепсис.
В большинстве случаев из раневого экссудата высевается стафилококк, реже — анаэробная неклостридиальная инфекция.
Лечение синдрома диабетической стопы требует решения ряда вопросов.
Предоперационная подготовка включает устранение кетоацидоза и коррекцию углеводного обмена (инсулинотерапия до оптимальных цифр содержания глюкозы в крови 8—10 ммоль/л и не более 1 % в моче), профилактика возможных тромбоэмболических осложнений (гепарин по 1 мл 2— 3 раза в день).
Современный подход к лечению гнойной хирургической инфекции у больных сахарным диабетом основан на следующих положениях:


а _—— б,
Рис. 17.20. Диабетическая гангрена стопы (а), стопы и голени (б).
481
гнойный процесс резко отягощает течение основного заболевания;
течение гнойного процесса у этих больных имеет выраженные особенности: острая бурная фаза воспаления со склонностью к выраженному распространению гнойного процесса по подкожной жировой клетчатке и септическим осложнениям;
развитие некроза и затяжное течение в фазе регенерации;
минимальное оперативное вмешательство оказывается недостаточно эффективным.
А Больным, страдающим синдромом диабетической стопы со значимыми окклюзиями магистральных артерий, производят артериально-реконструктив-ные операции, которые позволяют если не сохранить опороспособность стопы, то по крайней мере снизить уровень ампутации. Это имеет большое значение, так как смертность у пациентов, перенесших ампутацию нижней конечности на уровне бедра, значительно выше, чем у перенесших ее на уровне голени.
А При гнойно-некротических осложнениях синдрома диабетической стопы производят ампутацию на уровне голени и выше, а также на уровне пальцев и области середины стопы (трансметатарзальные ампутации предплюсны).
А При инфицированной нейропатической форме синдрома диабетической стопы производят первичное иссечение явно некротических тканей, дренирование. Несмотря на длительное заживление, большинству больных удается сохранить опороспособность стопы.
А При сочетании гангрены пальцев и начинающейся флегмоны стопы показана некрэктомия со вскрытием флегмоны. При быстром распространении инфекционного процесса по сухожильным влагалищам и межплюсневым пространствам широкими разрезами вскрывают все гнойники и удаляют все некротические ткани в сухожильных и межкостальных пространствах.
При обширных флегмонах голени и ее влажной диабетической гангрене крайней мерой является ампутация бедра на уровне его средней трети.
При местном лечении ран учитывают особенности раневого процесса у больных с сахарным диабетом: низкую скорость эпителизации, склонность к генерализации процесса.
Назначают 0,01 % раствор мирамистина для стимулирования фагоцитоза на ранних стадиях лечения и предотвращения его гиперактивации после очищения ран и перехода к фазе регенерации, иммунокорригирующего действия. Тектин улучшает регенеративные процессы в ране: оказывает дубящий эффект, коагулирует белок, лизирует некротические массы.
Применяют сукцинат натрия в дозе 15 мг/кг в течение 10 сут как эндогенный адаптоген, повышающий резистентность тканей, улучшающий окислительные и энергетические процессы в тканях.
Назначают и гипоталамический полипептид окситоцин, обладающий инсулино-подобными свойствами, внутриартериально, 10 МЕ/сут в течение 7—10 сут или орошают им раневую поверхность. Местное применение стимулирует синтез ДНК в адвентициальных клетках и очищение раны при открытом ее ведении, способствует ее первичному заживлению.
Для компенсации углеводного обмена, улучшения кровотока и восстановления функций эндотелия и системы гемостаза применяют три группы препаратов.
А Первая группа (тиенопиридины) показана пациентам с синдромом диабетической стопы, связанным с периферической полинейропатией. Физиологический антиоксидант (тиоктовая кислота) блокирует избыточные свободные радикалы, предотвращает образование конечных продуктов гли-кирования, которые играют ключевую роль в развитии нейропатии.
А Ко второй группе относятся простагландиновые производные (вазо-простан), ингибирующие активацию нейтрофильных гранулоцитов, угнета-
482
ет высвобождение свободных радикалов, лизосомальных ферментов и медиаторов хемотаксиса. Увеличению кровотока способствуют сильные вазо-дилататорные свойства препарата, что проявляется прямым действием на мышечные клетки сосудистой стенки, купированием болевого синдрома, уменьшением трофических и даже заживлением язв.
А К третьей группе относят гликозаминогликаны (сулодексид), которые способствуют восстановлению функции и антитромботического потенциала стенок микрососудов, воздействуют на реологические свойства крови, повышают фибринолиз, ослабляют метаболические изменения, лежащие в основе поражения сосудов при сахарном диабете.
А В лечении гнойных осложнений диабетической стопы применяют системную ферментотерапию (вобэнзим, флогэнзим).
А В связи с угнетением фагоцитарной активности нейтрофилов, снижением бактерицидной функции лейкоцитов, содержания иммуноглобулинов и компонентов системы комплемента в комплексном лечении больных сахарным диабетом используют средства, нормализующие иммунный статус.
17.7. Гнойные заболевания костей и суставов
Остеомиелит (osteomyelitis, греч. osteon кость + myelos местный мозг + itis) — инфекционно-воспалительный процесс, поражающий все элементы кости — костный мозг, компактную и губчатую кость, надкостницу.
Многообразие форм остеомиелита классифицируют по нескольким общим критериям.
А По этиологии выделяют неспецифический (вызывается гноеродными микробами) и специфический (вызывается возбудителями специфических инфекций — туберкулезный, сифилитический, бруцеллезный) остеомиелит.
А В зависимости от путей проникновения микроорганизмов в кость различают гематогенный остеомиелит (возбудители заносятся по кровеносным сосудам из отдаленных очагов воспаления) и негематогенный остеомиелит (происходит экзогенное инфицирование костной ткани: открытые повреждения и огнестрельные ранения, при распространении инфекционного воспаления на кость с соседних тканей и органов).
А По клиническому течению различают острый и хронический остеомиелит.
А В зависимости от локализации процесса выделяют остеомиелит трубчатых костей (эпифизарный, метаэпифизарный, диафизарный, тотальный) и остеомиелит плоских костей (тазовых, позвоночника, лопатки, черепа, грудины).
А По морфологическим изменениям различают диффузную, очаговую и диффузно-очаговую формы остеомиелита.
Существует и классификация осложнений остеомиелита.
А К местным осложнениям относят патологический перелом, деформацию конечности, аррозивное кровотечение, распространение гнойного воспаления по кости, образование гнойных очагов в мягких тканях, развитие артритов, патологического вывиха, ложных суставов, контрактур в смежных суставах; поражение сосудисто-нервных образований; реинфекция с нагноением постнекрэктомической костной полости.
А К общим — воспалительные осложнения со стороны внутренних органов (пневмония, гепатит, паранефрит), сепсис; обострение или прогрессиро-вание сопутствующих заболеваний (развитие диабетической комы, печеночно-почечная недостаточность на фоне амилоидоза); развитие токсико-аллергиче-ских, системных нарушений (анемия, ДВС-синдром, капилляротоксикоз).
483
17.7.1. Гематогенный остеомиелит
Острый гематогенный остеомиелит в 75—85 % случаев возникает у детей в возрасте от 1 до 14 лет. У взрослых обычно наблюдаются обострения и рецидивы этой болезни, перенесенной в детстве. Процесс поражает преимущественно длинные трубчатые, реже плоские и короткие кости. Наиболее часто страдают бедренная, болылеберцовая и плечевая кости; из коротких — кости стопы; из плоских — кости таза и верхней челюсти. Наблюдаются и множественные процессы.
Этиология и патогенез. Гематогенный остеомиелит вызывается, как правило, гноеродными микроорганизмами, из которых ведущую роль играют стафилококки (St. aureus), а также грамотрицательные микроорганизмы (Proteus, Pseudomonas aeruginosa, E. coli), гемолитический стрептококк. В подавляющем большинстве случаев гематогенный остеомиелит является моноинфекцией. Определенную роль играют вирусные инфекции, снижающие общую сопротивляемость организма и повышающие патогенные свойства гноеродных бактерий.
Первичным очагом (источником инфекции) у детей грудного возраста обычно являются рана пуповины, опрелости и потертости кожи. У детей старшего возраста и у взрослых эту роль выполняют очаги хронической инфекции (например, тонзиллиты, синуситы, кариозные зубы), гнойные заболевания мягких тканей (фурункул, абсцесс, панариций и др.), раневая инфекция. Под действием различных предрасполагающих и провоцирующих факторов, в том числе травм, патогенные бактерии проникают из первичного очага в кровеносное русло, развивается бактериемия. С током крови микроорганизмы достигают костного мозга, где и вызывают воспаление.
Сосудистая, или эмболическая, теория патогенеза, связывает возникновение остеомиелита с особенностями кровоснабжения длинных трубчатых костей у детей.
Аллергическая теория позволяет считать, что заболевание развивается только в сенсибилизированном организме при возникновении в кости асептического воспаления.
Согласно нервно-рефлекторной теории, возникновению остеомиелита способствует длительный рефлекторный спазм сосудов с нарушением кровообращения в кости.
В клиническом течении остеомиелита выделяют несколько стадий: острую (интрамедуллярная и экстрамедуллярная фазы), подострую (фазы выздоровления и продолжающегося процесса) и хроническую (фазы обострения, ремиссии и выздоровления).
По клиническому течению выделяют местную (очаговую) и генерализованную (септико-токсическую или септико-пиемическую) формы острого гематогенного остеомиелита.
Клиническая картина. Местная (очаговая) форма встречается чаще. Заболевание начинается остро, внезапно. В продромальный период (от нескольких часов до 2 сут) отмечают слабость, вялость, недомогание, озноб, после чего повышается температура тела и почти одновременно появляются выраженные постоянные распирающие боли в конечности. Обращает на себя внимание вынужденное положение конечности, резкое ограничение движений. Фокус наибольшей болезненности, соответствующий очагу воспаления, удается выявить при осторожной пальпации и «тишайшей» перкуссии кости пораженного сегмента. На 2—3-й день болезни возникает постепенно распространяющаяся отечность мягких тканей. С момента выхода гноя в
484
мягкие ткани интенсивность болей обычно снижается. К исходу 1-й недели отмечаются гиперемия, флюктуация и другие признаки параоссальной либо межмышечной флегмоны.
При генерализованной форме гематогенного остеомиелита ведущими в клинической картине становятся признаки общей интоксикации. Постоянная лихорадка до 39—40 °С, озноб нередко сопровождаются сыпью, менин-геальными симптомами, рвотой, диареей. При септико-пиемическом варианте выявляются симптомы гнойного метастатического поражения других органов (плеврит, гнойный перикардит, пиелонефрит, менингит), что еще более отягощает состояние больного. В септико-токсическом варианте (1— 3 % случаев) заболевание развивается столь стремительно, что признаки местного воспаления нередко не успевают проявиться. Ведущими являются такие яркие симптомы общей интоксикации, как помрачение и утрата сознания, гипотермия, судороги, сменяемые адинамическим состоянием, раздражение мозговых оболочек. Клиническая симптоматика и лабораторные изменения при этой форме остеомиелита практически полностью соответствуют картине септического шока. В ближайшие сутки возможно развитие полиорганной недостаточности, нередко со смертельным исходом.
Следует иметь в виду, что характерное начало заболевания может быть стертым при раннем начале антибиотикотерапии.
Диагностика острого гематогенного остеомиелита основывается на клинических данных, термографии, ультрасонографии, пункции кости (наличие гноя), остеотонометрии и внутрикостной термометрии (более 37,2 °С).
При радионуклидном исследовании скелета отмечается повышенное накопление радиофармпрепарата в зоне поражения. При МРТ на томограммах обнаруживают поражение костного мозга.
При успешном лечении изменения в костях на рентгенограммах могут вообще не появиться. Однако в большинстве случаев гематогенный остеомиелит сопровождается выраженными рентгенологическими симптомами, которые обнаруживают преимущественно к концу 2-й (у детей — к концу 1-й) недели после острого начала болезни. Если участок воспаления расположен в глубине кости, то самыми ранними рентгенологическими признаками являются локальный остеопороз и мелкие очаги разрушения костной ткани (деструктивные очаги).
Если участок воспаления локализуется поднадкостнично, то первым рентгенологическим симптомом оказываются периостальные наслоения, которые в течение процесса нарастают, очертания их становятся неровными (бахромчатый периостит). В острой фазе заболевания преобладают процессы разрушения, некроза и гнойного воспаления тканей. Их рентгенологическим отражением являются деструктивные очаги, секвестры и периостальные наслоения.
Переход острого процесса в хронический знаменуется появлением признаков реактивного воспаления вокруг омертвевших участков, отграничением очагов воспаления. Разрушение кости приостанавливается, края деструктивных очагов становятся более резкими, вокруг них возникает зона остеосклероза. Периостальные наслоения сливаются с поверхностью кости.
Лечение острого гематогенного остеомиелита должно быть ранним и комплексным. Комплекс лечебных мероприятий включает местное лечение, антибактериальную терапию и общее лечение. Задачами местного лечения являются постоянное удаление гноя и продуктов воспаления из очагов поражения, обеспечение декомпрессии костномозгового канала, снятие патологической импульсации из очага поражения, создание благоприятных ус-
485
ловий для репаративных процессов в костной ткани, снижение локальной температуры в очаге поражения.
Диагностическая остеопункция при подтверждении диагноза становится лечебным мероприятием, будучи дополнена внутрикостным введением антибиотиков в течение 7 сут. Пункционный метод применяют у детей в возрасте до 4—6 лет, когда в костномозговом канале еще не образовался гнойный экссудат.
Во всех других случаях выполняют оперативные вмешательства. В ин-трамедуллярной фазе применяют щадящие методы: декомпрессивную ос-теоперфорацию с последующим внутрикостномозговым лаважем через сквозной дренаж, щадящую декомпрессивную остеоперфорацию путем наложения малых фрезевых отверстий. В экстрамедуллярной фазе операцию дополняют вскрытием, по возможности радикальной хирургической обработкой и дренированием. Обязательна длительная (до полного стихания воспаления по клиническим и лабораторным данным) иммобилизация пораженной конечности.
Антибактериальное лечение начинают с первого часа поступления больного 2—3 антибиотиками широкого спектра действия, под контролем анти-биотикограммы не реже 1 раза в неделю. Предпочтение отдают внутриарте-риальному и внутривенному капельному введению; один из препаратов обычно вводят также внутрикостно.
Общее лечение включает детоксикационную, общеукрепляющую, стимулирующую и иммунотерапию, подобно программе лечения сепсиса.
17.7.2. Негематогенный остеомиелит
Различают несколько видов негематогенного остеомиелита.
Острый остеомиелит после огнестрельных ранений — разнообразный по характеру и клиническим проявлениям гнойно-воспалительный процесс вследствие огнестрельных повреждений костей.
Под воздействием высокой кинетической энергии ранящего снаряда возникают обширные стойкие нарушения крово- и лимфообращения в зоне ранения. На этапе развития гнойной инфекции в огнестрельной костной ране значительно угнетаются репаративные процессы. Нагноение в зоне огнестрельного перелома кости сопровождается образованием секвестров и регенерацией тканей. Очаг нагноения постепенно изолируется валом из грануляций, а в последующем и соединительнотканной капсулой.
Нагноение нередко распространяется в глубь мягких тканей и в толщу кости вдоль трещин и каналов, проделанных сместившимися в момент ранения костными осколками.
В результате пролиферации тканей формируется «костная мозоль», включающая в себя гнойники с секвестрами, из которой свищевые ходы ведут на поверхность кожи.
Отличительной особенностью огнестрельного остеомиелита губчатых костей является слабое отграничение гнойных очагов, часто с неуклонным прогрессированием процесса и скудное мозолеобразование.
Клиническая картина. Острый огнестрельный остеомиелит проявляется в первые 2—3 сут после ранения и обусловлен гнойным воспалением костного мозга вследствие прямого контакта отломков костей с инфицированными тканями в зоне перелома. Наблюдается характерная клиника токсико-резорбтивной лихорадки. Местные изменения включают гнойный экссудат, отек околораневых тканей, лимфаденит, тромбофлебит.
486
Рентгенологическая картина огнестрельного остеомиелита многообразна и трудна для интерпретации. На рентгенограммах, произведенных после ранения, определяется огнестрельный перелом кости. В течение 10 сут после повреждения щель перелома увеличивается, отмечается регионарный остеопороз, но эти симптомы наблюдаются после любого перелома и не могут быть основанием для установления диагноза остеомиелита. Лишь в начале 3-й недели и особенно к ее концу в краях отломков намечаются мелкие очаги разрушения, которые удается отличить от местного остеопо-роза ввиду их неравномерного распределения, размытых очертаний, наличия мелких секвестров в центре очагов.
Лечение острого огнестрельного остеомиелита комплексное и включает:
операцию вторичной хирургической обработки раны, в том числе поврежденных костных структур, обеспечение адекватного дренирования;
надежную лечебную иммобилизацию;
местное лечение раны в соответствии с фазностью раневого процесса;
восстановление и улучшение регионарного кровообращения и микроциркуляции;
антибактериальную терапию;
коррекцию гомеостаза, иммунотерапию.
А Острый травматический остеомиелит — инфекционный воспалительный процесс в кости, осложняющий открытые переломы неогнестрельного происхождения. Гнойное воспаление распространяется на все отделы кости без образования изолированного первичного очага в костном мозге, поэтому процесс иногда называют острым посттравматическим оститом, хотя чаще используют традиционное название «травматический остеомиелит».
Для посттравматического остеомиелита характерно экзогенное проникновение возбудителей — через рану или из соседних инфекционных очагов. Ведущими в патогенезе заболевания являются тяжесть и масштабы повреждения кости и окружающих анатомических структур, степень микробного загрязнения раны, особенности индивидуальной реакции организма на травму. В развитии посттравматического остеомиелита различают три этапа:
— острое воспаление в стенках раны с отграничением и частичным расплавлением некротизированных тканей;
— формирование гнойного очага, окруженного гноеродной оболочкой;
— образование длительно существующего гнойного очага после сращения перелома и восстановления функции поврежденного сегмента.
Острое воспаление начинается в мягких тканях в виде диффузной воспалительной инфильтрации с последующим отграничением некротизированных участков. Гнойное воспаление в костных отломках возникает параллельно с гнойным процессом в мягких тканях. Инфекционно-воспалительный очаг постепенно изолируется грануляционной тканью, позднее — соединительнотканной капсулой. При неблагоприятном течении раневого процесса гнойный процесс распространяется в глубокие слои мягких тканей и в кость. Параллельно с гнойным расплавлением и отторжением некротизированных участков мягких тканей секвестрируются и омертвевшие участки кости. При задержке гнойного экссудата в ране, развитии флегмоны и утяжелении общего состояния пострадавшего сроки формирования костного секвестра могут удлиняться. По мере развития пролиферативных процессов формируются гноеродная оболочка, а затем костная мозоль или только костные разрастания по периферии костных отломков (ложный сустав). Костная мозоль, как
487
правило, включает гнойные очаги, содержащие секвестры, что предопределяет потенциальную возможность обострения инфекционно-воспалительно-го процесса на любом этапе лечения. Подобное течение остеомиелита характеризуется истечением гноя через свищи, скоплением гнойного экссудата в виде затеков, развитием флегмон. Вспышки дремлющей инфекции нередко сопровождаются возникновением реактивных артритов и тромбофлебитов. При повреждении метафизарных участков процесс инфекционного воспаления чаще всего приобретает распространенный характер и сопровождается гнойным пропитыванием метаэпифизарной зоны кости.
Тактика хирургического лечения базируется на полноценной хирургической обработке костно-мышечной раны, на быстром восстановлении гомеостаза.
Острый остеомиелит, возникающий в результате перехода на кость гнойного воспаления с окружающих тканей, отличается некоторым своеобразием. Он начинается иногда незаметно при относительно длительном существовании гнойного процесса, особенно около костей, примыкающих к кожному покрову. Так начинается остеомиелит болынеберцовой кости при флег-монозной форме рожи, остеомиелит костной фаланги при подкожном панариции, остеомиелит костей свода черепа при обширных инфицированных ранах волосистой части головы с прогрессирующим гнойным лизисом апоневроза. Возможны также одонтогенный остеомиелит челюсти и ото-генный остеомиелит височной кости.
Диагностика этого вида остеомиелита не вызывает обычно больших затруднений. Несмотря на лечение, инфицированная рана, прилегающая к поверхности кости, в течение длительного времени не обнаруживает тенденции к заживлению или в этой области образуются гнойные свищи. При рентгенографии обычно обнаруживают характерные для остеомиелита изменения в кости. Лечение состоит в оперативном удалении секвестров, санации гнойного очага.
Хронический (вторичный) остеомиелит развивается при переходе любой клинической формы острого (гематогенный, огнестрельный, травматический, а также возникший при переходе гнойного процесса с окружающих тканей) остеомиелита в хроническую стадию. Имеющиеся в остром периоде морфологические и клинические различия между отдельными формами остеомиелита в хронической стадии сглаживаются, и процесс протекает в общем одинаково для всех этих форм.
Диагностика. Хронический остеомиелит с уверенностью можно диагностировать лишь при наличии триады признаков: гнойного свища, костного секвестра и рецидивирующего течения.
При переходе острого остеомиелита в хронический в области очага окончательно сформировываются гнойные свищи.
Свищ исходит из одного остеомиелитического очага или из разных, может быть одиночным или множественным, нередко несколько свищей соединяются друг с другом в мягких тканях, образуя сложную сеть инфицированных каналов.
Наружное отверстие свища иногда располагается на значительном удалении от остеомиелитического очага. Количество гнойного отделяемого может быть разным, но заметна тенденция к значительному уменьшению гноетечения. В мягких тканях в области поражения сохраняется воспалительная инфильтрация, постепенно уменьшающаяся по мере перехода в стадию ремиссии.
Гнойное воспаление ведет к некротизации и отделению участков кости. Секвестр может целиком или частично находиться в костной полости или полностью располагаться вне ее, в мягких тканях.
488
Лечение хронического остеомиелита носит комплексный характер. Хирургическое пособие радикальное: некрэктомия, санация и пластика пост-некрэктомической костной полости.
При радикальной некрэктомии удаляют все секвестры, вскрывают или ликвидируют все полости, удаляют все участки остеонекроза с внутренних стенок костных полостей, инфицированные грануляции и гнойный детрит, ликвидируют все свищи и инфицированные очаги в мягких тканях. Некрэктомию завершают многократным и обильным промыванием костной полости и раны растворами антисептиков (хлоргексидин).
Рану санируют всеми доступными методами с целью получения наибольшего антисептического эффекта. Используют промывание раны антисептиками, ультразвуковую кавитацию, лазерную обработку. Больший профилактический эффект дает аспирационно-промывное и аспирационное дренирование, особенно на фоне локальной гипотермии сегмента конечности. Наряду с этим применяют внутрикостное лазерное облучение местного воспалительного очага.
Заключительным этапом операции является пластика (пломбировка) костной полости разными методами — в зависимости от локализации и величины костной полости, состояния окружающих тканей, степени инфицированное™, радикальности выполнения некрэктомии.
Мышечные лоскуты выкраивают из прилегающих мышц с проксимальной или дистальной питающей ножкой.
Для хондро- и остеопластики костных полостей применяют, как правило, консервированную аллоткань.
Коллапан (биокомпозиционный материал), содержащий гидроксиапа-тит, коллаген и антибактериальные средства, введенный в дефект кости, создает антибактериальный фон, является «матрицей» для новообразую-щейся костной ткани и активизирует процесс остеогенеза.
Дренирование, особенно вакуумное и промывное, является в большинстве случаев обязательным компонентом радикальной операции.
При промывном способе дренирования эффективны антисептики, диок-сидин, хлоргексидин и сочетание их с растворами протеаз. Местная энзи-мотерапия в виде проточного ферментативного диализа при дренировании костных полостей — один из наиболее эффективных санирующих методов.
К общим послеоперационным лечебным мероприятиям относится антибио-тикотерапия, при проведении которой следует придерживаться следующих основных положений: а) начинать только после радикальной операции; б) учитывать тропность антибиотиков в костной ткани и чувствительность к ним патогенной флоры; в) создавать высокие концентрации антибиотика в костной полости на длительный срок.
Лучшие результаты получают при введении высоких доз антибиотика в постнекрэктомическую костную полость перед зашиванием раны.
Показан комплекс иммунотерапии, включающий иммунные препараты парентерального (стафилококковый анатоксин, продигиозан, у ряда больных аутовакцина, у-глобулин), энтерального (метилурацил) и местного (бактериофаг) применения, что позволило повысить показатели иммунобиологической реактивности у больных после радикальной операции.
17.7.3. Атипичные формы остеомиелита
Атипичные формы остеомиелита (первично-хронический остеомиелит) с самого начала протекают подостро и диагностируются обычно в хронической стадии. В эту группу включают несколько заболеваний. Диагноз осно-
489
вывается на данных анамнеза, характерной клинической картине и данных рентгенографии.
При склерозирующем остеомиелите Гарре поражается диафиз длинной трубчатой кости, чаще болыдеберцовой или бедренной. На фоне бурной пролиферации и прогрессирующего склероза костной ткани развиваются небольшие деструктивные изменения. Патологический процесс может доходить до стадии гнойного воспаления, но никогда не заканчивается некрозом кости. В клинике заболевания отсутствуют выраженные острые явления: в мягких тканях определяются плотная припухлость, размягчение инфильтрата и образование свищей не наступает. Боли носят выраженный характер, усиливаются по ночам и служат поводом для подозрений на остео-генную саркому, неврит, радикулит. Рентгенологически обнаруживается веретенообразное утолщение диафизарной части кости в виде симметричной гомогенной муфты длиной до 8—12 см.
Абсцесс Броди — одна из форм гематогенного остеомиелита с локализацией ограниченного очага воспаления в эпиметафизарных отделах длинных трубчатых костей. Заболевание возникает в подростковом и юношеском возрасте, чаще у лиц мужского пола. Возбудителями являются различные штаммы стафилококков.
Для заболевания характерно хроническое течение после острого начала с повышением температуры до 39—40 °С в течение 2—3 сут. Одновременно или спустя 7—10 сут появляется локальная боль вблизи сустава ноющего характера, усиливающаяся при физической нагрузке, а позднее и по ночам. Имеются небольшая припухлость мягких тканей над очагом поражения, местное повышение температуры, более четко выражена сосудистая сеть. Возможны обострения, которые протекают без повышения температуры тела и проявляются болями. Свищи никогда не образуются. Из-за близости очага к суставу нередко в картине заболевания на первый план могут выступать суставные явления. Протекает абсцесс Броди доброкачественно. Диагноз устанавливается только после рентгенологического исследования.
На рентгенограммах абсцесс Броди представляется в виде изолированной округлой или овальной полости в губчатом костном веществе метафиза или метаэпифиза диаметром 2—3 см.
При альбуминозном остеомиелите Оллье серозный экссудат, богатый белком, не приобретает гнойного характера, и процесс «застывает» на стадии серозного воспаления, что объясняют слабой вирулентностью микроба, особенностями реактивного фона. Патологические изменения локализуются в наружных отделах кости, изредка образуются мелкие секвестры. Последующие репаративные процессы приводят к утолщению кости.
При наличии показаний к оперативному лечению проводят хирургическую обработку костных полостей по описанным выше правилам их санации. При отсутствии необходимости в секвестрэктомии и иссечении свищей проводят консервативное лечение и динамическое наблюдение за больным.
17.7.4. Гнойный артрит
Гнойный артрит (arthritis purulenta) — воспалительный процесс в суставе, вызванный гноеродной микробной флорой. Возбудитель гнойного артрита — гноеродная микробная флора. Среди возбудителей преобладает стафилококк, но встречаются и другие (стрептококк, пневмококк, энтеробак-терии, гонококк). Острый гнойный артрит бывает первичным и вторич-
490
ным. Первичное инфицирование происходит при ранении сустава. При вторичном инфицировании патогенная гноеродная микрофлора попадает в сустав гематогенным путем из отдаленных гнойных очагов или при гнойном воспалении окружающих сустав тканей. Воспалительный процесс в суставе быстро приводит к экссудации, гиперемии, отеку и лейкоцитарной инфильтрации синовиальной оболочки (синовит). Воспаление очень редко ограничивается синовиальной оболочкой, а распространяется на всю суставную сумку, что приводит к развитию флегмоны суставной сумки. Распространение воспаления на окружающие ткани способствует образованию параартикулярной флегмоны. Дальнейшее прогрессирование гнойного процесса может привести к развитию обширных гнойных затеков.
Гнойным воспалительным процессом чаще всего поражаются коленный сустав (гонит), тазобедренный (коксит), плечевой (омартрит); другие суставы вовлекаются в воспалительный процесс реже.
Клиническая картина: острое начало, сильная боль и ограничение движений в суставе, напряжение, инфильтрация и гиперемия кожных покровов, изменение контура сустава. При осложнении процесса появляются местные признаки флегмоны. К общим клиническим симптомам относятся проявления гнойной интоксикации: высокая температура тела, слабость, недомогание, озноб, потливость, угнетение сознания, прогрессирующая анемия.
Диагностика. Обследование больных острым гнойным артритом имеет свои особенности. При сборе анамнеза необходимо выяснить наличие травмы сустава. При отсутствии травмы предполагается гематогенный путь инфицирования сустава. При осмотре обращают внимание на вынужденное (полусогнутое) положение конечности, наличие гиперемии кожных покровов, степень изменения конфигурации сустава. При этом пораженный сустав сравнивают с симметричным. При пальпации определяются местная гипертермия кожи над суставом, болезненность, флюктуация, указывающая на скопление жидкости в полости сустава или на наличие параартикулярной флегмоны. При большом количестве выпота в коленном суставе отмечается симптом баллотирования надколенника. Необходимо определить объем движений в пораженном суставе; степень их ограничения косвенно указывает на выраженность воспалительного процесса.
Большое значение для исследования имеет пункция сустава: по характеру выпота удается уточнить особенность воспалительного процесса (серозный, гнойный, гнойно-геморрагический). Проводят микробиологическое исследование эвакуированного выпота для определения вида патогенной микрофлоры и ее чувствительности к антибиотикам.
Рентгенологическое исследование при остром гнойном артрите позволяет обнаружить расширение суставной щели, остеопороз в эпифизарных концах костей пораженного сустава.
Лечение острого гнойного артрита включает как местные, так и общетерапевтические мероприятия. Местное лечение: пункция сустава с эвакуацией гнойного выпота, промывание полости сустава антисептическим раствором и затем введение антибиотиков; иммобилизация конечности с помощью гипсовой лонгеты или лечебной шины; физиотерапия: УВЧ, кварцевое облучение, электрофорез трипсина, антибиотиков и др. После стихания воспалительного процесса назначают лечебную физкультуру, массаж и другие мероприятия для восстановления функции сустава.
Хирургическое вмешательство — артротомия — показано лишь в случаях, когда пункционный метод лечения с общей и местной антибактериальной терапией оказывается безуспешным. При артротомии из полости сустава
491
эвакуируют гнойный выпот, фибринозные пленки, после чего вводят дренажи для активного длительного промывного санирования.
Мерами профилактики острого гнойного артрита являются тщательная первичная хирургическая обработка ран при ранениях сустава, строгое соблюдение асептики при ортопедических операциях и правильное лечение гнойных процессов в тканях, прилежащих к суставу.
17.7.5. Гнойный бурсит
Бурсит — воспаление слизистых сумок, которые представляют собой ограниченные соединительнотканные мешки с гладкой внутренней поверхностью, покрытой эндотелием, выделяющим синовиальную жидкость. При скоплении гноя в сумке развивается гнойный бурсит. Возбудителями острого бурсита являются гноеродные микробы, преимущественно стафилококки и стрептококки, реже — специфические виды бактерий, гонококки, пневмококки, туберкулезная и кишечная палочка (в таких случаях развивается специфический бурсит). Микробы могут проникать в суставные сумки по лимфатическим путям из расположенных вблизи гнойных очагов (рожа, флегмона, карбункул, фурункул, остеомиелит). Острым бурситом могут осложняться и другие заболевания: ангина, грипп, ревматизм.
Чаще встречается острый гнойный бурсит локтевой слизистой сумки и слизистых сумок коленного и плечевого суставов.
Клиническая картина. При осмотре и пальпации выявляют округлую опухоль значительных размеров в месте расположения сумки, болезненную при ощупывании, отечность кожи, местное повышение температуры. Может определяться флюктуация. Иногда отмечается незначительное нарушение функции конечности.
Изменения общего состояния выражаются в общей слабости, повышении температуры тела до 38—38,5 °С.
Диагностика гнойного бурсита складывается из типичных признаков острого гнойного воспаления. Она облегчается пункцией полости сумки с отсасыванием и исследованием экссудата. Помогают тщательно собранный анамнез, бактериологическое исследование гноя на наличие специфических возбудителей. Основным дифференциально-диагностическим признаком, позволяющим отличить бурсит от артрита, является сохранение движений в суставе.
Лечение на ранних стадиях заболевания сводится к пункциям слизистой сумки с удалением гноя и введением антибиотиков, что нередко приводит к излечению. При безуспешности мер показано хирургическое вмешательство — вскрытие сумки и удаление гноя с последующим лечением гнойной раны.
Для предупреждения развития гнойного бурсита необходимо раннее и активное лечение серозной формы острого бурсита.
При затянувшемся течении острого бурсита показана пункция полости сумки с отсасыванием экссудата и введением в нее антибиотиков в растворе новокаина.
17.8. Хирургический сепсис
Сепсис (гнилокровие) — патологическое состояние организма, возникающее при распространении инфекции по кровеносному и лимфатическому руслу из первичного очага в другие органы, характеризующееся при-
492
знаками общей воспалительной реакции с тяжелым клиническим течением и приводящее к полиорганной недостаточности вследствие неспособности иммунных сил организма к локализации инфекции.
Классификация сепсиса:
по локализации первичного очага: общехирургический, раневой (ожоговый), посттравматический, абдоминальный, ангиогенный, урологический, гинекологический;
по виду и характеру возбудителя: вызванный аэробной флорой: грампо-ложительный сепсис — стафилококковый, стрептококковый; грамот-рицательный сепсис: колибациллярный, псевдомонозный, протейный; вызванный анаэробной флорой: клостридиальный; неклостридиальный;
по характеру генерализации инфекции: септицемия (сепсис без метастазов), пиемия (сепсис с метастазами) и септикопиемия (смешанные формы сепсиса);
по фазам развития: фаза напряжения (реакция организма в ответ на внедрение возбудителя в условиях несостоятельности его защитных сил); катаболическая фаза (прогрессивная недостаточность ферментных и структурных факторов с развитием недостаточности систем организма), анаболическая фаза (восстановление организмом утраченных резервных материалов);
по клиническому течению: молниеносный — клиническая картина развертывается в течение 1—2 сут; острый — в течение 5—7 сут без ремиссий; подострый — 7—14 сут; хронический — более 3 мес и нередкими ремиссиями;
по времени развития: ранний, возникающий в сроки до 2 нед; поздний — более 2 нед.
Существуют также критерии диагностики и классификация, предложенные Чикагской согласительной конференцией Американского колледжа торакальных врачей и Общества специалистов критической медицины (табл. 17.7).
Таблица 17.7. Классификация сепсиса
|
Клинический синдром |
Характеристика |
|
ССВР Сепсис Легкий сепсис Сепсис средней тяжести Тяжелый сепсис Септический шок |
Синдром системной воспалительной реакции на различные тяжелые повреждения тканей, проявляющийся двумя и более из следующих признаков: — температура тела выше 38 °С или ниже 36 °С; — тахикардия более 90 уд/мин; — частота дыхания более 20 в 1 мин; — число лейкоцитов более 12 • 109/л, палочкоядерных нейтрофилов — менее 4 • 109/л или не менее 10 % незрелых клеток (палочкоядерные, юные) ССВР при выявлении очага инфекции ССВР + гнойно-воспалительный очаг + полиорганная дисфункция по 1—2 системам ССВР + гнойно-воспалительный очаг + полиорганная дисфункция по 3 системам и более ССВР + гнойно-воспалительный очаг + полиорганная недостаточность Сепсис с гипотензией (ниже 90 мм рт. ст.), сохраняющейся несмотря на адекватную коррекцию гиповоле-мии + синдром гипоциркуляции |
493
Продолжение
|
Клинический синдром |
Характеристика |
|
Синдром полиорганной дисфункции Синдром полиорганной недостаточности |
Органные функциональные нарушения печени, почек, легких, сердца, головного мозга, костного мозга, своевременная и адекватная терапия которых позволяет ликвидировать дисфункцию в сроки до 7 сут Органные нарушения печени, легких, сердца, головного мозга, костного мозга, при которых даже своевременная и адекватная терапия не позволяет ликвидировать недостаточность в сроки до 7 сут |
Помимо воспалительного процесса, ССВР может быть вызван неинфекционными причинами — панкреатит, ишемия, тяжелая сочетанная травма (ранения), геморрагический шок, повреждения органа иммунологического характера или экзогенное введение медиаторов воспаления (фактор некроза опухоли, цитокины).
17.8.1. Этиология и патогенез сепсиса
Возбудителями сепсиса могут являться бактерии и грибы; на долю первых приходится более 95 % случаев, а также почти все существующие патогенные и условно-патогенные бактерии. Этиологическая структура сепсиса периодически меняется в связи с трансформацией патогенных свойств микробов, изменением реактивности макроорганизма и экологических условий.
Для стафилококкового сепсиса характерны пиемические метастазы в различные органы и частые септические пневмонии. Входными воротами инфекции, как правило, являются обширные раневые поверхности, особенно при наличии некротизированных тканей и нарушении оттока гнойного отделяемого. В закрытых очагах при наличии фиброзной капсулы стафилококки могут долго сохраняться, являясь источником дремлющей инфекции.
Общая стрептококковая инфекция отличается тяжестью клинического течения и отсутствием метастазов. Стрептококки чаще, чем стафилококки, распространяются по лимфатическим путям, вызывая лимфангиты и лимфадениты. Возбудители продуцируют агрессивные и повреждающие факторы. Для стрептококкового сепсиса характерно частое сочетание с другими видами возбудителей. Приобретенный иммунитет нестоек. Чаще вьщеляют гемокультуры пиогенного стрептококка, зеленящего и гемолитического стрептококков, реже — пневмококков.
Синегнойный сепсис — один из наиболее тяжелых, часто протекает молниеносно с выраженным инфекционно-токсическим шоком. Возбудитель обитает на ожоговых поверхностях, реже — в гнойных затеках. Патогенетическим фактором является эндотоксин, обладающий выраженными протео-литическими свойствами. Специфический иммунитет обычно отсутствует. Синегнойная палочка выделяется в ассоциации со стрептококками.
В симбиозе с синегнойной палочкой и другими аэробными и анаэробными бактериями часто находится протей, что приводит к развитию смешанной инфекции, или суперинфекции. В сочетании с гнилостными анаэробами он вызывает воспаление, по клиническим проявлениям сходное с газовой гангреной. Патогенность протея обусловлена наличием у него
494
гиауронидазной активности и токсигенности, а клиническая картина — быстрым распространением некрозов по клетчатке и фасциальным пространствам.
Кишечная палочка является основным возбудителем абдоминального сепсиса и нередко вызывает эндотоксический шок. Из первичного очага инфекции чаще выделяется в ассоциации с другими видами бактерий, в том числе с анаэробами.
Вопрос об этиологической роли спорообразующих аэробных бактерий рода Bacillus при бактериемии решается неоднозначно. Большинство исследователей считают их контаминантами, загрязняющими кровь при взятии биологического материала или в процессе субкультивирования. Согласно другой точке зрения, относительно безвредные микроорганизмы могут служить причиной опасных осложнений у ослабленных больных.
Анаэробные септицемии нередко вызываются токсигенными клостридия-ми. Анаэробная инфекция чаще обусловлена полимикробной ассоциацией, но в каждом случае преобладает определенный микроб, накладывающий отпечаток на течение заболевания. Для С. perfringens характерно газообразование в ране, С. oedematiens вызывают отек, а С. septicum — некроз тканей. Клостридиальная инфекция очень редко сопровождается метастазиро-ванием, но обычно протекает тяжело с высокой летальностью.
В последние годы в связи с совершенствованием бактериологических методов диагностики чаще выявляют неспороносные анаэробы: бактероиды, фузобактерии, пептококки, пептострептококки. Наиболее распространены бактероиды, обусловливающие своеобразную клиническую картину сепсиса — образование метастатических гнойников в крупных суставах, брюшной и плевральной полостях, легких, головном мозге и других висцеральных органах. Они продуцируют протеолитические ферменты, способствующие усилению инвазивных свойств и распространению других возбудителей, а также энзим, разрушающий гепарин, что ведет к образованию тромбозов и эмболии. В их присутствии чаще наблюдается ДВС-синдром.
Кандидаты й сепсис возникает значительно реже и вызывается в основном С. albicans и С. tropicalis. Генерализация инфекции обусловлена выделением токсичных субстанций и способностью дрожжеподобных грибов рода Candida размножаться в макрофагах. Иммунитет к ним не вырабатывается.
В настоящее время в этиологии раневой инфекции возрастает удельный вес полимикробного сепсиса (10—50 % случаев), что отражает общую тенденцию в эволюции заболеваний, вызываемых условно-патогенными бактериями.
Интегральное взаимодействие макро- и микроорганизма носит динамический характер, и системная воспалительная реакция вначале в виде локального ответа на повреждение или инфекцию при сепсисе может быстро стать хаотическим нарушением всех механизмов противоинфекционной защиты.
Центральным звеном патогенеза грамотрицательного сепсиса является эндотоксин, или липополисахарид. Последний в комплексе с липополисаха-ридсвязывающим белком активирует макрофаги и синтез в них провоспа-лительных антигенов. Последние обладают широким спектром биологического действия, проявляющегося в многообразных изменениях метаболизма, гемопоэза, свойств сосудистой стенки, функции регуляторных систем, в первую очередь ЦНС. При высокой концентрации эндотоксина в крови возможна агломерация или опсонизация клеток организма, в том числе эн-дотелиальных. Прямое повреждение клеток эндотелия играет большую роль в развитии полиорганной недостаточности.
495
Патогенез грамположительного сепсиса обусловлен взаимодействием поверхностных структур микробных клеток с компонентами иммунной системы человека.
Следует отметить, что при септических состояниях в процессе лизиса бактерий происходит накопление так называемых молекул средней массы, ингибирующих ряд метаболических процессов и нарушающих многие функции форменных элементов крови.
Таким образом, начальным этапом в развитии «каскада» септических реакций является появление в сосудистом русле больного антигенов, выполняющих роль триггера (спускового курка), провоцирующего запуск эндотоксина при грамотрицательной бактериемии, бактериальных грамположи-тельных или дрожжевых фрагментов стенок, частиц вирусов или грибов, продуктов разрушения собственных тканей организма.
Активация иммунитета в ответ на инвазию антигенов, кроме защитной функции, имеет оборотную сторону — выделение большого числа провоспалительных агентов (фактор некроза опухолей — альфа, интерлейкин-1р, 2, 6, 8, 15, фактор активации тромбоцитов, тромбоксан, фосфолипаза А2, свободные радикалы кислорода, простациклин, простагландины, интерферон-у), играющих патогенетическую роль в развитии системного воспаления и интоксикации.
Часть из них (фактор некроза опухолей-альфа, фактор активации тромбоцитов, тромбоксан) в значительной степени ответственны за развитие синдрома внутрисо-судистого диссеминированного свертывания, другие (ИЛ-1, лейкотриены, эндоте-лиальный фактор релаксации, эндотелии-1, тромбоксан А2, интерферон-у) способствуют повышению проницаемости сосудистой стенки при сепсисе. Нарушение функции эндотелия является центральным звеном распространения системного воспаления за границы сосудистого русла и его неблагоприятного действия на печень, почки, легкие, центральную нервную систему. Вслед за повреждением эндотелия нарушается метаболическая активность клеток этих и других органов, проявляющаяся снижением тонуса сосудов, нарушением режима микроциркуляции — признаками полиорганной недостаточности.
Иммунная система организма, помимо различных активирующих цито-кинов, способна продуцировать и их инактиваторы, противовоспалительные агенты (ИЛ-4,10,13, ИЛ-1 и ИЛ-2 растворимый рецептор, белки, связывающие липополисахариды, трансформирующий фактор роста-р\ адреналин, ФНО-а растворимый рецептор, антагонист рецептора лейкотриена В4, белок «теплового шока»).
В случае нормального течения инфекционного процесса достигается равновесие активности провоспалительных и противовоспалительных цито-кинов.
Разбалансированный иммунный ответ может проявляться активацией про-и противовоспалительных агентов и постоянными их колебаниями, что клинически обычно соответствует фазе синдрома полиорганной недостаточности. Длительно существующие нарушения иммунных реакций обусловливают постепенный переход сепсиса в форму под острого и далее хронического.
Клиническая картина сепсиса в большой степени обусловлена характером резистентности организма больного, выраженностью ответной реакции на внедрение и распространение микроорганизмов, их количеством и вирулентностью.
Классические проявления системной воспалительной реакции, составляющие симптомокомплекс сепсиса (лихорадка, тахикардия, одышка и лейкоцитоз), недостаточно чувствительны и специфичны для точной диагностики. Клиническая картина, подобная сепсису, нередко наблюдается у пациентов со стерильными формами панкреонекроза, тяжелой травмой, ожога-
496
(^pg!2^2Ј^

Рис. 17.21. Основные компоненты интенсивной терапии сепсиса.
ми, лекарственной реакцией, после обширных хирургических вмешательств и даже при тяжелой сердечной недостаточности.
Одним из наиболее частых симптомов, присущих сепсису, является изменение терморегуляции в сторону гипертермии (чаще всего) или гипотермии (реже). Повышение температуры тела вызывают пирогенные цитокины (прямое и опосредованное действие на гипоталамус), которые выделяют в кровь преимущественно моноциты и макрофаги в ответ на внедрение инфекции. Наиболее типична для сепсиса нестабильная гипертермия в течение суток: характерны внезапные кратковременные подъемы температуры тела один или несколько раз в течение суток с последующим литическим снижением, проливными потами, слабостью, тахикардией и одышкой. Озноб свидетельствует о массивной инвазии тканевых и микробных антигенов. Данный период является наиболее благоприятным для диагностического посева крови на гемокультуру.
Прогностически неблагоприятным признаком является неожиданное снижение температуры тела у таких больных до нормы (или даже ниже нормы) при отсутствии положительной динамики общего состояния.
Бактериемия и сепсис. Бактериемия — присутствие микроорганизма в системном кровотоке — не является обязательным проявлением сепсиса. Обнаружение микроорганизмов у лиц без клинико-лабораторных подтверждений синдрома системного воспалительного ответа, но при наличии
497
факторов риска должно расцениваться не как сепсис, а как транзиторная бактериемия. Ее возникновение описано после лечебных и диагностических манипуляций, таких как бронхо- и фиброгастроскопия, колоноско-пия, стоматологические манипуляции.
Даже при самом скрупулезном соблюдении техники забора крови и использовании современных технологий идентификации микроорганизмов частота положительных результатов при посевах крови не превышает 55 %. Традиционным методом диагностики сепсиса является посев крови, при этом частота выделения гемокультуры существенно варьирует (от 22,5 до 87,5 %) и в значительной степени зависит от методики исследования.
Лечение хирургического сепсиса, основу которого составляет гнойный очаг, инициирующий генерализованную инфекцию, должно быть комбинированным (рис. 17.21).
Хирургическая санация — прекращение поступления микроорганизмов из очага инфекции посредством вскрытия очага с удалением гноя и некроти-зированных тканей, а также адекватного дренирования гнойной полости, занимает ведущее место.
17.8.2. Приоритетные методы интенсивной терапии сепсиса
Рациональный выбор режима антибактериальной терапии сепсиса определяется локализацией источника (очага) инфекции и условиями возникновения инфекции (внебольничная или госпитальная). Если есть основания предположить внебольничный характер инфекции, то препаратами выбора могут быть целофалоспорины III поколения (цефотаксим, цефтриак-сон). Допустимо также использование цефалоспоринов II поколения или защищенных пенициллинов в комбинации с аминогликозидами.
Инфузионная терапия при сепсисе способствует восстановлению адекватной тканевой и органной перфузии, повышению потребления кислорода тканями, коррекции гомеостатических расстройств, снижению концентрации токсических субстанций и медиаторов септического каскада.
Инфузионная программа зависит от степени гиповолемии, фазы ДВС-синдрома, уровня альбумина крови, тяжести респираторного дистресс-синдрома. Плазмозаменители (декстраны, желатиноль, гидроксиэтиламидоны) показаны при выраженном дефиците ОЦК, сочетающемся с артериальной гипотензией. Переливание альбумина имеет преимущество перед искусственными плазмозаменителями при уровне альбумина менее 25—30 г/л.
Применение криоплазмы (15 мл/кг массы) показано при дефиците антитромбина III (AT III) или плазменных факторов коагуляции.
Восстановлению адекватной тканевой и органной перфузии способствуют инфузионно-трансфузионная терапия в режиме гемодилюции и использование гепарина (10—20 тыс. ЕД/сут внутривенно), трентала — 10—20 мл/сут.
При сердечной недостаточности начинают инфузию добутрекса (5— 7,5 мкг/кг/мин) или допамина (5—10 мкг/кг/мин). При развитии септического шокового синдрома показано введение адреналина (0,05—0,1 мкг/кг/мин).
Адекватная и своевременная респираторная поддержка — один из главных моментов лечения сепсиса. Для купирования респираторного дистресс-синдрома используют механическую вентиляцию легких, кортикостероиды, му-колитические средства, синтетические и естественные сурфактанты.
При тяжелом течении сепсиса наблюдается развитие вторичного иммунодефицита, наиболее типичного для хирургической инфекции. Направленная иммунокоррекция проводится в соответствии с выявленным дефек-
том конкретного звена иммунитета — заместительная (взвесь лейкоцитов, интерферон, гипериммунная антистафилококковая плазма, иммуноглобулины для внутривенного введения и др.), иммуностимулирующая (стафилококковый анатоксин, тималин и др.) терапия.
Ингибиторы свободных радикалов показаны в силу активации при сепсисе процессов свободнорадикального окисления и развития дисбаланса в системе перекисного окисления липидов — антиоксидантной системы, усиливающего структурные органные повреждения. Наибольшее увеличение скорости свободнорадикального окисления наблюдается при сепсисе, сочетающемся с респираторным дистресс-синдромом. Для повышения антиокислительного потенциала к терапии добавляют унитиол, витамин С, токоферол, синтетические антиоксиданты (эмоксипин, мексидол и др.).
Современные методы лечения сепсиса предусматривают цитокиновую терапию [ронколейкин (ИЛ-2), беталейкин (ИЛ-ip), рекомбинантный гра-нулоцитарно-макрофагальный колониестимулирующий фактор и др.)].
Восстановление функции печени осуществляют внутрипортальной оксиге-нацией, введением эссенциальных фосфолипидов, даларгина, трансплантации изолированных гепатоцитов.
Тяжелый сепсис, как правило, сопровождается проявлениями гиперметаболизма. В этой ситуации покрытие энергетических потребностей происходит за счет деструкции собственных клеточных структур («аутоканниба-лизм»), что усугубляет органную дисфункцию и усиливает эндотоксикоз. Поэтому проведение искусственной питательной поддержки является очень важным компонентом лечения. Оптимальное суточное потребление энергии — 30—35 ккал/кг. Назначают энтеральное питание специальными смесями, которые сбалансированы по основным питательным компонентам, высококалорийны, содержат добавки микроэлементов и витаминов. Энтеральное питание предупреждает транслокацию микрофлоры из кишечника, развитие дисбактериоза, повышает функциональную активность энтероци-та и защитные свойства слизистой оболочки, снижая степень эндотоксико-за и риск возникновения вторичных инфекционных осложнений.
Наиболее эффективными методами детоксикации при сепсисе являются экстракорпоральные — обменный плазмаферез, перфузия крови через свиную селезенку, плазмосорбция.
17.8.3. Клинические формы хирургического сепсиса
Клинические формы хирургического сепсиса вариабильны.
Абдоминальный сепсис является системной воспалительной реакцией организма в ответ на развитие первоначально деструктивного процесса в органах брюшной полости и/или забрюшинного пространства. Основу абдоминального сепсиса в подавляющем числе случаев составляет распространенный перитонит на почве деструктивных процессов или перфораций органов брюшной полости, а также в результате закрытой травмы и ранений живота, реже — послеоперационный.
Основную роль играет неэффективная хирургическая санация гнойно-воспалительного очага в брюшной полости, продолжающийся перитонит или несвоевременное хирургическое и интенсивное лечение (позднее поступление больных в стационар).
Схема комплексного лечения абдоминального сепсиса предусматривает воздействие на все звенья его патогенеза. После поступления больных в стационар проводят экстренную адекватную предоперационную подготовку
499
до стабилизации гемодинамики, уменьшения сгущения крови, разгрузки верхних отделов желудочно-кишечного тракта. Через 2—4 ч выполняют экстренную хирургическую операцию, направленную на удаление источника перитонита и тщательную санацию брюшной полости.
Важная роль в лечении абдоминального сепсиса отводится рациональной интенсивной терапии, основные принципы которой изложены в начале настоящей главы.
Сепсис с локализацией первичного очага в сосудистом русле (катетериза-ционный сепсис) возникает, если патогенные возбудители генерализованной инфекции и их токсины поступают в кровоток, минуя биологические барьеры организма. Проблема ангиогенного сепсиса в хирургии обусловлена широким внедрением в клиническую практику различных инвазивных методов диагностики и лечения заболеваний. Нарушение целости сосудистой стенки инструментами из синтетических материалов (катетеры, сосудистые трансплантаты, сердечные клапаны) повысило риск развития генерализованной инфекции.
17.9. Специфическая хирургическая инфекция 17.9.1. Столбняк
Столбняк (tetanus) — раневая инфекционная болезнь, вызываемая токсином анаэробной спороносной палочки Clostridium tetani при ее проникновении в организм через дефект кожи или слизистой оболочки, характеризующаяся поражением нервной системы, приступами тонических и тетани-ческих судорог, гипоксией и сердечно-легочной недостаточностью.
Заболеваемость столбняком во всем мире сохраняется на достаточно высоком уровне, несмотря на широкий охват населения вакцинопрофилакти-кой. Частота осложнений ран столбняком составляет 0,6—0,7 на 1 тыс. ранений. Летальность составляет 25—50 % среди больных молодого возраста и 70—80 % среди лиц пожилого возраста.
Возбудитель столбняка cl. tetani — строго анаэробный, спорообразую-щий, грамположительный микроб. Споры его высокоустойчивы, они могут выжить при кипячении и сухом нагревании до 150 °С в течение 1 ч; в обычных условиях сохраняются десятилетиями. Входными воротами для столбняка могут служить любые, даже самые незначительные раны. В военное время это, как правило, огнестрельные раны, а в мирное — микротравмы, особенно содержащие инородные тела.
Распространяется столбнячный токсин из места его образования или введения несколькими путями: по окружающим тканям, по лимфатической и кровяной системе, по нервным стволам. При распространении столбнячного токсина по регионарному невральному пути возникает относительно локальное поражение соответствующих нервных центров, которое проявляется развитием местного столбняка соответствующих мышц. Если количество столбнячного токсина значительно, он может далее распространяться по спинному мозгу в восходящем направлении, охватывая новые нервные центры (восходящий столбняк). При поступлении столбнячного токсина первоначально в кровь он разносится по всему организму (гематогенный путь распространения), попадает в мышцы и затем по двигательным нервам, составляющим общий невральный путь, достигает различных двигательных центров. Время поступления его в центры находится в прямой за-
500
висимости от длины каждого нерва. Поэтому вначале столбнячный токсин достигает двигательных центров мимических и жевательных мышц, затем мышц шеи, спины, а на более поздних этапах поражаются центры мышц рук и ног. Нисходящее движение столбнячного токсина имеет место в том случае, когда возникает депо столбнячного токсина в верхних отделах спинного мозга (при лицевом столбняке). При генерализованном процесе в последнюю очередь вовлекаются дыхательные мышцы, в частности диафрагма.
Клиническая картина. Поражение вегетативных центров проявляется в виде проливного пота, гиперпирексии, тахикардии, наклонности к гипо-тензии. Меньшую роль играет прямое патологическое влияние токсина на сердце, легкие, кровь, печень.
Лимфатические узлы при столбняке могут выполнять роль временных резервуаров столбнячного экзотоксина.
Различают общую и местную форму столбняка. Последняя встречается редко и сопровождается длительной ригидностью конечности, на которой имеется рана. Такая форма заболевания не опасна для жизни, так как судороги самостоятельно ликвидируются на фоне лечения раны.
Типичной местной разновидностью является лицевой столбняк Розе, при котором наряду с тризмом на пораженной стороне развивается паралич мышц лица, нередко и мышц глазного яблока, а на противоположной стороне обычно отмечается напряжение мышц лица и сужение глазной щели.
Однако местные формы столбняка могут привести и к летальному исходу из-за развития ларингоспазма.
Классическое описание клинической картины столбняка было дано еще Гиппократом, сын которого умер от этой грозной инфекции. Болезнь всегда проявляется триадой симптомов: тризмом, дисфагией и ригидностью затылочных мышц. Наиболее ранним и имеющим особое диагностическое значение симптомом столбняка является тризм — тоническое сокращение жевательных мышц. В начале заболевания тризм проявляется умеренным затруднением при жевании и открывании рта, а затем прогрессирует вплоть до полной невозможности разомнуть зубы. При этом отмечаются боли в горле и расстройства глотания.
Для клинической картины столбняка также характерна сардоническая улыбка, возникающая вследствие тонического сокращения мимических мышц и придающая лицу своеобразное выражение одновременно улыбки и плача.
К тризму и дисфагии последовательно в нисходящем порядке присоединяются «тянущие» боли и ригидность затылочных мышц, которая распространяется на длинные мышцы спины, поясницы, передней брюшной стенки и проксимальных отделов конечностей.
Судороги вначале проявляются в виде спастической ригидности, распространяющейся сверху вниз и постепенно захватывающей мышцы туловища и нижних конечностей.
На фоне тонического гипертонуса возникают приступы болезненных клонических судорог, провоцируемых любыми, даже незначительными раздражителями (свет, звук, прикосновение).
Быстрое нарастание клинических симптомов столбняка свидетельствует о глубокой степени интоксикации организма и тяжести заболевания.
А При столбняке I степени тяжести продолжительность инкубационного периода составляет 3 нед, начального — 5 сут и более, а средние сроки обращения больных за медицинской помощью — 5—7 дней заболевания. Судорожный синдром в основном проявляется в виде умеренного гиперто-
501
нуса мышц спины, брюшного пресса. Непостоянные легкие клонические судороги не вызывают расстройств дыхания. Больные полностью сохраняют способность жевать и проглатывать пищу. Все симптомы самостоятельно исчезают за 2—3 нед.
А Инкубационный период при столбняке II степени тяжести составляет 2 нед, начальный — 4 сут и более, больных госпитализируют на 4—5-й день заболевания. Клиническая картина либо вовсе не нарастает, либо прогрессирует очень медленно. Мышечный гипертонус выражен умеренно, редкие клонические судороги практически не сопровождаются нарушением дыхания. Жевание и глотание пищи затруднены в значительной степени. Общая продолжительность болезни не превышает 3 нед.
Л При столбняке III степени тяжести инкубационный период колеблется от 9 до 15 сут, начальный период составляет 3—4 сут, а больных обычно госпитализируют на 2—3-й день заболевания. Уже при поступлении возможны сильные приступы клонико-тонических судорог с опасными расстройствами дыхания. Поэтому врач, принимающий больного, должен быть готов к оказанию помощи при внезапном приступе апноэтического криза. Частота и сила судорог прогрессируют очень быстро, буквально по часам. Температура тела часто поднимается до 39 °С и выше, хотя может быть и субфебрильной. Пульс достигает 120—140 уд/мин. Резко выраженный тризм, расстройства глотания полностью исключают возможность кормления через рот. Введение нейролептической смеси, седуксена, гексе-нала, хлоралгидрата и других противосудорожных средств ликвидирует судороги при сохранении достаточного уровня спонтанного дыхания.
А Столбняк IV степени тяжести характеризуется наиболее коротким инкубационным периодом (5—8 сут), начальный период в большинстве наблюдений не превышает 1—1,5 сут, больных госпитализируют в 1-й день заболевания с уже выраженной клинической картиной и приступами судорог, ежеминутно угрожающими асфиксией. В ближайшие 1—2 сут, несмотря на введение предельно высоких доз наиболее сильных противосудорожных средств, приступы судорог усиливаются и учащаются, поэтому возникает необходимость систематического введения миорелаксантов с переводом больного на режим постоянной ИВЛ. Предельно высокий подъем температуры тела (40—41 °С) с тенденцией к дальнейшему росту может стать непосредственной причиной остановки сердца, если вовремя не прибегнуть к гипотермии — искусственному охлаждению больного. Тахикардия до 120—160 уд/мин может приводить к сердечной недостаточности. Тоны сердца глухие, отмечается наклонность к гипотензии. На ЭКГ регистрируют признаки ишемии и токсического поражения миокарда. При физикаль-ном и рентгенологическом исследовании легких определяется картина очаговой, сливной пневмонии, прогрессирующего застоя и начинающегося отека. Стул и мочеиспускание нередко задержаны.
Бактериологическое подтверждение столбняка не имеет практического значения. Дифференциально-диагностическими признаками столбняка является обязательная «классическая» триада: тризм, дисфагия и ригидность затылочных мышц. Течение столбняка отличается непрерывным нарастанием клинических симптомов («светлые» промежутки в спонтанном течении заболевания отсутствуют). При столбняке в судороги не вовлекаются мелкие мышцы кистей рук и стоп ног по типу «руки акушера» и «обезьяньей кисти».
Лечение столбняка в настоящее время целиком основывается на принципах интенсивной терапии. Заболевших следует срочно госпитализировать в соответствующее отделение, располагающее опытом оказания по-
502
мощи при этом заболевании. Госпитализация заболевших в инфекционные отделения нецелесообразна. Из отдаленных больниц сельской местности заболевших можно без особого риска эвакуировать в отделение реанимации с помощью специализированных автомобилей санитарного транспорта, а также санитарной авиацией в сопровождении опытного врача-реаниматолога. Предварительно вводят противосудорожные препараты в такой дозировке и сочетании, которые полностью устраняют угрозу судорог при сохраненном спонтанном дыхании. В случаях очень тяжелого столбняка с опасными судорогами, не купируемыми никакими противосу-дорожными средствами, кроме миорелаксантов, производят интубацию трахеи и проводят эвакуацию в условиях ИВЛ. Для устранения судорог на всех этапах лечения рекомендуют гексенал и барбитураты (тиобарбитура-ты) плюс седуксен (реланиум и диазепам); гексенал или барбитураты плюс нейроплегическая смесь; гексенал или барбитураты и хлоралгидрат в клизме (спустя 20—30 мин).
При развивающейся гиперпирексии показаны введение литической смеси и применение физических методов охлаждения (влажные обтирания, пузыри со льдом). Нормализация температуры тела уменьшает силу и частоту судорог. В качестве важного элемента противосудорожной терапии выступает покой: больного размещают в отдельной тихой палате с неярким рассеянным светом, в удобной постели, обеспечивают постоянную готовность к немедленной ликвидации апноэтических кризов за счет круглосуточного врачебного поста, наличия «дежурного» шприца с миорелаксантом и набора для интубации, отсасывателя, аппарата ИВЛ, установленного в вене катетера.
Необходимость перевода больного на ИВЛ обычно возникает с 4—5-го дня (заболевание IV степени тяжести) до конца 2-й недели. Таким больным заблаговременно накладывают трахеостому под «защитой» эндотрахеальной общей анестезии. При проведении ИВЛ необходимы систематический контроль за газовым составом крови и тщательная санация трахеобронхиаль-ного дерева. Содержание эритроцитов, пониженное вследствие гемолиза, восстанавливают путем переливания эритроцитной массы, потери воды, белков и электролитов — инфузией плазмы, альбумина, солевых энергетических растворов. Наклонность к задержке в организме жидкости устраняют путем назначения мочегонных препаратов. Очищения кишечника добиваются с помощью клизм, слабительных.
Антитоксин (противостолбнячную сыворотку, ПСС) следует ввести в первые часы лечения— 100—150 тыс. ME в разведении не менее 1:10 на изотоническом солевом растворе; при этом '/2 дозы можно ввести внутривенно капельно, а половину одномоментно в мышцу.
Учитывая механизмы движения столбнячного эндотоксина, используют и эндолимфатический способ введения ПСС, который позволяет внедрить антитоксические антитела сразу в лимфатическое русло, более быстро и эффективно связать находящийся там столбнячный эндотоксин.
Хирургическую обработку раны, где потенциально возможны продолжающие вегетации возбудителя, необходимо рассматривать как способ профилактической защиты от поступления новых порций токсина. Эту операцию следует провести в неотложном порядке, обязательно удалить все инородные тела, для повторного промывания использовать перекись водорода и категорически отказаться от наложения ранних швов. В ходе дальнейшего лечения раны влажновысыхающие повязки необходимо менять каждые 12 ч.
Антибиотики назначают для предупреждения гнойно-воспалительных осложнений в ране, легких.
503
После выздоровления необходимо провести активную иммунизацию с помощью столбнячного анатоксина (трехкратно по 0,5 с интервалами 1, 5 и 9—12 мес), так как перенесенное заболевание не оставляет после себя иммунитета. Обращают внимание на своевременную разработку суставов (физиотерапевтические процедуры, ЛФК).
Столбняк остается опасной раневой инфекцией, которую легче предупредить, чем вылечить. Поголовная иммунизация поливалентной вакциной АКДС, в состав которой входит адсорбированный столбнячный анатоксин, проводится в нашей стране в соответствии с действующим календарем профилактических прививок, начиная с 5—7-месячного возраста до 18 лет, а в последующем на протяжении всей жизни во всех случаях повреждения тканей. У лиц, привитых таким образом, экстренная профилактика столбняка осуществляется введением одного столбнячного анатоксина (0,5 мл одномоментно подкожно). В остальных случаях вводят ПСС — 3 тыс. ME трехкратно: 1) внутрикожная проба; 2) 0,2 мл; 3) 3 тыс. ME и адсорбированный столбнячный анатоксин (1 мл). В соответствии с действующей инструкцией экстренной профилактике столбняка подлежат лица, обращающиеся за медицинской помощью по поводу повреждений кожи и слизистых оболочек, укусов животными, ожогов и отморожений (11—IV степень) и операциях удаления старых инородных тел.
17.9.2. Туберкулез ран
Туберкулез ран встречается очень редко. Однако в связи с подъемом общей заболеваемости туберкулезом в последние годы необходимо помнить о возможности инфицирования ран микобактериями.
Различают экзогенный и эндогенный пути попадания туберкулезной ми-кобактерии в рану. Для внедрения патогенной микрофлоры необходимы предрасполагающие моменты: наличие пораженного соседнего органа, например переход костной формы туберкулеза на окружающие ткани. Мико-бактерия туберкулеза может попасть в рану путем метастазирования из первичного очага.
Туберкулез раны подтверждается при помощи бактериоскопического, бактериологического и биологического методов.
Клиническая картина раневого процесса характеризуется длительным, затяжным и рецидивирующим течением. Рана тусклая, с вялыми грануляциями. Отделяемое из раны незначительное, слизисто-гнойного характера. После заживления раны в области рубца могут образовываться изъязвления. Последние носят прогрессирующий характер и снова образуется рана, а через некоторое время открывается свищ или возникают кожные формы туберкулеза (язвенная, волчаночная, фунгозная, бородавчатая) {рис. 17.22).
Лечение общее, включает специфические противотуберкулезные препараты, климатотерапию, физиотерапевтические процедуры, применение средств, повышающих специфическую реактивность организма. Лечение проводится длительно, повторно.
Местное лечение раны должно быть щадящим, проводиться с тщательным соблюдением правил асептики для предупреждения развития вторичной инфекции. Присоединение последней резко осложняет течение основного заболевания и часто полностью его маскирует, что может привести к ошибочной тактике при выборе метода лечения. Прогноз заболевания при своевременном установлении диагноза и комплексном лечении благоприятный.
504

17.9.3. Сибирская язва
Сибирская язва — инфекционная болезнь из группы зоонозов, характеризующаяся тяжелой интоксикацией, поражением кожи и лимфатического аппарата.
Возбудитель заболевания Bacillus anthracis — крупные, грамположитель-ные, имеющие капсулу факультативно-анаэробные палочки.
Человек заражается обычно через кожу, однако известны случаи при употреблении в пищу зараженного мяса. Вдыхание спор при неблагоприятных условиях приводит к легочной форме, часто со смертельным исходом. Трансмиссивный путь передачи возбудителя возможен при укусах насекомых — слепней, мух, жигалок.
505

Рис. 17.23. Сибиреязвенный карбункул на лице (а); предплечье (б); бедре (в); спине (г).
Входными воротами возбудителя сибирской язвы в большинстве случаев являются поврежденная кожа, значительно реже слизистые оболочки дыхательных путей и желудочно-кишечного тракта. В основе патогенеза лежит действие экзотоксина возбудителя, отдельные фракции которого вызывают коагуляцию белков.
На месте внедрения возбудителя в кожу развивается сибиреязвенный карбункул — очаг геморрагическо-некротического воспаления глубоких слоев дермы на границе с подкожной клетчаткой, сопровождающийся отеком и деструкцией ткани в центре очага — некроз кожи с образованием буро-черной корки (рис. 17.23).
Для сибиреязвенного карбункула характерно появление небольшого красного узелка, в котором через 12—48 ч образуется сильно зудящий сине-багровый пузырек (первичная пустула) с красноватым мутным содержимым, отсутствие болезненности и гнойных выделений. После прорыва пустулы рана сибиреязвенного карбункула покрывается плотным темно-красным струпом, который через сутки становится почти черным и очень твердым. Отсюда и название болезни — «углевик» (anthrax). Вокруг струпа образуется венчик из нескольких мелких пузырьков с серозным или серозно-кровянистым содержимым, затем развиваются сильный отек, некроз тканей, лимфангит и лимфаденит. Обычно общее состояние больного нарушается мало, но в тяжелых случаях развивается клиника сепсиса. Безболезненность, валик с пузырьками, отсутствие нагноения до периода отделения струпа позволяют отличить сибиреязвенный карбункул от обычного.
506
Возбудитель из места внедрения заносится подвижными макрофагами в ближайшие регионарные лимфатические узлы, в которых обычно развиваются явления воспаления без серьезных нарушений барьерной функции, в силу чего генерализация процесса не наступает или наступает в относительно поздние сроки от начала развития воспалительного процесса.
При проникновении возбудителя в лимфатические узлы в них развивается лимфаденит с воспалительной инфильтрацией окружающей клетчатки. Лимфатические узлы увеличены, полнокровны, синюшно-красного цвета, с очагами кровоизлияний. Сформировавшийся карбункул и лимфаденит — основные элементы первичного сибиреязвенного комплекса.
Клиническая картина. В течении кожной формы различают карбункулезную, эдематозную, буллезную и рожистоподобную разновидности; преобладающей является карбункулезная.
Состояние больного по мере развития карбункула ухудшается: повышается температура тела, появляются головная боль, слабость, недомогание. Сибиреязвенный карбункул может локализоваться на любых, но чаще открытых частях тела. Поражаются слизистые оболочки рта, глотки, конъюнктивы глаз. Обычно возникают одиночные карбункулы, но нередко 2—3 и больше.
Струп отторгается с образованием или без образования гранулирующей язвы, размеры и глубина которой зависят от величины зоны некроза карбункула. Длительность периода рубцевания, а также выраженность и характер Рубцовых изменений определяются глубиной и местом поражения подлежащих тканей.
Эдематозная разновидность сибирской язвы характеризуется тяжелым течением с выраженным отеком, развивающимся до появления видимого некроза кожи. В месте внедрения возбудителя, обычно в области щек и век, появляется зуд и одновременно развивается отек, распространяющийся последовательно на всю область головы, шеи, грудную клетку, верхние конечности, живот, нередко до паховых складок.
Несколько позже в зоне внедрения возбудителя развивается некроз кожи и подлежащих тканей, и с этого момента эдематозная разновидность уже ничем не отличается от карбункулезной.
Для буллезной разновидности характерно развитие в месте внедрения возбудителя не пузырька, а пузыря, под которым идет процесс некроза тканей. Спустя некоторое время стенки пузыря опадают, некротизиру-ются.
При рожистой разновидности сибирской язвы на коже лица и рук возникает большое количество беловатых тонкостенных пузырей различной величины, расположенных на гиперемированной припухшей, но безболезненной коже. Через несколько дней пузыри вскрываются и на их месте остаются язвочки с темным дном и обильным серозным отделяемым. Глубоких некрозов обычно не наблюдается, формирование струпов идет относительно быстро, и по их отпадении Рубцовых изменений обычно не бывает.
Лабораторная диагностика основывается на бактериологическом исследовании содержимого везикул, отделяемого карбункулов и язв, мокроты, фекалий, мочи, при сепсисе — крови из вены.
При лечении наиболее эффективна вакцина на основе фильтрата культуры; для лечения и экстренной профилактики применяют также противоси-биреязвенный глобулин (30—75 мл после предварительной проверки индивидуальной чувствительности к нему с помощью внутрикожной пробы).
507
Применяют также антибиотики, которые предотвращают системное распространение и способствуют постепенному разрешению гнойников.
Если лечение начато своевременно, прогноз благоприятный; при генерализации процесса — сомнительный. Лица, перенесшие сибирскую язву, приобретают довольно стойкий, но не абсолютный иммунитет.
17.9.4. Сифилис
Сифилис — хроническое прогрессирующее инфекционное заболевание, вызываемое бледной трепонемой, поражающее все органы и ткани человека.
При сифилисе ран инфицирование происходит при попадании бледной трепонемы непосредственно в рану, чаще всего на кистях рук при непосредственном контакте с очагами инфекции.
Клиническая картина характеризуется резкой реакцией организма на инфекцию, отмечаются подъемы температуры до фебрильных цифр, выражены явления лимфаденита и лимфангоита. Указанные симптомы быстро купируются на фоне приема антибактериальных препаратов. Диагностика, как правило, носит случайный характер, основываясь на данных серологических методов (реакция Вассермана и др.).
В настоящее время поражение ран сифилисом встречается крайне редко. В основном описываются поражения суставов и костей во всех стадиях приобретенного и врожденного сифилиса. С хирургической точки зрения наибольший интерес представляет гуммозный период, когда формируются язвы и свищи, которые могут быть связаны с банальной инфекцией.
Для вторичного сифилиса характерно развитие специфических периоститов в виде болезненных припухлостей мягкой консистенции, локализующихся на костях черепа, передней поверхности голени, грудине, бедрах. После специфического лечения отмечается рассасывание периоститов. Наиболее тяжелые изменения костей наблюдаются в третичном периоде, когда в процесс вовлекаются кость и костный мозг (остит и остеомиелит). Обычно поражаются диафизы костей (предплечья и голени), что отличает сифилис от туберкулеза, развивающегося преимущественно в эпифизах, и от неспецифического гнойного остеомиелита, чаще наблюдаемого в метафизах.
При типичных симптомах диагностика не представляет трудностей.
Специфическое лечение сифилиса должно быть начато как можно раньше и проводиться в специализированных учреждениях. Однако если больной вынужден находиться в хирургическом стационаре, необходимо изолировать его и начать специфическую терапию (подробно описана в специальной литературе).
Заболевание протекает благоприятно только в случае раннего распознавания и своевременно начатого лечения в условиях специализированных учреждений.
17.9.5. Актиномикоз кожи
Актиномикоз — хроническое инфекционное заболевание, вызываемое лучистыми грибами рода актиномицет.
С хирургической точки зрения интерес представляет первичный актиномикоз кожи, когда он развивается в результате проникновения актиноми-цетов извне при травмах, ранениях.
508

Рис. 17.24. Актиномикоз кожи: голени (а); челюстно-лицевой области (б).
Клиническая картина. Различают узловую, бугорковую, бугорково-пусту-лезную, язвенную и атероматозную клинические формы актиномикоза кожи.
При узловой форме определяется плотный или плотноэластичный малоподвижный безболезненный инфильтрат в глубоких слоях кожи размером 3 х 4 см и более. Увеличиваясь, инфильтрат выступает над уровнем окружающей кожи, которая приобретает темно-красный цвет с фиолетовым оттенком {рис. 17.24).
Рядом с основным очагом нередко развиваются новые. При гуммозной форме узлы абсцедируют и вскрываются с образованием нескольких свищей. В гнойном отделяемом часто можно обнаружить желтоватые зерна — друзы актиномицета. Часть свищей рубцуется, но вскоре возникают новые.
Бугорковая форма обычно развивается при первичном актиномикозе кожи в виде мелких (0,5 х 0,5 см), не сливающихся плотных, безболезненных, полушаровидных, темно-красных бугорков. Большая часть их абсце-дирует, вскрываясь с выделением капли гноя. Позже образуются свищи, периодически покрывающиеся корками буро-желтого цвета. Процесс имеет тенденцию поражать подкожную жировую клетчатку и распространяться на соседние области.
Язвенная форма обычно возникает у ослабленных больных на месте абс-цедировавших инфильтратов. Края язв мягкие, подрытые, неровные, кожа вокруг них синеватого цвета. Дно язв покрыто некротизированными тканями, вялыми грануляциями. Язвы чаще возникают в местах, где имеется рыхлая подкожная клетчатка (над- и подключичные области, подмышечные впадины).
Атероматозная форма чаще возникает у детей. Инфильтрат округлой формы, до 5 см в диаметре, эластической консистенции, с четкими границами, напоминает истинную атерому; в последующем инфильтрат абсцеди-рует с выделением гноя и образованием свища.
509
Диагностика актиномикоза требует подтверждения микробиологическим исследованием отделяемого из свищей, кожно-аллергической реакцией с актинолизатом и гистологическим исследованием тканей инфильтрата.
Лечение больных актиномикозом проводится в специализированных стационарах. Хирургическое лечение заключается в иссечении пораженных тканей и проводится в комплексе с иммунотерапией. Проводится также общеукрепляющее и иммуностимулирующее лечение.
При местных формах заболевания и адекватном комплексном лечении прогноз благоприятный.
Для хирургов интересна особая разновидность актиномикоза — мадур-ская стопа — хроническое заболевание неконтагиозной грибковой этиологии, которое характеризуется поражением мягких тканей, костей нижней конечности и других частей человеческого тела. Впервые в 1842 г. Камп-фер-Джилл охарактеризовал эту болезнь как отдельную нозологическую форму.
На конечности отмечаются гиперкератоз, гиперпигментация, шелушение и кровоизлияния.
В большинстве случаев в связи с лимфостазом развивается «слоновая стопа».
Лечение консервативное и оперативное. В запущенных случаях производится ампутация конечности.
17.9.6. Дифтерия ран
Дифтерия ран — острое инфекционное заболевание, часто сопровождающееся скудной локальной картиной и тяжелой общей интоксикацией организма с поражением сердца, почек, нервной системы.
Данное заболевание благодаря проведению широких профилактических мероприятий в последние годы стало большой редкостью. Однако возникновение его возможно, особенно в детском возрасте, в случае обсеменения ранее существовавших ран или язв. При попадании палочки дифтерии на рану отмечается образование фиброзных пленок серого, серо-желтого цвета, плотно спаянных с подлежащими тканями. При попытке снять пленку образуется кровоточащая ранка с некротическими тканями. Окружающие ткани инфильтрированы, края раны красного цвета, а регионарные лимфатические узлы увеличены. Более тяжелые проявления заболевания наблюдаются при присоединении гноеродной инфекции или возникновении осложнений со стороны сердечно-сосудистой системы.
Клинически распознать дифтерию ран трудно, поэтому в сомнительных случаях необходимо проводить микроскопическое исследование патологического материала в препаратах, окрашенных по Граму, Нейссеру, Леф-флеру.
Лечение следует начинать как можно раньше, сразу же после установления диагноза. Оно заключается в подкожном или внутримышечном введении противодифтерийной сыворотки в дозе 2000—4000 АЕ с предварительной десенсибилизацией путем подкожного введения сначала 0,1 мл, через 30 мин 0,2 мл и через 1—2 ч остальной дозы. Необходима также полная изоляция больного. Местно рану лечат с применением антисептиков и повязок, пропитанных специфической сывороткой. На весь период лечения необходима также полная изоляция больного.
При своевременной диагностике и адекватной терапии прогноз благоприятный, при развитии полиорганной недостаточности — сомнительный.
510
 Г
л а в а 18. ОСНОВЫ
ХИРУРГИИ ПОВРЕЖДЕНИЙ
Г
л а в а 18. ОСНОВЫ
ХИРУРГИИ ПОВРЕЖДЕНИЙ
18.1. Общие вопросы хирургии повреждений
Травматизм — социальное явление, в результате которого отдельные группы населения, находящиеся в одинаковых условиях труда и быта, получают травмы.
Классификация травматизма
А Травматизм производственный: промышленный, сельскохозяйственный.
А Травматизм непроизводственный: бытовой, уличный (транспортный и нетранспортный).
А Травматизм умышленный — убийство, самоубийство и членовредительство.
А Травматизм военный: травмы в военное и мирное время, возникающие в воинских частях.
А Травматизм среди детей выделен в особую группу вследствие специфических особенностей детского организма.
Травма, или повреждение, — внезапное воздействие механических факторов внешней среды на ткани и органы, приводящие к анатомо-функциональ-ным изменениям, сопровождаемым местной и общей реакцией организма.
Травмы классифицируют по причине, характеру повреждений, локализации.
Травму характеризуют и с нозологических позиций: изолированные — одно повреждение внутреннего органа, сегмента опорно-двигательного аппарата или других структур организма; множественные — несколько повреждений в пределах одной анатомической области, сочетанные — повреждения в нескольких анатомических областях тела; комбинированные — несколько различных по этиологии повреждений (механические, термические, химические и радиационные).
18.1.1. Осложнения и опасности травм
Травма характеризуется типом клинического течения: не осложненное, осложненное с выздоровлением, осложненное с летальным исходом и неблагоприятное течение с быстро развивающимся летальным исходом.
Все осложнения тяжелой травмы разделяют на 3 группы: неинфекционные, воспалительные и гнойно-септические (табл. 18.1).
К наиболее значимым угрожающим жизни последствиям тяжелой травмы относятся гипертензионно-дислокационныи синдром головного мозга, острая массивная кровопотеря (геморрагический шок), нарушения регуляции жизненно важных функций: дыхания, кровообращения, компрессионно-дислокационный синдром спинного мозга.
18.1.2. Общие принципы диагностики травматических повреждений
Обследование пострадавшего должно быть быстрым, продуманным и проводиться в определенной последовательности:
• выяснение механизма и времени травмы, без конкретных деталей, у тяжело пострадавших;
511
определение состояния жизненно важных функций организма, а также угрожающих жизни последствий травмы;
оценка местных повреждений с учетом того, насколько они влияют на функцию основных систем организма.
Таблица 18.1. Частота и характер осложнений тяжелой травмы
|
Характер воспалительного процесса |
Клинические проявления |
Частота возникновения, % |
|
Неинфекционные |
Инфаркт миокарда |
1,4 |
|
|
Тромбоэмболия легочной артерии |
1,1 |
|
|
Жировая эмболия сосудов головного мозга |
2,1 |
|
|
Тампонада сердца |
0,8 |
|
|
Неправильно сросшиеся переломы и ложные суставы |
0,8 |
|
|
Вторичное внутричерепное кровотечение |
0,5 |
|
|
Травматический делирий |
0,8 |
|
|
Посттравматическая гидроцефалия |
1,4 |
|
|
Вторичное кровотечение в плевральную полость |
1,0 |
|
|
Аррозионное внутрибрюшное кровотечение |
1,1 |
|
t |
Посттравматический ишионеврит |
0,5 |
|
|
Аррозионное внутритазовое кровотечение |
0,5 |
|
|
Вторичное смещение отломков |
1,6 |
|
Воспалительные |
Пневмония |
17,5 |
|
|
Менингит, менингоэнцефалит |
6,4 |
|
|
Тромбофлебит конечностей |
8,6 |
|
|
Пролежни |
3,0 |
|
|
Свернувшийся гематоракс |
1,3 |
|
|
Спаечная кишечная непроходимость |
1,1 |
|
|
Тромбоз мезентериальных сосудов |
0,3 |
|
|
Посттравматический гепатит |
0,7 |
|
|
Свищи поджелудочной железы |
0,4 |
|
|
Гемобилия |
0,1 |
|
|
Желчные свищи печени |
0,2 |
|
|
Прорезывание мягких тканей спицами |
1,8 |
|
Гнойно-септические |
Эмпиема плевры, гнойный медиастинит |
3,2 |
|
|
Сепсис |
3,2 |
|
|
Пиопневмоторакс |
3,9 |
|
|
Нагноение послеоперационных ран |
8,6 |
|
|
Внутритазовая флегмона |
4,3 |
|
|
Нагноение мягких тканей вокруг спиц |
5,3 |
|
|
Прогрессирующий перитонит |
2,1 |
|
|
Флегмона грудной стенки |
0,75 |
|
|
Несостоятельность швов анастомозов |
0,75 |
|
|
Абсцессы брюшной полости |
0,75 |
|
|
Нагноение раны с эвентрацией внутренних органов |
1,4 |
|
|
Тонкокишечные свищи |
0,7 |
|
|
Флеботромбоз, гангрена конечности |
1,4 |
|
|
Гнойно-некротический панкреатит |
0,9 |
|
|
Остеомиелит таза |
1,9 |
|
|
Некроз мягких тканей конечности |
2,9 |
|
|
Остеомиелит длинных трубчатых костей |
1,9 |
|
|
Спицевый остеомиелит |
1,2 |
512
Объем и методику исследования подбирают индивидуально. Применяемые методы должны быть щадящими (без грубых приемов физикального исследования, перекладывания пострадавшего, по возможности без изменения положения тела), быстрыми и максимально эффективными.
Повреждения черепа и головного мозга. Диагностический поиск складывается из определения частоты и фазности нарушения сознания; выявления с помощью краниографии характера и локализации переломов костей черепа; установления характера и локализации внутричерепных гематом, гидром, очагов ушиба-размозжения мозга по данным эхоэнцефалографии (эхоЭГ), УЗИ, КТ, каротидной ангиография, а в которых случаях — с помощью наложения диагностических отверстий. Первоочередной задачей является выявление гипертензионно-дислокационного синдрома головного мозга.
Следует тщательно осмотреть и пальпировать череп, выявить вдавления, кровоподтеки, эмфизему, особенно в окологлазничной клетчатке (перелом основания черепа). Осматривают слуховые проходы и нос (кровотечение, истечение спинномозговой жидкости), конъюнктиву глаз (кровоизлияния), затем полость рта; пальпируют нос, скуловые дуги, челюстные кости, проверяют прикус. Западения и деформации, асимметрия лица из-за отечности мягких тканей и смещений костей, онемение в зоне разветвления подглазничного нерва, ограничение движений челюстей, их деформация, патологическая подвижность, нарушение прикуса могут служить достоверными клиническими признаками повреждений лицевых костей.
В отдельных случаях переломы верхней челюсти могут сопровождаться вскрытием верхнечелюстной пазухи, экзофтальмом, носовым кровотечением, обильной саливацией, затруднением жевания, глотания, дыхания и нарушением речи.
Необходимо исследовать черепные нервы. Сужение или расширение зрачков, разная их величина (анизокория), нарушение зрачковых и рого-вичных рефлексов, парезы лицевого и других нервов могут свидетельствовать о внутричерепных повреждениях. Функцию языкоглоточного и блуждающего нервов у больных в бессознательном состоянии определяют с помощью пробы на глотание. Определенную информацию можно получить при перкуссии черепа одним пальцем. Она позволяет определить локальную болезненность, при нарушенном сознании выявляемую по мимическим реакциям, стонам больного, и область избирательного притупления перкуторного звука.
С помощью обзорной рентгенографии черепа (краниография) устанавливают перелом костей; пневмоцефалию — перелом основной пазухи, решетчатого лабиринта, лобной пазухи, клеток пирамид височной кости).
ЭхоЭГ позволяет установить типичные смещения вследствие интракра-ниальных гематом, гидром, ушибов мозга с размозжением и без размозже-ния.
Изучение биоэлектрической активности головного мозга (электроэнце-фалография-ЭЭГ) представляет определенный интерес при травме черепа и головного мозга.
Реоэнцефалография (РЭГ) как безопасный и общедоступный метод изучения мозговой гемодинамики особенно важен при сочетанной травме черепа и головного мозга. По РЭГ-картине можно косвенно судить об отношении гематомы к оболочкам и веществу мозга. Наибольшие изменения вызывают субдуральные гематомы, так как они, кроме механического сдав-ления и рефлекторного возбуждения, непосредственно раздражают сосуды изливающейся кровью.
513
При черепно-мозговой травме отмечается изменение зрительных вызванных потенциалов.
Сканирование головного мозга ультразвуком позволяет уточнить наличие отека головного мозга, очагов ушиба и размозжения, внутричерепных гематом.
Каротидная ангиография с высокой степенью достоверности позволяет выявлять интракраниальные гематомы, ушибы мозга, внутрижелудочковые кровоизлияния, острую гидроцефалию и др.
Компьютерная томография является наиболее информативной методикой, а при синдроме сдавления головного мозга и диффузно-аксональном повреждении его — единственно достоверной.
Люмбальная пункция и исследование ликвора при травме черепа и головного мозга проводится как с диагностической, так и лечебной целью.
Использование эндофиброскопии существенно расширяет возможности хирургической диагностики. Снижая травматичность вмешательства (надежность обеспечивается наложением лишь одного отверстия с каждой стороны), внутричерепная эндоскопия позволяет осуществить диагностику внутричерепных повреждений.
Повреждения шеи. Учитывают анамнез и механизм травмы; при закрытых повреждениях существует риск травматизации крупных сосудов и органов шеи (трахея, пищевод), переломы или вывихи шейных позвонков. Тяжелые последствия может иметь травма передних отделов шеи (механическое сдавление), если она сопровождается нарушением хрящей гортани или трахеи. При этом возникает обтурационная асфиксия — либо первично (в результате деформации дыхательных путей), либо вторично (сдавление кровоизлиянием и отеком). Возникают резкие боли, речь затруднена, нарушается акт глотания, отмечаются кашель, одышка. На передней поверхности шеи видны припухлость, кровоизлияние. При тщательной пальпации удается определить положение отломков подъязычной кости и степень их смещения. Кровоизлияния нередко распространяются на боковые отделы шеи (возможно сдавление ветвей шейного сплетения). При значительных ушибах в соответствующих зонах бывает гиперестезия или анестезия. Пострадавшие жалуются на острую боль, которую нельзя объяснить только ушибом мягких тканей. Обычно при этом голова наклонена в сторону повреждения, а лицо несколько повернуто в здоровую сторону.
Своеобразное положение головы с поворотом в сторону бывает и при вывихах или подвывихах шейных позвонков. При односторонних вывихах голова больного наклонена в сторону вывиха, а лицо обращено в противоположную сторону. При одностороннем подвывихе голова наклонена в здоровую сторону, лицо обращено в направлении подвывиха или прямо. При двустороннем вывихе (вывихнутый позвонок вместе с вышележащим отделом смещается кпереди) положение головы бывает симметричным, но она наклонена, а шея несколько вытянута кпереди.
Из открытых повреждений шеи в мирное время чаще всего встречаются резаные раны в результате суицида. Симптомами проникающего ранения гортаноглотки являются наружное и внутриглоточное кровотечение, дисфа-гия и затрудненное дыхание, кровавая рвота (вследствие затекания крови в пищевод). Повреждение симпатического нерва вызывает синдром Горнера (птоз, миоз, энофтальм, гиперемия половины лица) и хрипоту с поперхива-нием. При повреждениях гортани или трахеи, кроме асфиксии, отмечают кашель с выделением слизисто-кровянистых масс, пенистую кровь из раны, свист в ране при дыхании, подкожная эмфизема. Повреждения пищевода сопровождаются кровью в рвотных массах, затруднением или болью
514
при глотании; из раны в области шеи может выделяться слюна, а при еде или питье — пища или жидкость.
Повреждения позвоночника и спинного мозга. Первоочередными задачами диагностики являются определение компрессии спинного мозга, его корешков и магистральных сосудов, а также оценка стабильности поврежденного отдела позвоночника.
Как правило, критерием, указывающим на возможность повреждения позвоночника, был механизм травмы: падение с большой высоты на ноги, спину, ягодицы; удар головой о грунт; сдавление тела значительной тяжестью. К прямым признакам, указывающим на повреждение позвоночника, относятся локальные боли, припухлость (гематома в области остистых и поперечных отростков), патологическая деформация в области травмированных позвонков в виде локального кифоза и расширения межостистых промежутков; рефлекторная фиксация и ограничения движения в поврежденном отделе позвоночника; двигательные нарушения (парезы, параличи); угнетение всех видов чувствительности; угнетение сухожильных, периостальных и кожных рефлексов; расстройства функции органов таза.
Использование «традиционной» спондилографии в двух стандартных проекциях позволяет установить наличие факта перелома позвонков (деформация или дефект тела позвонка, неравномерность его поперечных размеров, боковые подвывихи и вывихи тел позвонков, перелом суставных поверхностей позвоночника).
Оценить характер нарушений стабильности поврежденного отдела позвоночника позволяет прицельная рентгенография, рентгенография с прямым увеличением изображения, рентгенография в косых (атипичных) проекциях.
Компьютерная томография (КТ) дополняет данные рентгенографии, уточняет состояние позвонков, выявляет костные фрагменты, внедрившиеся в позвоночный канал, определяет пролабировавшие в позвоночный канал диски, а также гематомы в позвоночном канале.
Магнитно-резонансная томография позволяет определить структуру спинного мозга (отек), дает возможность судить о стенках позвоночного канала, выявляет кровоизлияние в подпаутинное пространство и эпиду-ральную клетчатку, костные и хрящевые фрагменты, смещенные в позвоночный канал.
Определение компрессии спинного мозга (уровня сдавления или блока подпаутинных пространств) осуществляют люмбальной пункцией, ликвороди-намическими пробами, позитивной миелографией с водорастворимыми йодсо-держащими контрастами, КТ-миелографией.
Повреждения груди. Диагностический поиск грудного составляющего травмы складывается из клинических данных, лучевых методов, плевральных (перикардиальная) пункций, УЗИ, фибробронхоскопии, видеоторакоскопии.
Достоверными клиническими признаками травмы груди являются одышка в сочетании с синюшностью лица и акроцианозом; феномен парадоксального дыхания (на момент вдоха отмечается западение реберного «окна»); подкожная эмфизема (асимметрия мягких тканей груди); петехиальные высыпания на коже груди, лица, конъюнктиве глаз; расширение вен шеи; симптом «крепитации» костных фрагментов; гемопневмоторакс.
Рентгеносемиотика повреждений груди в острый период отражает переломы костного каркаса грудной клетки; повреждения легкого и плевры, в частности разрывы и размозжения паренхимы легкого в виде обширных,
515
неправильной формы, однородной структуры затемнений; субплеврально расположенные гематомы до 2 см в диаметре; разрывы межальвеолярных перегородок с образованием «сухих» тонкостенных полостей. Разрывы легкого определяются на снимках и благодаря наличию косвенных признаков: эмфиземы средостения и мягких тканей грудной клетки, пневмоторакса. Следует отметить, что рентгенологическая картина реакции легких на тяжелую травму развивается в первые часы после травмы без выраженных ау-скультативных данных.
Применение УЗИ плевральной полости позволяет с максимальной точностью определять объем внутриплеврального кровотечения, диагностировать гемоторакс объемом даже до 100 мл, оценить изменение воздушности и плотности легочной ткани в зоне поражения.
Спиральная КТ (СКТ) в остром периоде травмы груди позволяет выявить переломы ребер, в том числе «симптом острого отломка», не всегда видимого на обычных рентгенограммах, обнаруживаются травматические инфильтраты при ушибах легких, травматические воздушные кисты и гематомы легкого и др.
Торакоцентез — высокоинформативный диагностике-лечебный метод, позволяющий судить о наличии гемопневмоторакса и эвакуировать кровь и воздух из плевральной полости, что приводит к расправлению легочной ткани, нормализации дыхания и гемодинамики, а в некоторых случаях — и остановке кровотечения.
Видеоторакоскопия позволяет оценить морфологические изменения грудной стенки и органов груди, возникающие в результате травмы определить их размеры и локализацию.
Фибробронхоскопия всегда носит лечебно-диагностический характер. Она позволяет в каждом случае установить причину острой дыхательной недостаточности: пневмония, шоковое легкое, ателектаз, бронхолегочная аспирация.
Повреждения сердца. Очень важно диагностировать закрытую травму сердца, ушиб, разрыв перикарда и миокарда, кровоизлияние в сердечную сумку, сотрясение сердца, травматический инфаркт миокарда.
Достоверными клиническими симптомами при травме сердца являются боль в области сердца, глухость тонов сердца, систолический шум на верхушке, шум трения перикарда, тахикардия, ритм галопа, снижение АД систолического, снижение АД пульсового. Клинические признаки тампонады сердца определяются в виде синевато-багрового цвета лица, петехиальных высыпаний на коже груди, лица, конъюнктиве глаз; набухание вен шеи, увеличение границ относительной сердечной тупости в поперечнике, ослабление сердечных тонов.
Данные ЭКГ улучшают достоверность диагностики закрытой травмы сердца: при регистрации серийных ЭКГ выявляется тахикардия в сочетании с различными расстройствами ритма сердца, смещение сегмента ST выше или ниже изолинии, появление двухфазного, иногда отрицательного зубца Т, нарушение внутрисердечной и внутрижелудочковой проводимости.
По данным ЭхоКГ повреждение сердца характеризуется нарушением насосной и сократительной функции миокарда, дилатацией полостей сердца, локальными и диффузными нарушениями движения стенок его, повреждением клапанов и других внутрисердечных структур.
При УЗИ признаками повреждения сердца служат визуализация слоя крови вокруг миокарда, маятникообразный ток крови из желудочка в перикард, «спадающаяся» аневризма миокарда.
516

Рис. 18.1. Пункция перикарда.
а — места пункции: 1 — по Марфану; 2 — по Пирогову—Делору; 3 — по Ларрею; 4 — по Курш-ману; б — пункция перикарда (по Ларрею) под контролем электрокардиограммы: 1 — стерильный провод к электрокардиографу. Стрелкой показан момент соприкосновения иглы с миокардом.
На рентгенограммах грудной клетки при повреждении сердца выявляется картина расширения его границ, сглаженность контуров (сердце приобретает форму шара или треугольника с основанием книзу) и изменение картины их пульсации, а также — горизонтальный уровень жидкости как отражение пневмогемоперикарда.
Важную диагностическую информацию, прямо подтверждающую развитие гемоперикарда, дает срочная пункция полости перикарда. Наиболее распространены способы, представленные на рис. 18.1.
Повреждения живота. Достоверность клинических данных невысока, что связано с невозможностью в ряде случаев получить объективные данные о повреждении органов брюшной полости в связи с наличием картины «острого живота» (так называемый псевдоабдоминальный синдром). Он отмечается при утраченном сознании, забрюшинной гематоме, переломах нижних ребер, нижних грудных и I поясничных позвонков и костей таза. При повреждениях живота выделяют 3 группы преобладающих симптомов (синдромов): развивающегося перитонита (при повреждении полых органов), внутрибрюшной кровопотери (при повреждении паренхиматозных органов), расстройств со стороны мочевыводящих путей (задержка мочеотделения, болезненность при мочеиспускании, гематурия).
Обзорная рентгенография (при тяжелом состоянии пострадавшего в ла-теропозиции) преследует цель обнаружения свободного газа в брюшной полости и косвенных признаков наличия в ней жидкости.
К косвенным признакам наличия свободной жидкости в брюшной полости относят высокое положение и ограничение подвижности купола диафрагмы; реактивный выпот в плевральной полости; дисковидные ателектазы в нижних отделах легких; «потерю» нормальной толщины мышц и неровность линий пред брюшинного жира; увеличение расстояния между боковой стенкой брюшной полости и восходящей ободочной кишкой; прогрессирующее вздутие кишечных петель и «всплытие» их на поверхность; расширение межпетлевых промежутков (картина звездчатых тканей в центральных областях и лентовидных — в проекции боковых каналов). Кроме того, в области поврежденного полого органа обнаруживается вздутие какой-либо одной петли тонкой кишки (симптом «дежурной петли»), а скоп-
517
ление отдельных пузырьков газа встречается при разрывах забрюшинно расположенных органов (двенадцатиперстная, восходящая и нисходящая ободочная кишки).
У пострадавших с подозрением на повреждение почек проводят обзорную рентгенографию мочевыводящих путей, ретроградную цистографию и др.
При обзорной рентгенографии почек обнаруживают признаки околопочечной гематомы в виде разлитой гомогенной тени; нечеткость контуров поясничной мышцы; смещение раздутых газом петель тонкой кишки в противоположную сторону. При экскреторной урографии выявляют «затекание» контрастного вещества различной формы и величины за пределы почки, деформацию чашечек и лоханок, субкапсулярное скопление контрастного вещества, отсутствие функции (при сохранении с другой стороны). При ретроградной цистографии обнаруживают контрастное вещество в брюшной полости, что указывает на внутрибрюшинный разрыв мочевого пузыря, в околопузырной клетчатке — на внебрюшинный разрыв.
Высокоинформативным методом исследования при травме живота является ультразвуковое исследование. Сокращая время обследования пострадавших, обеспечивая возможность динамического наблюдения, метод позволяет обнаружить наличие свободной жидкости до 200 мл, а также по изменению размеров и конфигурации (неровность контуров и деформация) судить о характере повреждений паренхиматозных органов.
Число диагностических ошибок резко сократилось в результате внедрения в практику лапароцентеза, который является простым, быстрым и щадящим методом диагностики с высокой степенью достоверности обнаружения патологического содержимого в брюшной полости.
Неясная клиническая картина и нечеткие данные рентгенологического исследования и лапароцентеза являются показанием для выполнения лапароскопии. В частности, видеолапароскопия позволяет производить осмотр сразу всех органов брюшной полости, а по косвенным признакам — судить о состоянии органов, расположенных забрюшинно, а также диагностировать продолжающееся кровотечение.
Повреждения таза основываются в первую очередь на клинических данных. Достоверные признаки травмы таза: поза Волковича (вынужденное положение — бедра ротированы кнаружи с одновременным сгибанием в коленных суставах); кажущееся или относительное укорочение конечности; отсутствие ригидности мышц при сдавливании таза или при давлении на крылья подвздошных костей; асимметрия таза; повреждение тазовых органов (наличие пастозности над лобком, нарастающая гематома промежности, задержка мочи, выделение крови из уретры и прямой кишки, отсутствие самостоятельного мочеиспускания). При повреждении мочевого пузыря часто выявляется симптом «пустого» пузыря — положительный симптом Зельдовича.
Симптомокомплекс включает также боль при движениях нижних конечностей на стороне повреждения крестцово-подвздошного сустава; боль в паховой, ягодичной области, области большого вертела и седалищного бугра; боль, иррадиирующая по внутренней поверхности бедра, в подколенную, икроножную и пяточную области; судорожные подергивания в икроножных мышцах на стороне повреждения; симптом «жесткого ложа» (больные не переносят положения лежа на спине на щите); купирование болевого синдрома при введении анестетика в области крестцово-подвздошного сустава на период действия препарата; асимметрия таза (илиосакральный сдвиг).
518
Рентгенологическая диагностика повреждений тазового кольца достаточно сложна, особенно при множественных переломах костей. Для повышения качества диагностики повреждений тазового кольца используют принцип многопроекционного рентгенологического обследования таза.
КТ позволяет выявить патологию, невидимую на стандартных рентгенограммах в прямой проекции, и под утлом 45°. К таким повреждениям относятся разрывы крестцово-подвздошных сочленений, невправимые вывихи и подвывихи бедра, костные отломки в полости тазобедренного сустава и др.
Повреждения конечностей диагностируют на основании клинических данных, лучевых методов исследования и ангиографии магистральных сосудов.
Выяснение обстоятельств и механизма травмы дает представление о характере повреждения: при падении на выпрямленную руку с опорой на ладонь возникает перелом лучевой кости в типичном месте, перелом ладьевидной кости кисти, перилунарный вывих кисти; при травме с резким про-национным или супинационным движением стопы — переломы лодыжек.
При осмотре обращают внимание на состояние и окраску кожи (бледность, цианоз), наличие ран, кровоподтеков, пузырей, отека. Сравнение при осмотре со здоровой конечностью позволяет выявить не только анатомические, но и функциональные изменения. Диагностике повреждений конечностей помогает сравнительное измерение длины и окружности пострадавшей и неповрежденной конечностей и их отдельных сегментов. Определяют амплитуду движений в суставах и силу мышц.
Достоверными клиническими признаками травмы конечностей являются отек и гематома на уровне повреждения; деформация и появление патологической подвижности; «крепитация» и появление в ране костных отломков, укорочение или деформация конечности. При повреждении магистральных сосудов конечности и открытых переломах отмечается кровотечение, при закрытых переломах — пульсирующая гематома; часто возникают резкая боль и онемение конечности, потеря чувствительности, а затем и движений; практически всегда отсутствует или резко ослаблен пульс на периферии поврежденной конечности.
Рентгенография обязательно включает обзорный снимок поврежденного сегмента в двух проекциях с захватом смежных суставов и выделением при анализе обзорных рентгенограмм переломов группы «риска», требующих срочной оценки состояния магистрального кровотока.
Для этих целей используют прямую ангиографию путем пункции артерии проксимальнее места предполагаемого повреждения; в более сложных случаях используют артериографию по Сельдингеру.
Ключевой проблемой переломов головки таранной кости является их плохая идентификация при стандартном исследовании. Для этого требуется рентгенография в косой внутренней проекции. Значительно более информативна компьютерная томография, выявляющая такие переломы в 100 % случаев.
Сегодня ультразвуковое исследование является наиболее адекватным методом быстрой, общедоступной и качественной диагностики патологических изменений в коленном суставе. Новые ультразвуковые методики (тканевая гармоника, панорамное сканирование, трехмерная волюметрическая реконструкция и ультразвуковая ангиография) играют важную роль в диагностике повреждений коленного сустава.
Пункцию сустава выполняют как диагностический и лечебный прием с целью эвакуации патологического содержимого и введения лекарственных средств.
519
Артроскопия является «золотым стандартом» для диагностики повреждений коленного сустава, позволяющим выявлять повреждения менисков, костеобразных связок, остеохондральные переломы, разрывы синовиальной оболочки и ее складок, в том числе с возникновением гемартроза и(или) синовита, изолированные повреждения хряща суставных поверхностей, а также такие последствия травмы, как деформирующий артроз и хронический синовит.
18.1.3. Оценка функции центральной нервной системы
Вследствие черепно-мозговой травмы возникают структурно-функциональные изменения нервной системы, проявляющиеся различной неврологической симптоматикой.
Важное значение имеет оценка характера нарушения сознания и глубины комы. Фазы сознания оценивают в соответствии с этой классификацией:
I — ясное сознание; II — оглушение умеренное;
— оглушение глубокое;
— сопор;
V — кома умеренная; VI — кома глубокая; VII — кома запредельная.
Фазы нарушения сознания, как и другие неврологические и соматические признаки, исследуют ежедневно вплоть до наступления ясного сознания или смертельного исхода (табл. 18.2).
Таблица 18.2. Шкалы фаз нарушения сознания
|
Неврологический признак |
|
|
Фаза нарушения сознания | ||||
|
I |
11 |
III |
IV |
V |
VI |
VII | |
|
Открывание глаз на звук или боль |
+ |
+ |
+ |
+ |
— |
— |
— |
|
Выполнение инструкций |
+ |
+ |
+ |
— |
— |
— |
— |
|
Ответы на вопросы |
+ |
+ |
— |
— |
— |
— |
— |
|
Ориентированность |
+ |
— |
— |
— |
— |
— |
— |
|
Двусторонний мидриаз |
— |
— |
— |
— |
— |
— |
— |
|
Мышечная атония |
— |
— |
— |
— |
— |
— |
— |
Ясное сознание характеризуется адекватными реакциями пострадавшего на окружающее, всесторонней правильной ориентировкой и бодрствованием. При умеренном оглушении пострадавший открывает глаза на звук или боль, выполняет инструкции и отвечает на вопросы, но часто с задержкой; наступает частичная дезориентация. У пострадавшего, находящегося в состоянии глубокого оглушения, отмечаются резкое затруднение и ограничение ответов на вопросы и полная дезориентация в обстановке, месте, времени, лицах, но при этом сохраняются открывание глаз на звук или боль и выполнение элементарных инструкций.
Наличие только открывания глаз на звук или боль характерно для апа-лического синдрома и сопорозного состояния сознания, однако при сопорозном сознании можно наблюдать периодическое восстановление эпизодического кратковременного словесного контакта.
520
Появление мышечной атонии характерно для глубокой комы, причем в некоторых случаях у пострадавшего наблюдается преходящий двусторонний мидриаз с сохранением вялой реакции на свет.
При запредельной коме, помимо мышечной атонии, отмечается двусторонний фиксированный мидриаз с отсутствием реакции зрачков на свет.
18.1.4. Оценка функции дыхания
При диагностике синдрома дыхательных расстройств обнаруживают три стадии (степени тяжести) острой дыхательной недостаточности (ОДН).
/ (легкой) степени характеризуется тахипноэ до 27 дыханий в 1 мин, умеренной тахикардией (до 105 уд/мин) без изменения АД, нарастанием артериальной гипоксемии.
/У (средняя) степень ОДН проявляется цианозом, увеличением частоты дыханий до 35 в 1 мин, учащением ЧСС более ПО уд/мин, умеренной ги-потензией, нарастанием артериальной гипоксемии.
III (тяжелая) степень ОДН характеризуется выраженным цианозом, частым поверхностным дыханием (более 35 в 1 мин), снижением АД более чем на 20 мм рт.ст., выраженной тахикардией (более 120 уд/мин), тяжелой артериальной гипоксемией.
18.1.5. Оценка функции системы кровообращения
При диагностике синдрома нарушения кровообращения обычно выявляют три типа циркуляторных изменений.
Гиперциркуляторный тип характеризуется увеличением гемодинамиче-ских показателей с наличием компенсации со стороны сердечно-сосудистой системы, при минимальных изменениях ОЦК.
Гипоциркуляторный тип характеризуется снижением гемодинамиче-ских показателей, компенсаторным увеличением периферического сопротивления сосудов и ЧСС.
Циркуляторный тип характеризуется очень низкими гемодинамиче-скими показателями, дефицитом ОЦК с превалированием вазодилатации.
18.1.6. Шкалы, определяющие тяжесть травмы
Для оценки тяжести повреждений используют различные шкалы и индексы.
ISS (шкала повреждений Injyry Severity Score) наиболее распространена для оценки тяжести повреждений. В этой шкале все травмы в зависимости от тяжести разделены на 5 категорий и обозначены кодами: 1 — незначительные повреждения; 2 — повреждения средней тяжести; 3 — тяжелая травма, не угрожающая жизни пострадавшего; 4 — тяжелая травма, непосредственно угрожающая жизни пострадавшего, но с возможным выживанием; 5 — крайне тяжелые повреждения.
По критерию локализации травмы делят на повреждения головы, шеи, груди, живота, области таза и конечностей; отдельно выделяют травмы лица. Для прогнозирования исходов при множественных травмах используют прием суммации квадратов кодов, обозначающих травмы различных областей тела. Чем больше сумма квадратов кодов, тем короче жизнь пострадав-
521
Таблица 18.3. Характеристика пострадав- шего после травмы. Пострадавшие
ших по тяжести травмы (М±т) с суммой квадратов кодов менее
|
Традиционные градации |
ISS, баллы |
|
Легкая |
10,1 ± 1,1 |
|
Средняя |
17,6 ± 1,9 |
|
Тяжелая |
28,1 ± 1,7 |
|
Крайне тяжелая |
39,4 ± 2,6 |
20 имеют шансы на выживание. При сумме квадратов кодов 20 половина пострадавших погибают через неделю, при сумме квадратов кодов, равной 30—49, 50 % пострадавших погибают в пределах 1 ч после травмы, 10 % — через 6 ч и 20 % — через 1 нед. Процент летальности в группе пострадавших с суммой баллов до 50 может служить показателем для определения эффективности мероприятий первой помощи и лечения.
Сравнительная характеристика тяжести травмы по «традиционным» градациям и балльной оценке представлена в табл. 18.3.
В практической деятельности используют также Ганноверскую шкалу тяжести травм (PTS) (табл. 18.4).
Таблица 18.4. Оценка тяжести травмы по шкале Ганновер
|
Область повреждения |
Баллы |
Возраст, лет |
Баллы |
|
Черепно-мозговые травмы: |
|
|
|
|
ЧМТ I степени |
4 |
|
|
|
ЧМТ II степени |
8 |
|
|
|
ЧМТ III степени |
12 |
|
|
|
перелом лицевого черепа |
2 |
|
|
|
тяжелый перелом лицевого черепа |
4 |
|
|
|
Сумма баллов |
|
|
|
|
Повреждения груди: |
|
|
|
|
перелом грудины, ребер |
2 (1-3) |
|
|
|
множественный перелом ребер |
5 |
|
|
|
множественный двусторонний перелом ребер |
10 |
|
|
|
пневмоторакс, гемоторакс |
2 |
|
|
|
контузия легких |
7 |
|
|
|
двусторонняя контузия легких |
9 |
|
|
|
двусторонние переломы ребер + ушибы легких + |
13 |
|
|
|
«нестабильная грудь» |
|
|
|
|
разрыв аорты |
7 |
|
|
|
Сумма баллов |
|
|
|
|
Повреждения живота: |
|
|
|
|
разрыв селезенки |
9 |
|
|
|
разрыв селезенки + печени |
13 (18) |
|
|
|
обширный разрыв печени |
13 (18) |
|
|
|
разрыв кишки + брыжейки + поджелудочной же- |
13 (18) |
|
|
|
лезы |
|
|
|
|
Сумма баллов |
|
|
|
|
Повреждения таза: |
|
|
|
|
простой перелом |
3 |
|
|
|
множественный перелом |
9 |
|
|
|
травма таза + мочеполовых органов |
12 |
|
|
|
разрушение таза |
15 |
|
|
|
перелом позвоночника |
3 |
|
|
|
Сумма баллов |
|
|
|
522
Продолжение
|
Область повреждения |
Баллы |
Возраст, лет |
Баллы |
|
Повреждения конечностей: сложный перелом бедра простой перелом бедра оскольчатый перелом бедра перелом голени разрыв связок коленного сустава, перелом надколенника, предплечья, локтевого сустава перелом плеча, надплечья разрыв сосудов в зоне коленного сустава разрыв сосудов дистальнее локтевого, коленного суставов ампутация бедра, плеча ампутация предплечья, голени каждый открытый перелом II—III степени обширное размозжение мягких тканей Сумма баллов |
12 8 12 4 2 4 8 4 12 8 4 2 |
До 9 10-39 40-49 50-54 55-59 60-64 65-69 70-74 75 |
0 0 1 2 3 5 8 13 21 |
|
Сумма баллов |
Степень тяжести* |
Летальность, % | |
|
До 19 20-34 35-48 49 |
I II III IV |
До 10 До 25 До 50 75 и более | |
* I степень — легкие и среднетяжелые повреждения; II степень — тяжелые, но без угрозы для жизни на первом этапе; 111 степень — тяжелые с угрозой для жизни на всех этапах; IV степень — очень тяжелые с небольшим шансом на выживание.
18.1.7. Общие принципы организации догоспитальной и стационарной травматологической помощи
Правильно и своевременно оказанная первая помощь во многом определяет дальнейшее течение травмы.
Первую медицинскую помощь оказывают сами пострадавшие (самопомощь) или их товарищи (взаимопомощь), а также младшие медицинские работники. Первая медицинская помощь основывается на принципе «прежде всего не навреди», т. е. не причини пострадавшему дополнительных страданий.
К мероприятиям первой медицинской помощи относятся:
тушение горящей одежды;
временная остановка наружного кровотечения;
устранение механической асфиксии;
искусственная вентиляция легких;
окклюзионная повязка при открытом пневмотораксе;
введение обезболивающих средств;
закрытие раны или ожоговой поверхности повязкой;
транспортная иммобилизаци при переломах костей и(или) обширных повреждениях мягких тканей;
523
• устранение продолжающего воздействия травмирующих факторов (ос вобождение из-под завалов, вынос или вывоз из очагов массового по ражения.
Первая врачебная помощь заключается прежде всего в устранении непосредственной угрозы жизни пострадавшего, предупреждении тяжелых осложнений травмы. Мероприятия первой врачебной помощи разделяют на две группы: неотложные и те, которые можно при необходимости отсрочить.
К неотложным относятся мероприятия, невыполнение которых ведет к смерти пострадавшего или тяжелым осложнениям:
остановка наружного кровотечения;
устранение разного рода асфиксий: освобождение верхних дыхательных путей, введение воздуховода или прошивание западающего языка, трахеостомия, крико- или коникотомия;
наложение окклюзионной повязки при открытом пневмотораксе; пункция или дренирование плевральной полости при напряженном пневмотораксе;
вливание плазмозамещающих растворов;
введение обезболивающих средств и при необходимости — новокаи-новые блокады;
транспортная иммобилизация;
наружный массаж сердца и ИВЛ;
отсечение конечности, висящей на лоскуте («транспортная ампутация»);
катетеризация или пункция мочевого пузыря при задержке мочеиспускания.
К отсроченным относятся мероприятия, невыполнение которых не влечет за собой непосредственной угрозы жизни пострадавшего и развития тяжелых осложнений:
вливание плазмозамещающих растворов, обезболивание и новокаино-вые блокады при шоке легкой степени тяжести;
устранение недостатков транспортной иммобилизации и повязок у пострадавших без признаков шока;
профилактическое введение столбнячного анатоксина.
Первая задача врача, прибывшего на место происшествия, состоит в быстром выявлении и устранении расстройств, прямо угрожающих жизни. Затем уточняют характер, масштабы повреждений и связанные с ними функциональные расстройства.
В любых критических ситуациях абсолютно приоритетное значение принадлежит экстренному устранению острых дыхательных расстройств, устранению критических нарушений гемодинамики.
Обезболивание на догоспитальном этапе составляет при тяжелых и соче-танных травмах предназначено не только для ликвидации боли, но и устранения психоэмоционального стресса, нормализации неироэндокринных и других нарушений. Иммобилизация также представляет собой элемент обезболивания.
Квалифицированная хирургическая помощь заключается в хирургических операциях и манипуляциях, направленных на спасение жизни, предупреждение и борьбу с уже развившимися тяжелыми осложнениями.
• Первая (неотложная) группа мероприятий: борьба с асфиксией; опера ции по поводу кровотечений; комплексная терапия шока и острой крово-
524
потери, синдрома длительного раздавливания; лапаротомия (видеолапароскопия) при повреждении органов живота; некротомия при глубоких цир-куляторных ожогах груди, шеи, конечностей, вызывающих нарушение дыхания и кровообращения; торакотомия (видеоторакоскопия) при продолжающемся массивном кровотечении; ушивание открытого пневмоторакса; плевроцентез при напряженном пневмотораксе; операции по поводу анаэробной инфекции; трепанация черепа при нарастающем сдавлении головного мозга.
• Вторая (отсроченная) группа мероприятий: ампутация по первичным показаниям; наложение надлобкового свища при повреждении уретры или внебрюшинного отдела мочевого пузыря; сигмостомия при повреждении внебрюшинного отдела прямой кишки; первичная хирургическая обработка ран (в том числе ожоговых) со значительным разрушением мягких тканей или сильным загрязнением их землей.
Специализированную медицинскую помощь оказывают врачи — специалисты узкого профиля в учреждениях, оснащенных специальным оборудованием и инструментарием. Существуют нейрохирургическая, стоматологическая, офтальмологическая, оториноларингологическая и другие виды специализированной помощи.
Спасение пострадавших с нарушением жизненных функций оказывается возможным при условии тесной преемственности между догоспитальным и стационарным этапами лечебной помощи, целиком основанных на реанимационных принципах. Когда пострадавших с ранением сердца, крупных сосудов и предельно тяжелыми нарушениями жизнедеятельности доставляют в ближайшую больницу общего профиля, его шансы на спасение весьма невелики.
18.2. Раны
Учение о ране относится к числу наиболее древних разделов медицины и является одним из основных в теории и практике хирургии.
Раной называется нарушение покровных и подлежащих тканей, слизистых или внутренних органов, вызванное механическим воздействием.
Элементами каждой раны являются раневая полость, как зона раневого дефекта, а также ее стенки, которые подразделяются на зоны в зависимости от характера повреждения. Раневая полость — это пространство, ограниченное стенками и дном раны. Когда глубина раневой полости значительно превосходит ее поперечные размеры, то ее называют раневым каналом.
18.2.1. Классификация ран
Д По происхождению различают раны преднамеренные (операционные) и случайные.
А По механизму повреждения выделяют раны: колотые, резаные, рубленые, ушибленные и размозженные, рваные, укушенные, огнестрельные.
А По наличию микрофлоры в ране: асептические и бактериально загрязненные раны.
А По виду ранящего снаряда — ножевые, пулевые, осколочные, стреловидные раны.
А По характеру раневого канала: сквозные, слепые, касательные раны.
525
А По количеству ран различают одиночные повреждения и множественные раны.
А По протяженности раны могут быть изолированными и сочетанными.
А По наличию осложнений различают неосложненные и осложненные раны.
А По отношению к полостям организма раны могут быть непроникающими и проникающими.
А По количеству поражающих факторов выделяют простое и комбинированное ранение.
18.2.2. Патогенез и фазы раневого процесса
Раневой процесс — сложный комплекс биологических реакций в ответ на повреждение. Он включает общие реакции организма и местное действие травмы, выражающееся в непосредственном повреждении клеток, сосудов и нервов. В результате возникают нарушения микроциркуляции, высвобождаются химические медиаторы, изменяется обмен веществ раны.
Расстройства и восстановительные процессы со стороны микроциркуля-торного русла делят на изменения самих сосудов, внутри- и внесосудистые изменения.
А Изменения микрососудов: вазоконстрикция и вазодилатация; изменение характера биосинтеза биологически активных веществ (простациклин, циклические нуклеотиды); разрыв сосудов, расхождение их стенок и кровоизлияния; повреждение, а в дальнейшем восстановление эндотелиальных клеток; нарушение структуры базальных мембран; изменения, обусловленные активной миграцией лейкоцитов; изменение проницаемости для воды, ионов, макромолекул и форменных элементов; пролиферация сосудов и их обратное развитие.
А Внутрисосудистые изменения: изменение скорости кровотока и стаз крови; изменения реологических свойств крови; нарушение в системе свертывания крови и фибринолиза; изменение форменных элементов крови.
А Внесосудистые изменения: реакция околососудистых элементов (дегра-нуляция тучных клеток, отхождение адвентициальных клеток, повреждение нервных окончаний); периваскулярный отек; периваскулярная инфильтрация; изменение межклеточного вещества.
Явления, характерные для воспаления, обусловлены накоплением в поврежденных тканях специфических биологически активных веществ белковой природы — медиаторов раневого процесса (калликреин-кининовая система; биогенные амины; система комплемента; липиды и их производные; система свертывания крови и фибринолиза; полипептиды и ферменты клеток крови и поврежденных тканей).
Биологически активные полипептиды (лимфокины) принимают непосредственное участие в заживлении ран. Лимфокины — эффекторные молекулы, высвобождающиеся из сенсибилизированных лимфоцитов в ответ на воздействие антигена. Такой лимфокин, как фактор ингибирования лейкоцитов, ингибирует беспорядочную и упорядоченную миграцию лейкоцитов и индуцирует высвобождение лизосомальных ферментов.
Лизосомалъные ферменты катализируют внеклеточные реакции гидролиза биополимеров, что приводит к расплавлению клеток и бактерий и способствует очищению раны. Кроме того, образующиеся продукты расщепления тканей активируют восстановительные процессы.
526
«Взрыв» окислительного метаболизма, которым сопровождается фагоцитоз, проявляется, помимо всего прочего, частичной редукцией кислорода с образованием токсичных продуктов (супероксидные анионы, перекиси водорода Н202, гидроксильных радикалов (ОН) и синглетного кислорода (02'). Они токсичны для микроорганизмов (в том числе грибов и простейших), а повышение их содержания во внутриклеточных вакуолях играет важную роль в разрушении фагоцитированных бактерий.
Местный ацидоз (рН < 6,0) повышает проницаемость и снижает тонус микрососудов, усиливает миграцию лейкоцитов, увеличивает способность тканей пропитываться коллоидами, стимулирует деятельность фибробластов.
Повреждение тканей и развитие раневого воспаления сопровождается гибелью значительного числа клеток, в результате чего освобождается содержащийся в них калий. Повышение содержания калия в раневом экссудате, лимфе и крови приводит к нарушению нормального соотношения электролитов — натрия, калия и кальция. Изменение коэффициента кальций/калий изменяет тонус нервной системы и вызывает усиление гиперемии. В результате нарушения электролитного баланса и повышения проницаемости сосудов увеличивается осмотическое давление, что обусловливает задержку воды, набухание и отек поврежденных тканей.
Большая роль в процессе заживления ран принадлежит обмену белков. Распад белка преобладает в первые 3—8 сут после повреждения, а синтез, активируясь вскоре после ранения, достигает максимума в период клеточной пролиферации, коллагенообразования и эпителизации. Повышению проницаемости капилляров способствуют а- и (3-глобулины. Наиболее активным веществом, повышающим проницаемость сосудов, является р2-гло-булин. Альбумины тормозят биологическое действие указанных глобулино-вых фракций.
Синтез белка в ране связан в основном с образованием коллагена и эпи-телизацией, причем решающее значение имеет формирование подлежащей соединительной ткани, обеспечивающей полноценную регенерацию эпителия. Биосинтез коллагена осуществляется фибробластами одновременно с синтезом других белков. При этом в клетках увеличивается содержание рибонуклеиновой кислоты (РНК), амино- (NH2) и сульфгидрильных (SH) групп аминокислот, затем суммарного белка, муко- и гликопротеидов, резко повышается активность ферментов биологического окисления, гликолиза и пентозного цикла.
Имеется связь белкового метаболизма с обменом энергии в ране. Эмиграция лейкоцитов, их хемотаксис и фагоцитоз сопровождаются резким повышением активности ферментов энергетического обмена, а также тех реакций, которые являются пунктами переключения метаболизма в сторону энергообразования. Фагоцитоз макрофагами в зоне воспаления, а также развитие грануляционной ткани в развивающихся микрососудах и фиброб-ластах происходит за счет активации ферментативных реакций, за счет которых окисляется глюкоза.
Напряжение кислорода (Р02) в ране является важным фактором, влияющим на клеточные реакции, рост микрососудов, образование коллагена. В ранних фазах заживления ран Р02 бывает обычно очень низким (10— 15 мм рт.ст.), постепенно возрастая к концу 2-й недели в чистой ране до 20—25 мм рт.ст. Надежное дренирование раны ускоряет ее заживление. В начале раневого процесса кислородное голодание стимулирует пролиферацию клеток соединительной ткани и образование капилляров. В противоположность этому эпителизация — аэробный процесс, стимулируется повышением концентрации кислорода.
527
Раневым процессом называют весь комплекс сложных биологических явлений в ране, завершающих ее заживление. Он всегда цикличен и может быть разделен на фазы (периоды) в соответствии с развитием функциональных и морфологических изменений в ране и окружающих тканях.
Существует несколько классификаций раневого процесса, но единой нет.
Согласно классификации по М. И. Кузину (1977), выделяют следующие фазы раневого процесса:
фаза воспаления, делящаяся на период сосудистых изменений (сумма последовательных сосудистых реакций, характеризующих механизм воспаления) и период очищения раны от некротических (погибших) тканей;
фаза регенерации, образования и созревания грануляционной ткани;
фаза реорганизации рубца и эпителизации.
Каждая из указанных фаз (стадий) состоит из многочисленных биологических процессов, развивающихся в определенной последовательности, но объединенных наиболее существенным признаком, характеризующим сущность данного этапа заживления.
Л / фаза раневого процесса (воспаление) характеризуется реакцией на повреждения тканей. К его морфологическим проявлениям относятся расширение сосудистой сети в окружности раны, экссудация и отек краев раневого дефекта, лейкоцитарная инфильтрация.
Раневое воспаление отражает реактивные свойства организма и является барьером для микробов и токсинов на пути их проникновения в организм. Воспалительные реакции в очаге повреждения сложны и многообразны. Раневое воспаление может быть асептическим и инфекционным, острым и хроническим, поверхностным и глубоким, альтеративным, экссудативным и пролиферативным, серозным и фибринозным, геморрагическим и гнойным.
В фазе воспаления выделяют сосудистую и клеточную реакции.
Первоначально возникает сосудистая реакция — спазм микрососудов в области травмы, сменяемый их паралитическим расширением, повышением проницаемости сосудистой стенки и быстро нарастающим отеком тканей. Эти процессы тесно взаимосвязаны и опосредованы выделением медиаторов сосудистой проницаемости: протеаз — плазмина, калликреина, глобулинового фактора проницаемости; полипептидов — брадикинина, каллидина, лейкотаксина; аминов — гистамина, серотонина.
Повышение проницаемости сосудистой стенки сопровождается выходом в ткани не только жидкой части крови, но и форменных элементов. Спустя 4—6 ч после нанесения раны развивается клеточная реакция, заключающаяся в инфильтрации травмированных тканей лейкоцитами, преимущественно нейтрофильными. Позже (2—3-й сутки) к ним присоединяются лимфоциты, макрофаги.
Нейтрофилы при воспалительной реакции приклеиваются к эндотелию сосудов травмированных тканей, мигрируют через стенки сосудов в ткани; осуществляют хемотаксис и фагоцитоз, а также дегрануляцию и переваривание поглощенного материала.
При заживлении раны функции эозинофилов заключаются в транспортировке или модификации антигена с возможной доставкой к предшественнику антителообразующей клетки; гомеостатической роли, защите от вредного влияния комплекса антиген — антитело путем поглощения и разрушения его.
528
В первые 12 ч после травм в рану поступают моноциты. Попав в рану, моноцит становится макрофагом — фагоцитирующей клеткой, которая удаляет большую часть некротизированных клеток, тканей и микробной флоры раны, поглощая и переваривая их. В отличие от нейтрофила моноцит характеризуется значительно большей продолжительностью жизни и способностью синтезировать белки (в частности, используемые при фагоцитозе ферменты), сохраняя при этом очень высокую активность на последней стадии воспалительного процесса.
Лимфоциты и другие одноядерные клетки составляют большинство клеток раневого экссудата между 12 и 24 ч после ранения. Морфологически различают малые, промежуточные и большие лимфоциты. Основная функция малых лимфоцитов — медиация иммунных реакций. Они ответственны за возмещение и перенос генетической иммунологической информации, которая поддерживает или повышает рост многих других типов клеток, включая клетки печени и фибробласты. Малые лимфоциты не являются конечной формой, они могут дифференцироваться в другие клетки и последовательно давать новые генерации лимфоцитов; основным их источником является тимус. Они могут трансформироваться в плазматические клетки, которые в основном ответственны за образование антител.
Тучные клетки выделяют гистамин, серотонин и гепарин, увеличивающие капиллярную проницаемость. Хемотрипсин и трипсиноподобные ферменты, содержащиеся в тучных клетках, воздействуют на фибрин и коллаген в течение всего процесса заживления. Выделение гранулами тучных клеток хондроитинсульфата (в комплексе с протеинами) имеет важное значение для образования новой основной субстанции и коллагена. Они играют важную роль в развитии гипертрофических рубцов.
На 3—4-е сутки после ранения начинается II фаза раневого процесса (пролиферация), характеризующаяся развитием грануляционной ткани, постепенно заполняющей раневой дефект. Новообразованная ткань, заполняющая рану, представляет собой тканевой комплекс, состоящий из соединительнотканного, сосудистого и эпителиального компонентов. Главное значение в этот период приобретают эндотелий капилляров и фибробласты.
Фибробласты представляют собой полиморфные клетки с удлиненной формой и продолговатым ядром, другие — овальной или неправильной формы. Фибробласты относятся к клеткам, активно связанным с продукцией соединительнотканной матрицы.
Источником фибробластов являются малодифференцированные клетки, располагающиеся в основном по ходу капилляров и продвигающиеся с врастающими в грануляционную ткань сосудами.
Функции фибробластов в процессе заживления раны сложны и многообразны. Количество фибробластов в ране особенно сильно возрастает в первые 48—72 ч.
На заключительных этапах заживления раны количество фибробластов, вытесняемое коллагеновыми волокнами, постепенно уменьшается, претерпевая деградацию и превращение в фиброциты. В продуктивной фазе заживления фибробласты синтезируют липиды, белки и углеводы, мукополи-сахариды, протеиновые предшественники коллагена, гиалуроновую кислоту, хондроитинсульфаты, гликопротеины, эластин, а также играют роль в стабилизирующем механизме для молекул коллагена.
Существенную роль в процессе заживления раны играет основное вещество, заполняющее внеклеточное и внесосудистое пространства соединительной ткани.
529
Новообразование соединительной ткани начинается с синтеза основного вещества, затем следует синтез коллагена.
Почти одновременно с образованием основного вещества в фибробла-стическом синцитии появляются первые волокнистые структуры — аргиро-фильные преколлагеновые волокна.
Синтез коллагена при заживлении раны происходит только в фибробла-стах и отражает общие закономерности синтеза белков.
По мере того как фибробласты синтезируют коллаген и белковополиса-харидные комплексы соединительнотканного матрикса заживающей раны, начинается образование множества мелких кровеносных сосудов. Новообразованные тонкостенные сосуды с окружающими их клетками представляют собой как бы основу, на которой (и из которой) постоянно развивается грануляционная ткань.
Восстановление сосудистой сети в ране является основной частью процесса ее заживления. На ранних стадиях заживления раны эта сеть сосудов обеспечивает доставку сравнительно большого количества кислорода, необходимого для клеток, активно синтезирующих белок в ране. Новообразованные капилляры в числе прочих факторов способствуют повышению ферментативной активности грануляционной ткани.
Механизм развития кровеносных сосудов в значительной степени зависит от характера раны и ее заживления. Формирование сосудистой сети при заживлении раны первичным натяжением происходит следующим образом. В течение 1 —2 сут среди волокон фибрина, склеивающего рану, появляются тяжи из фибробластов и щели, которые в дальнейшем выстилаются эндотелием, пролиферирующим из перерезанных травмированных сосудов. В дальнейшем из сосудистых щелей при первичном натяжении формируются мелкие вены и артерии; собственно капилляров немного, они не соприкасаются с внешней средой, следовательно, не выделяют и не всасывают, т. е. не выполняют функций, характерных для истинной грануляционной ткани.
Основным способом формирования сосудистой сети при заживлении раны вторичным натяжением является почкование капилляров. Когда образование соединительной ткани в основном завершается, новообразованные капилляры претерпевают обратное развитие, большинство из них регрессирует и исчезает.
Таким образом, в ране происходит превращение ткани, богатой кровеносными сосудами и активно делящимися клетками, в ткань, называемую соединительнотканным рубцом.
По мере того как соединительная ткань восполняет раневой дефект, эпидермальные клетки начинают закрывать поверхность раны. Процесс эпителизации раны осуществляется в результате амебовидного движения клеток, пролиферации эпителия, появления митозов. Прочная эпителиза-ция раны осуществляется только при нарастании эпителия на грануляционную ткань; в других случаях эпителий погибает. В чистых резаных ранах рост и наползание эпителия начинаются через 24 ч, полная эпителизация наступает через 3—5 сут. В ранах, заживающих вторичным натяжением, через 3—5 сут этот процесс только начинается.
Вследствие увеличения массы коллагеновых волокон грануляционная ткань становится все более плотной: наступает последний III период раневого процесса — реорганизация.
Данная фаза представляет собой завершающий этап заживления раны, заключающийся в преобразовании молодой соединительной ткани не просто в обычную ткань, аналогичную утерянной, а в новую — рубцовую, ткань, заменяющую первоначальную. Рубцовая ткань является продуктом
530
репаративнои регенерации и образуется в тех случаях, когда организм не может возместить потерю за счет восстановления той ткани, которая первоначально была повреждена.
Процесс формирования рубца в значительной степени зависит от характера заживления раны. Так, если рана заживает первичным натяжением, образуется минимальное количество молодой соединительной ткани, трансформирующейся в рубец. Результатом заживления вторичным натяжением является рубец, структура и физические свойства которого зависят от размеров бывшей раны, продолжительности нагноения, длительности заживления.
С закрытием раны эпителиальным покровом формирование рубца не заканчивается — в нем происходят явления, связанные с перестройкой его структуры.
Формирование рубца при естественном течении процесса происходит в четыре стадии:
— эпителизация начинается с момента окончания гранулирования. Рубец в это время покрывается очень тонкой пленкой, состоящей из неокрепших молодых клеток плоского эпителия. Через 7—10 сут рубец начинает грубеть, слегка уплотняется, цвет его из розоватого становится более бледным. В таком состоянии рубец находится 2—2,5 нед;
— набухание: рубец краснеет, объем его увеличивается, он начинает возвышаться над уровнем окружающей кожи, становится болезненным при прикосновении. Через 3—4 нед болезненность уменьшается, но покраснение еще более усиливается, приобретая цианотичный оттенок;
— уплотнение: рубец начинает уплотняться на всем протяжении, местами покрываясь плотными бляшками; становится бугристым, напоминает келоид, цианотический оттенок сохраняется;
— размягчение: постепенно рубец становится более плоским, окраска его бледнеет, а болезненность уменьшается. Через 3—4 нед он делается мягким, безболезненным, подвижным, отличается от окружающей кожи некоторой пигментацией.
Иногда нормальное развитие рубца нарушается. Он приобретает свойства гипертрофического, увеличивается в объеме и выступает над уровнем окружающей кожи. Такие рубцы нередко вызывают значительные обезображивания и различные функциональные расстройства.
Своеобразной разновидностью рубца является келоид, представляющий собой рубцеобразную изолированную опухоль, обладающую способностью распространяться в окружающие ткани и давать ответвления. Микроскопически келоиды состоят из большого количества фиброзной ткани, которая быстро подвергается гиалиновому перерождению, поэтому келоид считают плотной фибромой. Келоиды могут возникать после самой незначительной травмы. В основе образования келоида лежит системное поражение соединительной ткани.
Важнейшим условием нормального хода заживления раны является строгая синхронизация процесса эпителизации, с одной стороны, и созревания грануляционной ткани — с другой. Равновесие между созреванием, рассасыванием грануляций и рубцовой ткани лежит в основе феномена раневой контракции — равномерного концентрического сокращения краев и стенок раны.
Важную роль в процессах сокращения, уменьшения размеров раны играет так называемый вставочный рост — процесс разрастания кожи вокруг раны, направленный на восполнение утраченной массы кожи. Площадь кожи, вовлекаемой во внераневой вставочный рост, зависит от величины на-
531
носимого ранения: чем больше дефект, тем большая площадь интактной кожи включается в этот процесс.
Прямое отношение к процессам сокращения раны имеет так называемая сила натяжения ран. Она не увеличивается в первые 3—4 сут (так называемый латентный период), заметно нарастает в период образования коллагена, а в поздний период заживления, в фазе дифференциации коллагеновых волокон, изменяется вне зависимости от увеличения содержания коллагена.
Важное значение для скорости сокращения раны имеет так называемый феномен вторичной раны, т. е. наличие второй раны значительно ускоряет заживление и сокращение первоначальной раны, так как образование коллагена в ранах, раскрытых и повторно закрытых швами выше, чем в свежих ранах; соответственно выше и сила натяжения.
Особенности описанных вариантов заживления относятся к количественным, а не качественным различиям: во всех случаях в процессе участвуют одни и те же клеточные элементы, обеспечивающие принципиально сходную общую динамику раневого процесса (воспаление, пролиферация соединительной ткани, рубцевание и эпителизация).
18.2.3. Клинические особенности различных видов ран
Значительную роль в диагностике ран играют общеклинические методы обследования, которые складываются из выявления местных и общих симптомов.
Местными симптомами являются боль, кровотечение, зияние раны, степень гиперемии, характер раневого отделяемого, которые на практике оцениваются субъективно.
Боль в момент ранения возникает вследствие повреждения рецепторов и нервных стволов. Ее интенсивность зависит от количества нервных элементов в зоне повреждения. Раны в области лица, кисти, промежности и половых органов в силу богатой иннервации наиболее болезненные. Раневая боль обычно имеет характер жгучей, интенсивность ее возрастает и уменьшается синхронно с частотой ударов пульса («пульсирующая боль»). При страхе, ожидании травмы болевые ощущения сильнее. При возвышенном и спокойном положении поврежденной области раневая боль уменьшается.
Кровотечение зависит от характера и количества поврежденных сосудов. Чем острее инструмент, разделяющий ткани, тем сильнее кровоточит рана. При размозженных ранах кровотечение из сосудов менее значительное. При колотых и неосложненных огнестрельных ранениях мягких тканей без повреждения крупных сосудов кровотечение возникает лишь из капилляров поврежденных тканей. Кровотечение из паренхиматозных органов чаще имеют характер капиллярного. Капиллярное кровотечение со временем может повлечь за собой значительную кровопотерю, величина которой нередко недооценивается. Не всегда при ранении кровотечение бывает наружным. Выход крови из сосудов может осуществляться в ткани и приводить к образованию распространенных гематом.
Зияющая рана бывает в тех случаях, когда линия разреза идет поперек кожных линий или под углом к ним. Раны, расположенные поперек направления эластических волокон, отличаются большим зиянием, чем раны, идущие параллельно им.
При поверхностном, тангенциальном действии оружия возникают лоску-тообразные раны с дефектом тканей.
532
При огнестрельных ранах размеры и форма выходного отверстия являются очень важными показателями при определении тяжести повреждения тканей в области раневого канала.
Раны, которые возникают вследствие воздействия взрывной волны, не имеют раневого канала и представляют собой обширный дефект кожи разнообразной конфигурации с разрушением подлежащих тканей, массивной отслойкой мышечных групп и обнажением кости на большом протяжении.
Резаные раны возникают в результате непосредственного воздействия острого оружия (нож, бритва, осколки стекла) на поверхность кожи. Они отличаются минимальным разрушением тканей по ходу раневого канала. В такой ране имеются хорошие условия для эвакуации отделяемого из раневой полости. Одновременно могут повреждаться сосуды, нервы, мышцы и сухожилия.
Рубленые раны образуются при опускании тяжелого острого оружия (топор, шашка) на кожу под углом. Края раны разошедшиеся и зазубренные с кровоизлияниями вокруг. Возможны сильное кровотечение, повреждение костей, ушиб окружающих тканей.
Колотая рана — результат глубокого проникновения острого тонкого инструмента (шило, штык, нож типа «стилет») при небольшом повреждении покровов. Возможно ранение полостей или суставов. Вследствие небольшого поперечника ранящего орудия и малого диаметра раневого канала края раны быстро склеиваются. Эти особенности колотых ран обусловливают трудности диагностики нарушения целостности глубжележащих структур и высокий риск инфекционных осложнений вследствие затруднения оттока раневого отделяемого.
Ушибленные раны возникают в том случае, если какая-нибудь часть тела вступает в контакт с жестким препятствием и имеется твердая опора в виде костей черепа или другой кости. Они имеют неправильную форму, окружающие ткани размозжены, вокруг раны — выраженные кровоизлияния, гематомы. Жизнеспособность тканей нарушена, и в последующем они подвергаются некрозу.
Раздавленные, размозженные (рваные) раны образуются вследствие воздействия тупого орудия с широкой поверхностью при противопоставлении твердой опоры. Эти раны, как правило, имеют рваные зазубренные края, неправильную форму; отмечаются массивные кровоизлияния в коже, подкожной клетчатке, мышцах. Обычно рана заполнена сгустками крови, кровоточит умеренно. При попадании кожи между жесткими поверхностями происходит ее сильное повреждение, возникает некроз.
Если рана образовалась с полным или почти полным отделением лоскута кожи, то она называется скальпированной.
Вследствие укуса животных или человека возникают укушенные раны, в которые могут поступать высоковирулентные возбудители раневой инфекции. На этом основании не следует пренебрегать даже небольшими укушенными ранами. Крысы, мыши, куницы, белки и кошки являются переносчиками болезни укуса крыс (содоку) и бешенства (собаки и лисицы). Змеиные укусы, несмотря на небольшие размеры раны, из-за возможного развития параличей (нейротоксин) и гемолитических осложнений особенно опасны. Укусы насекомых вызывают местный отек, покраснение и центральный некроз в месте укуса. Иногда возникает воспаление с абсцедиро-ванием.
Хирургические раны образуются при каждой операции, когда происходит разъединение тканей. При асептических условиях после окончания вмешательства края операционной раны могут быть адаптированы без оставления
533
просветов, на них накладывают швы. Главное отличие операционных ран — их стерильность, что, впрочем, бывает далеко не всегда.
Внешний вид раны в I фазе раневого процесса определяется проявлением воспаления — гиперемией и отеком кожи в окружности раны, инфильтрацией ее стенок, болезненностью при пальпации зоны раны. На стенках раны обнаруживают участки некротизированных тканей, плотные фибринозные наложения. В раневой полости содержится раневой экссудат либо гной. Ткани при обработке раны кровоточат слабо.
Клинически процессы заживления во II фазе проявляются уменьшением гиперемии и воспалительного отека в окружности раны, уменьшением количества гнойного отделяемого. Поверхность раны постепенно очищается от некротических масс. Фибринозный налет истончается и легко отходит от раневой поверхности, которая заполняется сочными, легко кровоточащими розово-красными грануляциями.
Наступление III фазы заживления характеризуется уменьшением размеров раны, отсутствием отделяемого с раневой поверхности. Эпителий нарастает на поверхность грануляций в виде голубовато-белой каймы, которая в итоге закрывает всю раневую поверхность, завершая ее заживление.
Диагностика. При осмотре раны формируется представление о зоне повреждения, соотношении внутренних органов, костей и нервов с раневым каналом, внешнем виде тканей, консистенции и запахе раневого отделяемого. Пальпаторно определяют пульсацию магистральных и периферических сосудов в зоне раны, кожную температуру, отечность тканей и наличие жидкости в полости раны, подкожную и костную крепитацию. При ау-скультации можно выявить пульсацию гематомы или посттравматический стеноз магистрального сосуда. Дополнительно используют зондовое исследование раневого канала, при котором уточняют направление и характер раневого канала, определяют наличие инородных тел. С этой же целью широко используют рентгенографию и ангиографию, дающие информацию об объеме повреждения тканей, целостности костных структур, признаках проникающих повреждений, наличии контрастных инородных тел.
Точную информацию может дать вульнерография — рентгеноконтраст-ное исследование полости раны.
Использование компьютерной томографии, ультрасонографии существенно расширяет диагностические возможности при ранениях.
Методики, применяемые для оценки течения раневого процесса, подразделяют на 3 группы:
А методики, отражающие состояние тканей, образующих стенки раны и параметры раневого содержимого. С их помощью оценивают характер магистрального и капиллярного кровотока (биомикроскопия, фотоклеточная оксигемометрия, окклюзионная плетизмография, ультразвуковая допплерография, прижизненное окрашивание тканей красителями и флюорохромами). Особенности обмена веществ в тканях характеризуют полярография и редоксметрия. Выраженность воспалительной реакции в определенной степени отражает динамика электропотенциалов в области раны. Возможно также исследование отдельных физико-химических параметров раневого отделяемого: рН, про-теинограммы, электролитного состава, показателей системы гемостаза;
А методики, характеризующие качественно и количественно микрофлору раны. Качественное бактериологическое исследование состоит из трех этапов: выделение микроорганизмов; идентификация микроорга-
534
низмов; определение их чувствительности к антибиотикам и химио-препаратам. Основным показателем количества микроорганизмов в ране является уровень обсемененности на 1 г ткани раны; А методики, определяющие состояние местной и общей резистентности и иммунитета: разнообразные внутрикожные пробы с красителями, сыворотками, аутолимфоцитами, изучение бактерицидности кожных покровов и сыворотки крови и др. Для оценки системы иммунитета исследуют уровни иммуноглобулинов в крови, свойства субпопуляций иммунокомпетентных клеток и др.
Наиболее перспективным считают комплекс методов оценки раневого процесса, включающий: электроимпедансометрию тканей в области раны, редоксметрию раневой полости и поверхности, дающую раннюю достоверную информацию об особенностях метаболизма раневой микрофлоры и направлении течения раневого процесса; качественное и количественное исследование микрофлоры раны, в том числе и анаэробов, характеризующее динамику очищения раны в процессе лечения; иммунологические методы.
18.2.4. Виды заживления ран
Выделяют 3 вида заживления ран.
Первичное натяжение представляет собой процесс организации (т. е. замещения соединительной тканью) содержимого раневого канала (сгустков крови, отчасти некротических масс, не подвергшихся распаду). При небольшом объеме поражения, в частности при линейном разрезе ткани, края раны как бы слипаются, тонкая фибринная пленка, образующаяся между ними, быстро прорастает фибробластами и подвергается организации с образованием узкого, часто едва заметного рубца. Первичным натяжением заживают, например, стянутые швами разрезы после хирургических вмешательств. При заживлении раны первичным натяжением все процессы репа-ративной регенерации совершаются в глубине раны, т. е. ниже уровня ее краев, что также отличает первичное натяжение от заживления вторичным натяжением.
Вариантом заживления первичным натяжением может быть инкапсуляция. В том случае, когда в ране присутствует небольшое инородное тело (осколок ранящего снаряда, лигатура), не несущее на себе патогенной микрофлоры, вокруг него возникает область асептического воспаления, не влияющего на общий характер заживления раны. Исходом такого воспаления является образование соединительнотканной рубцовой капсулы, отграничивающей инородное тело от окружающих тканей. Однако инкапсулированные тела могут быть источником «дремлющей» инфекции, которая может проявиться даже через несколько лет после заживления раны и служить причиной гнойных свищей и других инфекционных осложнений.
Вторичное натяжение представляет собой заживление раны путем выполнения раневого дефекта грануляционной тканью, в связи с чем процесс именуют также «заживлением посредством гранулирования». Заживление вторичным натяжением происходит, если ткани, составляющие стенки раны, нежизнеспособны (большая зона повреждения) или имеется большой зияющей раневой дефект. Кроме того, при любом состоянии тканей и любой степени зияния рана заживает вторичным натяжением, если в нее внесены вещества, резко усиливающие раздражение рецепторного аппарата и
535
патогенную импульсацию из раны, а тем более непосредственно вызывающие гибель клеток и тканей в ране. Агентами такого рода могут быть многие вещества, химически активные или радиоактивные, но особенно часто — продукты жизнедеятельности патогенных микробов, возбудителей раневой инфекции. Заживление раны осуществляется через ее воспаление (нагноение), формирование хорошо выраженной грануляционной ткани и последующее ее фиброзирование с образованием глубокого рубца.
Заживление раны вторичным натяжением характеризуется выраженностью и значительной продолжительностью всех фаз раневого процесса. Сроки заживления при этом могут колебаться от 10—15 сут до нескольких месяцев.
Выделяют еще так называемое заживление под струпом, когда дефект ткани покрыт корочкой из свернувшегося и подсохшего секрета, крови и некротических масс. Регенерирующий эпидермис постепенно продвигается под струпом с краев раны, ложась на молодую соединительную ткань, восполняющую образовавшийся дефект. После того как последний покроется тонким слоем молодого эпителия, струп отпадает.
18.2.5, Принципы оказания первой медицинской помощи при ранениях
Первая помощь при ранениях предполагает туалет раны, наложение защитной асептической повязки, временную остановку наружного кровотечения, иммобилизацию зоны ранения и введение анальгетиков. При возможности проводят профилактическое введение противостолбнячного анатоксина и сыворотки, назначают антибактериальные средства. Этими мерами обычно ограничивается объем помощи при ранениях, не требующих первичной хирургической обработки. К таким ранениям относятся: сквозные ранения мягких тканей при отсутствии признаков повреждения крупных сосудов, костей; поверхностные ранения (включая касательные и слепые мелкоосколочные), не проникающие глубже подкожной клетчатки.
18.2.6. Хирургическая обработка ран мягких тканей
В системе комплексного лечения ран ведущее место принадлежит первичной хирургической обработке (ПХО), целью которой являются профилактика раневой инфекции, остановка кровотечения, полное обследование раневого канала для определения степени повреждений анатомических структур, удаление очагов первичного травматического некроза, адекватное дренирование раневой полости и создание условий для благоприятного заживления. В идеальном варианте ПХО должна быть ранней, одномоментной и по возможности радикальной. По срокам выполнения различают три вида ПХО: ранняя, отсроченная, поздняя, которая нередко несет в себе элементы повторной и вторичной.
Повторная хирургическая обработка направлена на удаление вновь образовавшихся участков вторичного некроза до возникновения в ране инфекционных осложнений. Как правило, повторная хирургическая обработка выполняется в сроки до 3—5 сут после произведенной ПХО.
Вторичная хирургическая обработка осуществляется в ране, в которой возникли инфекционные осложнения. Цель ее — наиболее полное очищение раны от некротического субстрата и гнойного экссудата, уменьшении
536

Рис. 18.2. Первичная хирургическая обработка (рассечение раны).
микробной обсемененности тканей и противодействие дальнейшему распространению инфекционного агента.
Показаниями к такой операции служат: наличие в ране участков некро-тизированных или инфильтрированных гноем тканей; обнаружение не дренированных раневых карманов и гнойных полостей; распространение ин-фекционно-воспалительного процесса за пределы раны в виде затеков, околораневой флегмоны, часто сопровождающихся регионарными лимфангитом, лимфаденитом, тромбофлебитом и сепсисом; возникновение арро-зивного кровотечения из раны.
При выполнении ПХО выделяют следующие этапы: 1 — рассечение раны с удалением инородных тел и остановкой кровотечения; 2 — иссечение краев раны с удалением нежизнеспособных тканей; 3 — проведение восстановительных и реконструктивных элементов вмешательства.
А Рассечение раны должно быть таким, чтобы позволить визуально обследовать ее и удалить все, что способствует развитию инфекции и будет препятствовать заживлению раны (рис. 18.2).
Это прежде всего кровяные сгустки и скопление жидкой крови, инородные тела, особенно обрывки обуви, одежды, куски земли, полностью отделенные участки тканей и обрывки их, висящие на ножке, не содержащей сосудов, или же имеющиеся в ней сосуды раздавлены или размозжены ранящим агентом, что делает питаемые с помощью этих сосудов ткани обреченными на неминуемую гибель. Начинают с рассечения кожи, подкожной клетчатки и фасции на таком протяжении, чтобы можно было хорошо осмотреть все слепые карманы раны. Рассечение обычно производят вдоль оси конечности. Если раны множественные, но не очень глубокие и располагаются близко друг от друга, то следует соединить их одним разрезом. Если же раны глубокие и расположены на значительном расстоянии, то каждую из них обрабатывают отдельно. На фасции делают Z-образные разрезы (рис. 18.3).
Рассечение фасции и апоневроза, в особенности на бедре, с добавлением боковых разрезов в нижнем и верхнем углу раны, обеспечивает не только достаточную экспозицию всех тканей, но и предупреждает возможное сдавление мышц, способствует быстрейшему спадению отека и нормализации микроциркуляции в поврежденных тканях.
537
Рис. 18.3. Первичная хирургическая обработка (Z-образное рассечение апоневроза).
А Иссечение преследует цель удалить некротизированные и нежизнеспособные ткани (рис. 18.4).
Иссечение погибших и плохо кровоснабжаемых тканей без вреда для раненого часто требует исключительно точного хирургического решения и здравого смысла, особенно при хирургической обработке ран кисти, лица, половых органов, предплечья, где удаление потенциально жизнеспособных тканей может создать реальную угрозу утраты формы и функции поврежденной части тела. Поэтому удалению при хирургической обработке раны подлежат только те ткани, утрата жизнеспособности которых не вызывает сомнений. Если же жизнеспособность поврежденных тканей или ее сохранение в дальнейшем сомнительны, то такие ткани должны быть оставлены на месте для тщательного наблюдения за ними в последующем и удаления их в случае некроза или развития инфекционного процесса при повторной хирургической обработке раны. Наиболее надежными критериями необра-

Рис. 18.4. Первичная хирургическая обработка (иссечение нежизнеспособных тканей).
538

Рис. 18.5. Дренирование раны.
а — однослойное; б — послойное.
тимой гибели мышечной ткани являются утрата его способности отвечать сокращением на механическое раздражение и отсутствие активного кровотечения из краев мышечной раны. Менее надежна оценка жизнеспособности мышц по их цвету, так как последний во многом зависит от состояния кровообращения в исследуемой мышце, нарушения которого могут быть как функциональной (часто обратимые), так и органической (как правило, необратимой) природы. Проще оценить жизнеспособность кожи, где линия демаркации отчетливо определяется уже через 24 ч после травмы. В более ранние сроки в определении жизнеспособности кожных покровов могут быть использованы феномен «белого пятна», кожная термометрия, наличие или отсутствие кровотечения из дистального края кожной раны. В настоящее время определение границ нежизнеспособности ткани облегчается лишь путем планируемой повторной хирургической обработки раны на 3—5-е сутки после ранения.
Определенную осторожность следует проявлять при хирургической обработке поврежденных сухожилий. Рекомендуется производить тангенциальные иссечения поврежденных тканей сухожилий. При больших повреждениях сухожилия в момент первичной обработки ран их не восстанавливают. При удалении нежизнеспособных тканей важно сохранить проходящие нервы и неповрежденные сосуды. Проходимость крупных сосудов должна быть восстановлена с помощью временного протезирования или сосудистого шва.
В конце хирургической обработки сосуды, нервы и сухожилия следует по возможности закрыть мягкими тканями для предупреждения их высыхания, дополнительной травмы и некроза. Полость суставов закрывают. Если зашивают синовиальную оболочку, то закрывают и капсулу сустава. Когда в ходе ревизии раны выявляется повреждение кости, то свободно лежащие костные фрагменты должны быть удалены, отломки обработаны и сопоставлены, сразу же должна быть обеспечена надежная иммобилизация конечности.
Пассивное дренирование применяют при неглубоких «открытых» ранах и при дренировании подкожной клетчатки небольших ушитых послеоперационных ран. В этих случаях в рану вводят резиновые или марлевые полоски, турунды, трубчатые дренажи (рис. 18.5), которые не дают слипаться краям кожной раны и обеспечивают ток раневого отделяемого в повязку под действием силы тяжести или за счет капиллярных свойств гигроскопичного перевязочного материала.
539
Недостатком такого способа дренирования является достаточно быстрое прекращение действия марлевых выпускников вследствие заполнения капилляров вязким экссудатом. Кроме того, при их смене травмируются появляющиеся в ране грануляции. Вариантом пассивного дренирования раны является тампонада по Микуличу, применяемая при наличии обширных раневых полостей с дефектом кожи. Дно и стенки раны выкладывают в виде мешка двухслойной марлевой салфеткой, а образовавшуюся полость выполняют тампонами с антисептическими средствами. При смене тампонов подлежащую салфетку не удаляют, чем предупреждают травматизацию грануляций.
Активное дренирование подразумевает принудительное удаление содержимого из полости раны. Активное дренирование показано при глубоких обширных ранах со сложной конфигурацией раневого канала и наличием замкнутых карманов.
Выбор метода закрытия раны после хирургической обработки является одним из центральных в хирургии. Шов раны показан при условии сопоставления краев раны без натяжения и нарушения кровоснабжения тканей — применяют различные виды швов (схема 18.1).
Схема 18.1. Виды швов и условия, позволяющие их накладывать на рану после хирургической обработки [Шапошников Ю. Г. и др., 1995]
Виды швов
|
|
|
Накладывают редко, преимущественно на лице: — в ране не должно быть признаков |
|
|
| |
|
|
или угрозы развития инфекцион- | |
|
|
ного воспаления; | |
|
|
— при уверенности в радикальности | |
|
|
хирургической обработки; | |
|
|
— при удовлетворительном состоянии | |
|
|
раненого и возможности наблю- | |
|
|
дать его на данном этапе эвакуа- | |
|
|
|
ции до снятия швов |
Накладывают сразу после хирургической обработки
Первичный
провизорный
Накладывают, не завязывая нитей, на большинство ран без признаков раневой инфекции; швы затягивают на 4—5-е сутки при спокойной ране
Накладывают сразу после хирургической обработки
Первичный
отсроченный
Накладывают на рану без признаков микробного воспаления до развития грануляций
Накладывают на 6— 7-е сутки после хирургической обработки
Вторичный
ранний
Накладывают на гранулирующую рану без признаков глубокой раневой инфекции при удовлетворительном состоянии раненого
Накладывают на 8— 15-е сутки после хирургической обработки
Вторичный
поздний
Накладывают в стадии рубцевания раны; рубцы и грануляции иссекают, края раны мобилизуют для последующего сближения швами
Накладывают на 20— 30-е сутки после хирургической обработки
Первичные швы накладывают непосредственно по окончании хирургической обработки раны. Условиями для наложения шва являются уверенность в радикальности хирургической обработки, отсутствие клинических признаков воспалительной реакции в тканях после хирургической обработки, адекватное кровоснабжение и иннервация в зоне ранения с учетом целости магистральных сосудов и нервов, удовлетворительное общее состояние больного, профилактическое применение антибиотиков.
Такое сочетание благоприятных условий для наложения первичного шва встречается, как правило, в стационарных условиях после выполнения плановых хирургических вмешательств, когда рана, образовавшаяся вследствие выполнения оперативного доступа, наносится по возможности атравматич-но. В хирургии повреждений это встречается достаточно редко, поэтому здесь широко используются первично-отсроченный шов и вторичные швы.
Однако существует ряд повреждений, при которых имеются абсолютные показания к наложению первичного шва или первичной кожной пластики: скальпированные раны головы и лица, ранения пальцев кисти с дефектом кожи, открытые повреждения в области суставов, ранения и отрывы кожи полового члена.
В этих случаях для кожной пластики и шва могут быть использованы кожные покровы, расположенные в непосредственной близости от раны; полностью и частично отторгнутые кожные лоскуты; кожные покровы, взятые в отдалении от раны, в том числе с удаленных сегментов конечностей.
Первично-отсроченный шов накладывают, как правило, между 4-м и 7-м днем после хирургической обработки до появления в ране грануляций. За это время купируются явления первичной воспалительной реакции, связанной с повреждением тканей, отграничивается зона вторичного некроза, истекают сроки инкубационных периодов для большинства патогенных микробных штаммов. Одновременно проводят профилактические антимикробные мероприятия, осуществляют полноценное комплексное лечение больного.
Вторичные швы накладывают на гранулирующую рану, в которой отсутствуют признаки инфекционного воспаления. Различают ранний вторичный шов, который накладывается на 8—15-й день после хирургической обработки раны. При наложении такого шва грануляции не иссекают, края раны не мобилизуют, так как они должны быть легко сопоставимы. Поздний вторичный шов накладывают на 15—30-й день после хирургической обработки, что, как правило, связано с длительным течением инфекционного процесса в ране. К этому сроку на отдельных участках раны и ее краях развивается рубцовая ткань, которая существенно ограничивает подвижность краев раны. Поэтому операция наложения вторичного позднего шва включает иссечение рубцов и грануляций, мобилизацию краев раны.
В тех случаях, когда одномоментное закрытие раны швом невозможно из-за обширного дефекта кожи, а свободная кожная пластика дает неблагоприятный функциональный результат, возможно использование так называемых экспандерных методов закрытия раны. Один из вариантов такого метода заключается в постепенном дозированном затягивании шва в течение 2—3 нед. Для предотвращения прорезывания швов вдоль края раны проводят укрепляющие металлические конструкции (спицы). По другой методике в непосредственной близости от раны подкожно имплантируют баллон из индифферентного материала, который постепенно увеличивают в объеме. В зоне баллона за счет эластичного растяжения постепенно создается избыток кожи, который и используется для закрытия раны.
При закрытии раны любым видом швов необходимо тщательное клиническое наблюдение за процессом заживления. Оно состоит в контроле за
541
Рис. 18.6. Узловые швы.
а — простой; б — вертикальный матрацный; в — горизонтальный матрацный.
функционированием дренажей, своевременной диагностике неинфекционных осложнений заживления, а также ранней диагностике гнойного воспаления.
При наложении швов необходимо соблюдать принцип хорошей адаптации краев раны, в ней нельзя оставлять недренируемые полости и карманы. В обычных условиях это достигается послойным ушиванием раны обычными узловыми швами. В то же время в ранах с высоким риском нагноения нежелательно оставляет неснимаемые (внутритканевые) лигатуры из нерассасывающегося материала (шелк, капрон, лавсан), которые впоследствии могут являться очагом хронического воспаления.
В этих случаях предпочтительнее наложение наружного многостежкового узлового шва (рис. 18.6).
В условиях умеренных воспалительных изменений краев раны целесообразно использование разгружающих (ретенционных) швов, а также амортизаторов (резиновых и ПХВ-трубок, резиновых пробок, пуговиц) (рис. 18.7).
При наличии округлых раневых кожных дефектов площадью более 5 см2 возможно использование различных вариантов кожной пластики. Свободная кожная пластика для закрытия обширных раневых поверхностей в настоящее время выполняется главным образом в виде дерматомной аутопластики перфорированным (сетчатым) лоскутом.
В целом основные принципы хирургической обработки сводятся к широкому рассечению мышечно-фасциальных футляров, что способствует не толь-
542
ко хорошему осмотру раны, но и улучшению ее кровоснабжения за счет декомпрессии отечных тканей; щадящему отношению к естественным тканевым барьерам, исключающему их дополнительную травматизацию: отказ от грубых лигатур, неумеренной электрокоагуляции, прошивания больших мышечных массивов; устранению по ходу операции замкнутых пространств и полостей, где создаются оптимальные условия для вегетации микробов; созданию естественных барьеров (кожных, мышечных) между внешней средой и тканями, обладающими невысокой устойчивостью к инфекции; адекватному гемостазу на всех этапах операции.
В практике современной хирургии осуществляют ПХО как одномоментную первично-восстановительную операцию — выполняют восстановительные вмешательства на поврежденных магистральных кровеносных сосудах, костях, сухожилиях и нервах, однако это требует надлежащего оснащения и должной квалификации хирурга.

Рис. 18.7. Ретенционные швы.
а — сквозной; б — внутренний коаптационный; в — прокладки под разгружающие швы.
543
18.2.7. Инфекционные осложнения ран
Инфекционные осложнения являются обязательным компонентом тяжелых травм.
Частота таких осложнений зависит от состояния защитных реакций организма, с одной стороны, и количеством и вирулентностью внедрившихся в рану возбудителей инфекции — с другой.
Пути попадания микробов в рану различны. Наиболее часто микрофлора заносит из окружающей среды в момент ранения — первичное микробное загрязнение раны. Кроме того, микробы-сапрофиты проникают в рану с поверхности кожи и из ее придатков — сальных и потовых желез, волосяных фолликулов, из просвета поврежденных полых органов, при нарушении правил асептики во время перевязок и операций — это вторичное микробное загрязнение раны. При развитии инфекционного процесса в ране в отличие от бактериального загрязнения, микробы распространяются в глубь жизнеспособных тканей и лимфатические и кровеносные пути, после чего проявляется их патогенное воздействие как на течение местного раневого процесса, так и организм в целом.
18.2.8. Современные принципы лечения гнойных ран
В комплексе мероприятий, направленных на лечение гнойной раны, важнейшее значение имеют:
скорейшее очищение раны от погибших и нежизнеспособных тканей, создание благоприятных условий для оттока раневого отделяемого;
подавление жизнедеятельности раневой микрофлоры и уменьшение степени микробной обсемененности раны;
устранение факторов, неблагоприятно влияющих на заживление раны, и коррекция нарушений иммунобиологической защиты организма.
Решение этих задач возможно только при рациональном сочетании оперативных методов лечения с приемами физической санации ран, использованием современных препаратов для местного медикаментозного лечения ран, комбинированным применением антибиотиков, комплексном общем лечении патологических синдромов, определяющих ход заживления раны.
Для лечения гнойных ран разработан метод активного хирургического лечения, включающий следующие основные компоненты:
радикальная хирургическая обработка раны с удалением всех нежизнеспособных тканей и с использованием дополнительных методов обработки (ультразвук, лазер и др.);
дренирование ран с промыванием, использование управляемой абак-териальной среды;
использование мазевых композиций на полиэтиленгликолевой основе;
раннее закрытие ран с помощью кожной пластики;
сочетание хирургического лечения с проведением многокомпонентной интенсивной терапии, включая регионарную внутриартериальную и(или) внутрилимфатическую инфузию антибактериальных препаратов.
Ликвидация гнойной раны в большинстве случаев может быть достигнута только одним способом — радикальной хирургической обработкой.
544
Под хирургической обработкой гнойной раны понимают широкое ее рассечение с вскрытием карманов и затеков и иссечением всех некротических, нежизнеспособных и пропитанных гноем и кровью тканей как основного субстрата для развития раневой инфекции. Помимо удаления нежизнеспособных тканей («питательная среда» для развития микробов), хирургическая обработка имеет целью значительное снижение количества микробов в ране.
Хирургическая обработка показана не только в I фазе течения раневого процесса. Показания к хирургической обработке во II фазе определяются также стремлением максимально быстро закрыть раневую поверхность вторичными швами или местными тканями. Хирургическое вмешательство часто необходимо и в фазе регенерации в связи с образованием гнойных затеков, потребностью повторного иссечения воспалительно-измененных тканей и гнойных грануляций.
Хирургическая обработка состоит из следующих основных элементов: 1) туалет окружности раны; 2) рассечение раны (доступ); 3) иссечение нежизнеспособных, загрязненных и имбибированных тканей; 4) применение методов дополнительной обработки раны (промывание пульсирующей струей жидкости, вакуумирование, ультразвук); 5) дренирование; 6) раннее закрытие раны.
Подготовку и обработку операционного поля следует проводить по всем правилам, принятым в общей хирургии. Для туалета раны и ее окружности эффективно мытье кожи и промывание самой раны гексахлорофеновым мылом и стерильными щетками под проточной водой (душ) или пульсирующий струей раствора антисептиков. Механическая очистка кожи и промывание самой раны уменьшают бактериальную обсемененность и создают асептические условия для оперативного вмешательства.
Рассечение рассматривают как оперативный доступ (разрез), необходимый для ревизии раны и выполнения основного этапа хирургической обработки — удаления нежизнеспособных тканей. Разрез следует производить с учетом анатомо-топографической характеристики раны, он должен быть достаточным для надежного доступа в глубину раны и ее ревизии, обеспечивать возможность полноценного иссечения некротизированных тканей, удаления гематомы и создания хорошего оттока раневого отделяемого.
Затем наступает основной и самый ответственный этап оперативного вмешательства — удаление нежизнеспособных тканей в направлении от поверхностных слоев к глубоким.
В результате радикальной хирургической обработки, особенно при обширном гнойном поражении, нередко образуются значительные дефекты мягких, а иногда и костных тканей. Эти обстоятельства ставят перед хирургом следующие задачи: 1) обязательное определение потенциальных или непосредственных возможностей максимально быстрого закрытия раневой поверхности любым доступным способом пластики; 2) обязательное эффективное активное дренирование раны после хирургического вмешательства любого объема.
В большинстве случаев при хирургической обработке ран различной этиологии и локализации полное иссечение погибших тканей и удаление всей раневой микрофлоры невозможны. Однако значение критического уровня содержания микробов в ране заставляет стремиться к максимальному уменьшению количества их в процессе операции. Повышение технического уровня оснащения хирургии открыло новые возможности для совершенствования техники и улучшения результатов хирургической обработки раны.
545
Промывание полости раны пульсирующей струей раствора антисептика осуществляется при помощи специальных приборов, которые подают в рану под давлением многократно ритмично прерывающуюся струю жидкости.
Использование специальных наконечников-распылителей позволяет обрабатывать слепые полости и затеки, сочетая промывание с кюретажем (выскабливанием) раневой поверхности. В качестве промывных сред используются растворы фурацилина, диоксидина. Такое промывание позволяет снизить микробную обсемененность раны на 2—3 порядка, создать депо антисептика в стенках раны за счет его импрегнации в ткани.
Метод вакуумной обработки раны основан на кратковременном создании отрицательного давления на отдельных участках раневой поверхности. С этой целью используют обычный операционный вакуум-отсос. При вакуумной обработке наконечник плотно прижимают к стенкам раны и, перемещая его, производят отсасывание детрита, свободных участков тканей, инородных частиц и микроорганизмов.
В настоящее время широко используют для обработки ран так называемые хирургические энергии — все виды хирургического воздействия на ткани с целью рассечения, иссечения, гемостаза, сопоставления краев раны с использованием ультразвукового, лазерного, плазменного воздействия.
Противопоказанием к проведению полной хирургической обработки гнойного очага является опасность повреждения жизненно важных образований — нервов, крупных сосудов, сухожилий, суставных сумок. В таких случаях операцию ограничивают широким рассечением гнойной раны и адекватным ее дренированием с иссечением лишь крупных очагов некроза, т. е. выполняют частичную хирургическую обработку.
Обязательным условием успешной хирургической обработки ран является создание беспрепятственного оттока раневого отделяемого с помощью различных методов дренирования. В зависимости от характера раны, конфигурации раневого канала, количества экссудата возможно применение различных способов дренирования.
А Аспирационное дренирование основано на введении в полость раны трубок и создании в ней отрицательного давления. Отрицательное давление на периферическом конце дренажной трубки может быть создано посредством присоединения сжатой резиновой груши или специального коллектора, которые, расправляясь, отсасывают жидкость из раны (дренирование по Ре-дону). В качестве аспирационного устройства используют также водоструйный отсос, аппарат Боброва, специальные отсосы.
А Промывное дренирование позволяет осуществить механическое удаление раневого содержимого вместе с током промывной жидкости.
Промывное дренирование осуществляют посредством перфорированных трубчатых сквозных дренажей, проведенных через всю полость раны. При наличии глубоких полостей используют слепое дренирование при помощи двухпросветного трубчатого дренажа, один канал которого используется для введения жидкости, а второй — для удаления. Перфузатом может быть любой стерильный раствор, обладающий умеренной гипертоничностью и антимикробным действием, а также не оказывающий раздражающего действия на ткани.
А Аспирационно-промывное дренирование объединяет в себе два вышеуказанных метода и обеспечивается постоянным или периодическим промыванием раны при постоянном отсасывании содержимого из ее полости.
Модификацией этого вида является программированное дренирование, которое позволяет автоматически чередовать промывание и аспирацию ране-
546
вого содержимого, что приводит к более полному очищению полости и обеспечивает определенную экспозицию перфузата-антисептика в ране.
Хирургическую обработку гнойной раны стремятся по возможности превратить в восстановительную операцию, что дает возможность провести ее закрытие. Используют первично-отсроченный шов, ранний вторичный шов, поздний вторичный шов. Их разделяют на несколько этапов: наложение глухих швов в условиях массивной местной и общей антибактериальной терапии; наложение первичных отсроченных и вторичных швов после энзимотерапии гнойной раны; наложение швов в условиях активного дренирования раны. Наложение швов на гнойную рану возможно только при полном ее очищении от погибших и нежизнеспособных тканей. При наличии разнообразных способов принципы наложения шва на гнойную рану являются практически едиными — нельзя оставлять замкнутых полостей и недренируемых «карманов», адаптация краев и стенок раны должна быть максимальной, нежелательно оставлять лигатуры из нерасса-сывающегося материала, запрещается послойное ушивание раны. Обычно используют узловой шов, проведенный через все слои раны. Можно использовать многостежковой обвивной шов. Хорошее соприкосновение стенок и краев раны обеспечивает шов по Донати. В тех случаях, когда предполагается длительное удерживание краев раны и имеется опасность прорезывания швов, целесообразно наложение вторично-провизорных швов или дополнительно прошивают (на отдельных участках) полость раны чрескожно и затягивают швы на пелоте (марлевые салфетки, полиэтиленовые трубки).
Следующим по значимости и эффекту методом закрытия гнойной раны является кожная пластика главным образом в виде дерматомной аутопластики перфорированным (сетчатым) лоскутом.
18.2.9. Местное медикаментозное лечение ран
Местное медикаментозное лечение ран заключается в нанесении различных лекарственных препаратов на поверхность раны, а также введении их различными способами в ткани, окружающие раневую полость. Местное лечение применяется как с профилактической целью до проведения хирургической обработки, так и в качестве лечения ран после нее. Местному медикаментозному лечению подлежат практически все раны, которые после хирургической обработки нельзя закрыть первичным швом наглухо.
Лекарственные препараты применяют строго в соответствии с фазой раневого процесса в зависимости от задач лечения. Некоторые средства имеют комплексный механизм действия, однако лекарств, которые можно эффективно использовать во всех фазах заживления, в настоящее время не существует.
а В первой фазе раневого процесса для ускорения купирования воспалительной реакции местные медикаментозные средства должны обеспечить подавление инфекции, эвакуацию раневого отделяемого, отторжение некроза, улучшение трофики тканей раны.
С этой целью применяют следующие препараты.
Антисептики в виде растворов и присыпок используют как для промывания раны, так и для аппликации на раневую поверхность вместе с марлевыми повязками. Наиболее широкое распространение получили 0,02 % раствор фурацилина, 0,5 % раствор хлоргексидина, слабый раствор этилового спирта, повидон-йода, йодметроксида.
547
Использование антисептических растворов целесообразно в виде влажно-высыхающих повязок на свежие раны до появления в них признаков развития инфекции. При лечении гнойных ран возможно применение антисептических ванн, где антибактериальное действие раствора сочетается с механическим очищением раневой поверхности.
Порошкообразные формы антисептиков создают защитный слой на поверхности раны, предотвращая дополнительное внедрение патогенной микрофлоры. Обычно применяют порошки стрептоцида, ксероформа, присыпку И. Д. Житнюка (стрептоцид 20,0; борная кислота 5,0; ксероформ 20,0; анестезин 5,0; глюкоза 50,0).
Гипертонические растворы (10 % раствор хлорида натрия, 40 % раствор глюкозы, 20 % раствор мочевины) улучшают дренирующие свойства марлевой повязки за счет осмотического эффекта, который, однако, уменьшается по мере высыхания повязки и заканчивается через 4—6 ч, что вызывает необходимость очередной перевязки.
Мази на основе полиэтиленоксида (водорастворимые мази) — левосин, ле-вомеколь, 5 % диоксидиновая мазь, 10 % мазь мафенид-ацетата, йодмет-риксилен и др. обладают хорошими гидрофильными, антибактериальными и некролитическими свойствами. Применение водорастворимых мазей быстро купирует отечность поврежденных тканей, уменьшает раневую экссудацию, способствует отторжению омертвевших тканей, оказывает выраженный обезболивающий эффект (за счет местного анестетика).
В последние годы разработана новая серия водорастворимых мазей, где в состав комбинированной основы-носителя введен проксанол. Мази «Диоксиколь», «Мирамистин», «Нитацид» сочетают мягкое дегидратаци-онное воздействие на ткани с высоким антибактериальным и некролити-ческим эффектом.
Протеолитические ферменты способствуют очищению ран и оказывают бактерицидное действие. Несмотря на различие в происхождении (животное, растительное, бактериальное), эти препараты обладают протеолитиче-скими, антикоагуляционными, противовоспалительными свойствами, повышают чувствительность раневой микрофлоры к антибактериальным средствам. Разжижая раневой экссудат, ферменты способствуют его лучшей эвакуации из полости раны.
Ферменты применяют как в нативном виде (трипсин, химотрипсин, папайи), так и в составе различных препаратов (ируксол). Нанесение порошка протеолитических ферментов на раневую поверхность или введение в раневую полость пропитанных ими влажных тампонов оказывает воздействие не более 3—4 ч. Постоянное воздействие достигается при помощи ферментативного орошения ран (в промывную жидкость, вводимую в рану по дренажам, добавляют протеолитический фермент). Промывание проводят постоянно или дробно, оставляя раствор ферментов в ране на 40—50 мин с последующей аспирацией.
Местное использование сорбентов является целесообразным и патогенетически обоснованным. Сорбирующие материалы обеспечивают отток с поверхности раны и из тканей воспалительного экссудата, содержащего микробы и их токсины, биологически активные вещества, продукты некро-лиза.
Местное применение в растворе антибиотиков ограничивается их низкой эффективностью за счет инактивации в кислой среде воспалительного очага, невысоким эффектом воздействия на живые ткани за счет ограничения их лейкоцитарным пиогенным валом, возможностью местного раздражающего воздействия и аллергизации, а также вследствие быстрой генера-
548
ции антибиотикорезистентных штаммов. Непосредственно вводить в рану можно лишь некоторые специально разработанные антибиотики: полимик-син М, неомицин, грамицидин.
Эффективным оказывается лечение таких ран с использованием коллаге-новой губки с иммобилизованным гентамицином, которую вводят после туалета раны и накладывают асептическую повязку. Перевязку производят в зависимости от вида раны, степени выраженности гнойных выделений 1 раз в сутки; для достижения очищения раны требуется всего 4—5 перевязок.
Введение окситоцин-антибактериалъных комплексов способствует снижению критической массы микроорганизмов в 2—3 раза на 2—3-й день лечения.
Значительно шире антибиотики применяют в составе новокаиновых блокад, действие которых направлено на улучшение трофики тканей, устранение спазма периферических сосудов, прерывание патологической афферентной импульсации, исходящей из зоны ранения. Патогенетическое действие новокаиновых блокад усиливается за счет введения в их состав стероидных гормонов (преднизолон, гидрокортизон, дексаметазон), ингибиторов проте-аз (контрикал, гордокс, трасилол), а также препаратов, улучшающих микроциркуляцию (но-шпа, компламин, трентал, реополиглюкин и др.).
В последние годы используется эндолимфатический путь введения антибиотиков, который быстро создает эффективное повышение их концентрации в регионарных лимфатических узлах.
Для местного лечения ран под повязкой применяют также перевязочные средства различной природы и структуры, содержащие в качестве активных веществ только фермент, только антибактериальное(ые) вещество(а), и повязки, содержащие оба этих агента.
После хирургической обработки рану промывают водными нейтральными растворами антисептиков, высушивают, а затем покрывают повязками, содержащими ферментативные вещества, фиксируя их вторичной асептической марлевой повязкой. В первые 3—5 дней повязку меняют ежедневно, в последующем — через день. Лечение ферментактивными повязками продолжают до очищения раны, а антибактериальными — до получения отрицательных бактериологических результатов. Метод применяют для лечения различных по конфигурации, локализации и этиологии гнойных ран мягких тканей, особенно с обильным отделяемым, и применим в любых условиях.
а Во второй фазе раневого процесса только невозможность или нецелесообразность по тем или иным причинам оперативного закрытия раны определяют необходимость продолжения ее местного лечения. Во второй и третьей фазах раневого процесса задачи местного лечения сходны; при этом полностью сохраняется основной принцип местного медикаментозного лечения гнойной раны: одновременное воздействие на каждый из факторов патогенеза, продолжение борьбы с раневой инфекцией, защита раневой поверхности от вторичного инфицирования, защита и стимуляция роста грануляций, стимуляция процесса эпителизации.
Чаще всего используют различные мази с антибиотиками на жировой основе: тетрациклиновую, эритромициновую, полимиксиновую, гентамици-новую. Мази на вазелиновой основе создают на раневой поверхности защитный слой — пленку, который обеспечивает наиболее благоприятные условия для развития грануляций и эпителия. В состав этих мазей могут входить также стимуляторы регенерации (метациловая мазь). Широкое распространение получили мазь Вишневского (дегтя березового 3 части, ксероформа 3 части, масла касторового 94 части) и винилин (бальзам Шостаковского), являющийся 20 % масляным раствором поливинил бутилового эфира.
549
Мази на водорастворимой основе не должны обладать выраженным гидрофильным эффектом, поэтому из этой группы в фазе регенерации чаще применяют мазь «Метилдиоксилин».
Антибактериальные средства применяют в виде присыпок, которые при отсутствии выраженной экссудации создают защитную корочку на поверхности раны. Растворы антибиотиков целесообразно наносить в сочетании с 10 % раствором димексида (диметилсульфоксида, ДМСО), который обладает определенным противовоспалительным действием, а также облегчает транспорт молекул антибиотиков через поверхность кожи и грануляций.
Хорошим стимулирующим эффектом обладают препараты облепихового масла (олазоль), пихтового масла (абиелин), масла шиповника (каротолин).
Стимуляторы роста соединительной ткани на основе экстрактов коллагена животного происхождения (солкосерил, комбутек) применяют при длительном замедленном течении репаративной фазы раневого процесса. Используют также альгипор — стимулятор репаративных процессов на основе альгиновой кислоты.
18.2.10. Озонотерапия ран
В первой фазе раневого процесса в зависимости от характера отделяемого и флоры чередуют обработку ран в газовом пластиковом мешке при постоянной поточной подаче газообразного озона со скоростью 1 л/мин и концентрации 5 мг/л в течение 20 мин ежедневно. После обработки в мешке проводят струйное промывание раны (раневой полости) озонированным 10 % раствором NaCl с концентрацией озона в растворе 0,85 ± 0,05 мг/л с одновременным подкожным введением в окружность раны 100—120 см газообразного озона, а также введением в магистральную вену пораженной конечности в максимальной близости к ране под жгутом 40—60 мл 0,9 % раствора NaCl с концентрацией озона в растворе 0,85 + 0,5 мг/л.
Применение такого комбинированного способа лечения гнойных ран позволяет с первых дней поступления больных активно бороться с условно-патогенной микрофлорой ран, так как озон при экспозиции 20 мин и концентрации 5 мг/л оказывает бактерицидное действие на широкий спектр раневой микрофлоры. Это позволяет сократить период очищения ран от гнойно-некротических тканей и создать оптимальные условия для дальнейшего течения раневого процесса.
18.2.11. Лечение ран в управляемой абактериальной среде
При обширных гнойных ранах показан метод лечения в управляемой воздушной абактериальной среде путем целенаправленного изменения микроклимата в изоляторе (температура, влажность, давление и скорость продуваемого воздуха).
Пораженную часть тела, наиболее часто конечность, помещают в прочный пластиковый герметичный мешок, у которого имеется входное отверстие и выпускной клапан. За счет непрерывной подачи стерильного воздуха с заданными температурой и влажностью в мешке создается абактериаль-ная среда. Постоянное подсушивание раневой поверхности способствует образованию тонкого рыхлого струпа, исчезновению отека, уменьшению микробной обсемененности раны. К достоинствам метода относится также
550
надежная профилактика внутригоспитального инфицирования, устранение «термостатного» эффекта, присущего лечению под повязками, отсутствие сдавления конечности.
Метод лечения в управляемой воздушной среде способствует ускорению течения воспалительной стадии раневого процесса. Обследование раны производят ежедневно, струп аккуратно удаляют, выполняют поэтапную некрэктомию. В результате за 5—8 сут добиваются полного очищения раны, подготавливают ее к пластическому закрытию или наложению швов.
18.2.12. Профилактика нагноения послеоперационных ран
В развитии инфекционных осложнений решающую роль играют сроки оказания первой помощи: остановка наружного кровотечения, наложение асептической повязки на рану, обезболивание и транспортная иммобилизация поврежденной области.
В специализированных лечебных учреждениях первостепенное значение приобретает своевременная и исчерпывающая первичная хирургическая обработка ран. При появлении признаков раневой инфекции необходима радикальная санация раны и инфекционного очага с помощью вторичной хирургической обработки и консервативных мероприятий, повышающих ее эффективность, в том числе использование массивных доз антибактериальных препаратов.
18.3. Травма головы
Черепномозговую травму разделяют на открытую, закрытую и проникающую.
К открытой черепно-мозговой травме относят повреждения черепа и головного мозга, при которых имеются раны покровов мозгового черепа (повреждение всех слоев кожи), но нет ликворных свищей.
Проникающие повреждения протекают с нарушением целостности твердой мозговой оболочки, в частности при переломах основания передней и средней черепных ямок. Эти переломы чаще всего сопровождаются нарушением целости воздухоносных полостей черепа и твердой мозговой оболочки, а также развитием ликворных свищей (макро- или микроликворея).
К закрытой черепно-мозговой травме относятся повреждения черепа и мозга, которые не сопровождаются нарушением целости мягких тканей головы и повреждением оболочек мозга. Критерием закрытых черепно-мозговых повреждений считается признак сохранности кожи мозгового черепа.
По механизму происхождения раны головы бывают резаными, колотыми, ушибленными, рваными, размозженными, укушенными, скальпированными и огнестрельными. Кожные раны не зияют. Поэтому их обработка не требует наложения швов. Все зияющие раны подлежат хирургической обработке.
Переломы костей черепа подразделяют на переломы свода черепа — вдавленные, оскольчатые, линейные; переломы основания черепа — линейные, сложные, оскольчатые, переломы свода и основания черепа — линейные, сложные.
Сотрясение головного мозга характеризуется утратой сознания после травмы продолжительностью от нескольких секунд до нескольких минут. Возможны ретро- и антеградная амнезии.
551
Ушиб головного мозга отличается от сотрясения макроскопически обнаруживаемыми участками повреждения мозгового вещества. Они бывают различными по выраженности, протяженности и глубине, одиночными и множественными, сопровождаются кровоизлияниями.
Сдавление головного мозга характеризуется опасным для жизни нарастанием через различные промежутки времени после травмы или непосредственно после нее общемозговых, очаговых и стволовых симптомов. Среди причин сдавления на первом месте стоят внутричерепные гематомы (эпи-дуральные, субдуральные, внутримозговые). Далее следуют очаги размозже-ния мозга, вдавленные переломы костей черепа, субдуральные гидромы.
Оценка тяжести состояния пострадавшего с травмой черепа и головного мозга. Отмечается прямая зависимость между тяжестью черепно-мозговой травмы и выраженностью и продолжительностью нарушения сознания.
Выделяют 7 градаций состояния сознания.
Ясное сознание — полная сохранность сознания с адекватными реакциями, всесторонняя ориентация. Сохранено активное внимание, возможны речевой контакт, осмысленные ответы на вопросы, выполнение инструкций, быстрая и целенаправленная реакция на любой раздражитель, сохранность всех видов ориентировки (в самом себе, месте, времени, окружающих лицах, ситуации).
Оглушение — нарушение сознания при сохранности ограниченного словесного контакта на фоне повышения порога восприятия раздражителей и снижения собственной активности.
Умеренное оглушение — частичная дезориентация, умеренная сонливость при сохраненной способности выполнения команд. Больной способен к активному вниманию, речевой контакт затруднен (как правило — при повторении вопросов), ответы с интервалом, выполнение команд с задержкой, обеднение мимики, сонливость. Контроль за функцией тазовых органов сохранен. Поведение не всегда упорядочено. Ориентация в окружающей обстановке и собственной личности, во времени — частичная.
Глубокое оглушение — дезориентация, глубокая сонливость, возможно выполнение лишь простых команд. Больной в состоянии сна, периодически в двигательном возбуждении, речевой контакт возможен, но крайне затруднен, непостоянен, ответы на вопросы односложны, нередко неправильны. Сохранена способность выполнения отдельных простых заданий (открыть глаза, пожать руку, показать язык). Для поддержания контакта необходимы повторные, многократные повторения задания, громкий окрик, зачастую с применением болевых раздражителей. Реакция на боль координированная. Контроль за функцией тазовых органов ослаблен. Дезориентация в месте, времени, обстановке; ориентация в собственной личности, как правило, сохранена.
Сопор — отсутствие сознания с сохранением защитных реакций и открыванием глаз в ответ на болевые, сильные и многократные звуковые раздражители, хотя и не постоянно. Больной отчетливо сонлив. Лишь при многократном обращении и нанесении болевого раздражителя открывает глаза или делает попытку открыть глаза, приподнять руку. Реакция на боль координированная. Неподвижность или автоматизированные стереотипные движения. Страдальческая гримаса на лице, периодически стон. Зрачковые, корнеальные, глотательные и глубокие рефлексы сохранены. Контроль над функцией тазовых органов нарушен. Витальные функции сохранены.
Кома — отсутствие сознания. В зависимости от выраженности и продолжительности неврологических и вегетативных нарушений подразделяется по степеням на умеренную, глубокую и запредельную.
552
Кома умеренная — разбудить больного невозможно, отсутствует реакция на звук при сохраненной вялой реакции на болевые раздражители. В отличие от сопора реакция на боль некоординированная, глаза не открывает. Сухожильные рефлексы вариабельны, поверхностные, как правило, угнетены, выявляются патологические рефлексы (стопные, орального автоматизма). Глоточные рефлексы, как правило, сохранены, но глотание затруднено. Контроль над функцией тазовых органов отсутствует. Дыхание и сердечно-сосудистая деятельность сравнительно стабильны, без угрожающих жизни отклонений.
Кома глубокая — разбудить больного невозможно, отсутствуют защитные рефлексы на боль, изменения мышечного тонуса, диссоциация менин-геальных симптомов, гипо- или арефлексия без двустороннего мидриаза, спонтанное дыхание сохранено, сердечно-сосудистая деятельность не имеет отчетливых критических нарушений витального характера.
Кома запредельная — более грубое нарушение неврологического статуса по сравнению с предыдущей формой нарушения сознания: двусторонний мидриаз, диффузная мышечная атония, выраженные нарушения витальных функций — расстройства ритма и частоты дыхания или апноэ, выраженная тахи- или брадикардия, АД критическое или не определяется, арефлексия.
Оценка тяжести состояния больного. Используют минимум 3 параметра — состояние сознания, состояние витальных функций, состояние очаговых неврологических функций. Выделяют 5 градаций состояния больных с черепно-мозговой травмой: удовлетворительное; средней тяжести; тяжелое; крайне тяжелое; терминальное.
▲ Удовлетворительное состояние. Сознание ясное; отсутствие наруше ний витальных функций; отсутствие вторичной (дислокационной) невроло гической симптоматики, отсутствие или мягкая выраженность тех или иных первичных полушарных и краниобазальных симптомов (двигательные нарушения не достигают степени пареза).
При квалификации состояния как удовлетворительное допустимо учитывать наряду с объективными показателями и жалобы пострадавшего.
Угроза для жизни (при адекватном лечении) отсутствует; прогноз восстановления трудоспособности обычно хороший.
Состояние средней тяжести: сознание ясное или умеренное оглушение; витальные функции не нарушены (возможна лишь брадикардия); очаговые симптомы полушарные и краниобазальные (двигательные нарушения могут достигать степени пареза; моно- или гемипарезы конечностей; парезы отдельных черепно-мозговых нервов; сенсорная или моторная афазия); могут наблюдаться единичные мягко выраженные стволовые симптомы (спонтанный нистагм). Для констатации состояния средней степени тяжести достаточно иметь указанные нарушения хотя бы по одному из параметров, например выявление умеренного оглушения для определения состояния больного как средней тяжести. Угроза для жизни (при адекватном лечении) незначительна; прогноз для восстановления трудоспособности чаще благоприятный.
Тяжелое состояние: сознание — глубокое оглушение или сопор; витальные функции нарушены умеренно по 1—2 показателям; очаговые симптомы; стволовые — умеренно выраженные (анизокория, легкое ограничение взора вверх, спонтанный нистагм и др.); могут быть грубые выраженные полушарные и краниобазальные симптомы раздражения (эпилептические припадки) и выпадения (двигательные нарушения могут достигать степени плегии). Для констатации тяжелого состояния больного допустимо иметь
553
указанные нарушения хотя бы по одному из параметров. Угроза для жизни значительная; во многом зависит от длительности тяжелого состояния. Прогноз восстановления трудоспособности порой малоблагоприятный.
Крайне тяжелое состояние: сознание — умеренная или глубокая кома; витальные функции — грубо нарушены одновременно по нескольким параметрам; очаговые симптомы — стволовые выражены четко, чаще тентори-ального уровня (парез взора вверх, выраженная анизокория, дивергенция глаз по вертикали или по горизонтали, тонический спонтанный нистагм, ослабление реакции зрачков на свет, двусторонние патологические знаки, децеребрационная ригидность); полушарные и краниобазальные грубо выражены (вплоть до двусторонних и множественных парезов). Для констатации крайне тяжелого состояния больного необходимо иметь выраженные нарушения по всем параметрам, причем по одному из них — обязательно предельные. Угроза для жизни максимальная, во многом зависит от длительности крайне тяжелого состояния. Прогноз восстановления трудоспособности чаще неблагоприятный.
Терминальное состояние: сознание — запредельная кома; витальные функции критически нарушены; очаговые симптомы (стволовые — предельный двусторонний мидриаз; полушарные и краниобазальные обычно перекрыты общемозговыми и стволовыми нарушениями). Прогноз: выживание практически невозможно.
К основным опасностям травм головы, представляющим угрозу жизни пострадавших, относят гипертензионные и дислокационные синдромы, посттравматическое нарушение мозгового кровообращения. Они являются одной из основных причин летальных исходов.
Внутричерепное давление — сложное понятие, но в клинической практике его обычно условно идентифицируют с ликворным. В норме уровень внутричерепного давления в основном определяется соотношением секреции, циркуляции и абсорбции ликвора; внутричерепной циркуляцией крови.
• Посттравматический синдром внутричерепной гипертензии чаще всего является следствием: 1) появления дополнительного внутричерепного объ емного образования — гематомы; 2) прогрессирующего отека головного мозга (регионарный или диффузный), превращающегося из саногенетиче- ского фактора в повреждающий; 3) «гиперемии» или «набухания» мозга вследствие сочетания гиперперфузии и венозного полнокровия в остром периоде тяжелой черепно-мозговой травмы; 4) гиперсекреции ликвора; 5) окклюзионной гидроцефалии.
Внутричерепная гипертензия приводит к нарушению регуляции мозгового кровообращения вследствие прогрессивного снижения перфузионного давления (разницы между средним артериальным и средним внутричерепным). Уровень перфузионного давления менее 30 мм рт.ст. является критическим, ниже которого происходит срыв ауторегуляции мозгового кровообращения, после чего наступает тотальный ишемический инфаркт мозга и его смерть.
Определение уровня внутричерепной гипертензии сопряжено с рядом объективных трудностей. В последние годы интенсивно развиваются методики регистрации и мониторирования давления в эпидуральном, субду-ральном пространствах, паренхимы мозга, вентрикулярного ликвора.
При формировании объемных патологических образований в полости черепа (гематома) развиваются явления дистензии.
• Дислокационный синдром — комплекс патофизиологических и пато- морфологических процессов, сопровождающихся клиническими признака-
554
ми, обусловленными смещением полушарий большого мозга с вторичным сдавлением его стволовых отделов. Элементом ее картины является смещение участков мозга по отношению друг к другу и выростам твердой мозговой оболочки.
В патогенезе черепно-мозговой травмы одним из ведущих факторов является нарушение мозгового кровообращения. В остром периоде травмы отмечается отчетливое уменьшение кровенаполнения ткани мозга. В терминальной фазе травматической болезни головного мозга у ряда пострадавших на фоне проводимых реанимационных мероприятий, включающих ИВЛ, поддержание гемодинамики, может развиваться специфический вариант нарушения мозгового кровообращения вследствие не совместимого с жизнью снижения перфузионного давления (ниже 20 мм рт.ст.) — прекращение мозгового кровообращения.
Оценка функционального состояния мозгового кровообращения у пострадавших с черепно-мозговой травмой проводится с использованием различных инструментальных методов регистрации параметров системы мозговой гемодинамики, но оптимальной в настоящее время является транскраниальная допплерография.
Комплекс лечебных воздействий, направленных на стабилизацию витальных функций, носит общий характер и в целом предпринимается профилактически при любых патологических процессах, сопровождающихся отеком головного мозга. В него входят:
нормализация внешнего дыхания (поддержание свободной проходимости дыхательных путей, достаточной оксигенации артериальной крови, нормо- или легкой гипокапнии, предупреждение резких метаболических сдвигов);
оптимизация уровня системного АД, показателем чего является адекватная перфузия мозга; восстановление сердечного ритма;
облегчение венозного оттока от полости черепа путем придания сред-нефизиологического положения шейному отделу позвоночника и голове, приподнятое (15°) положение верхней половины тела.
Мероприятия по снижению внутричерепного давления включают как физические (умеренная гипервентиляция, краниоцеребральная гипотермия, гипербарическая оксигенация), так и медикаментозные воздействия. Среди лекарственных препаратов выделяют средства, непосредственно снижающие внутричерепное давление (осмотические диуретики, салуретики, кор-тикостероидные гормоны) и препараты, использующиеся в качестве дополнительных (антигипоксанты, ноотропы, барбитураты, белковые растворы).
При безуспешности консервативных мероприятий, нарастающих неврологических нарушениях, угнетении витальных функций в ряде случаев проводят экстренное оперативное вмешательство, направленное на снижение внутричерепного давления: декомпрессивную трепанацию черепа (по Ку-шингу) и установку вентрикулярного дренажа. Следует учитывать, что оба варианта чаще всего относятся к «операциям отчаяния», предпринимаемым в фазе декомпенсации патологического процесса, и эффективность их вследствие этого невысока.
Для лечения развившегося дислокационного синдрома предпринимают комплекс консервативных и хирургических мероприятий, которые органически включают терапию внутричерепной гипертензии. Из специфических мер следует отметить реклинацию, заключающуюся в экстренном введении в люмбосакральный отдел субарахноидального пространства 50—100 мл 0,85 % раствора хлорида натрия. Эта мера способствует временной стаби-
555
лизации витальных функций, дает возможность осуществить оперативное вмешательство на основном патологическом очаге. Основным лечебным пособием при появлении признаков вклинения мозга должно быть экстренное оперативное вмешательство, направленное на радикальное устранение причины сдавления мозга, дополненное наружной декомпрессией, реклинацией, дренированием желудочковой системы.
Профилактика и лечение нарушений мозгового кровообращения включают методы предотвращения нарушений газообмена, купирования внутричерепной гипертензии и отека мозга. Тиобарбитураты, оксибутират натрия, применяемые для снижения внутричерепного давления, способствуют восстановлению адекватного соотношения между кровотоком и метаболизмом. Широко применяется ИВЛ в режиме гипервентиляции, способствующем уменьшению внутричерепного объема крови, снижению внутричерепного давления и восстановлению нарушений ауторегуляции мозгового кровотока. Нормализации нарушенного мозгового кровотока способствуют препараты, улучшающие реологические свойства крови и коллатеральное кровообращение.
Первая медицинская помощь при травме головы. Основная задача при оказании первой медицинской помощи пострадавшим с черепно-мозговой травмой на догоспитальном и госпитальном этапах — профилактика развития артериальной гипотензии, гиповентиляции, гипоксии, гиперкапнии. При наличии дыхательной аппаратуры следует ориентироваться на вспомогательную вентиляцию легких.
Перед врачом, оказывающим первую медицинскую помощь при повреждениях черепа и головного мозга, на догоспитальном этапе стоят следующие задачи:
выявление причин жизнеопасных нарушений и немедленное устранение их;
наложение асептической повязки на рану;
при возникновении рвоты, носового кровотечения, особенно у пострадавших с нарушениями сознания, необходимо предупредить попадание содержимого полости рта и носа в дыхательные пути;
пострадавшего укладывают на бок, осуществляя в таком положении вынос с места травмы и последующую транспортировку;
не следует вводить этим пострадавшим наркотические анальгетики.
