
- •Бестереков у.Б., Болысбек а.А., Мылтыкбаев а.Ж.
- •Содержание
- •Введение
- •Цели и задачи практических занятий
- •Содержание практических занятий
- •Порядок для проведения занятий
- •Практические занятия № 1
- •Теоретические основы занятия
- •Практические занятия № 2
- •Теоретические основы занятия
- •Практическое занятие № 3
- •Теоретические основы занятия
- •Практические занятия № 4
- •Теоретические основы занятия
- •Практические занятия № 5
- •Теоретические основы занятия
- •Практическое занятие № 6
- •Теоретические основы занятия
- •Практическое занятие № 7
- •Теоретические основы занятия
- •Практическое занятие № 8
- •Теоретические основы занятия
- •Практическое занятие № 9
- •Теоретические основы занятия
- •Практическое занятие № 10
- •Методологические основы проведения занятия
Практическое занятие № 7
Тема: «Кинетика химических реакций. Скорость и константа скорости процесса»
Цель занятия – привить студентам навыки установления кинетических параметров процессов, протекающих в гомогенных и гетерогенных системах.
Теоретические основы занятия
Кинетикой химических реакций называется учение о скорости их протекания и зависимости ее от различных факторов.
Основной величиной химической кинетики является скорость химической реакции. За скорость химической реакции принимают величину, пропорциональную производной от количества реагирующих веществ по времени или производной от концентрации по времени:
![]() или
или
![]() (7.1)
(7.1)
где
![]() – скорость химической реакции;
– скорость химической реакции;
с – концентрация исходного вещества в момент времени t;
х – концентрация продукта реакции в момент времени t.
Знак
(–) – перед
выражением
![]() означает убыль концентрации реагирующего
вещества с течением реакции.
означает убыль концентрации реагирующего
вещества с течением реакции.
Знак ( + ) – перед
выражением
![]() означает увеличение продукта реакции
вещества с течением реакции
означает увеличение продукта реакции
вещества с течением реакции
Стехиометрическое уравнение реакции гомогенных процессов можно представить в виде:
![]() .
(7.2)
.
(7.2)
По закону действующих масс скорость реакции пропорциональна концентрации реагирующих веществ с учетом их стехиометрических коэффициентов
![]() (7.3)
(7.3)
где к – константа скорости реакции или удельная скорость реакции, т.е.
скорость, отнесенная к единице концентрации,
с1 – концентрация вещества A1 ,
с2 – концентрация вещества А2 .
С учетом выражения 7.1 можно записать:
![]() (7.4)
(7.4)
Уравнение (7.3), связывающее скорость реакции с концентрациями реагирующих веществ, называется кинетическим уравнением реакции.
В отличие от гомогенных процессов, гетерогенные процессы протекают на границе раздела фаз (т.к. реагирующие вещества находятся в разных фазах) и скорость гетерогенной реакции измеряется количеством вещества, реагирующего на единице поверхности раздела фаз в единицу времени.
Любая гетерогенная реакция протекает в несколько стадий.
 Так, например,
при реакции: тв. + газI
газI
1 газI
диффундирует из газового потока к
поверхности твердого тела. Затем на
поверхности раздела происходит адсорбция
газаI
и химическое взаимодействие. Наконец,
газII
десорбируется и удаляется от реакционной
поверхности путем диффузии.
Так, например,
при реакции: тв. + газI
газI
1 газI
диффундирует из газового потока к
поверхности твердого тела. Затем на
поверхности раздела происходит адсорбция
газаI
и химическое взаимодействие. Наконец,
газII
десорбируется и удаляется от реакционной
поверхности путем диффузии.
Наблюдаемая скорость реакции определяется, с одной стороны, скоростью взаимодействия веществ на поверхности их соприкосновения, и с другой стороны, скоростью диффузионных процессов.
В стационарном состоянии скорость реакции должна быть равна количеству вещества, доставляемого в единицу времени к единице поверхности путем диффузии, т.е.:
![]() (7.5)
(7.5)
где к - константа скорости реакции;
С - концентрация газа-реагента вблизи реакционной поверхности;
С0 - концентрация газа-реагента в ядре газового потока;
β - константа скорости диффузии;
п - порядок реакции.
Если n = 1, то наблюдаемая скорость реакции из (VI. 1) будет:
![]() (7.6)
(7.6)
или
![]() (7.7)
(7.7)
г де
де![]() -
эффективная
константа скорости.
-
эффективная
константа скорости.
Если к
» β,
то в знаменателе β
пренебрегаем
![]() (7.8)
(7.8)
и суммарная скорость процесса определяется только скоростью диффузии. В таком случае говорят, что реакция протекает в диффузионной области.
Если к
«
β
, то пренебрегаем
в знаменателе уравнения
![]()
тогда
![]() (7.9)
(7.9)
Суммарная скорость определяется только истинной скоростью химического взаимодействия, и реакция протекает в кинетической области. В промежутке между диффузионной и кинетической областями лежит переходная область, где
![]() (7.10)
(7.10)
Константа скорости диффузии β зависит от многих факторов:
1) от формы и размеров твердого тела, d;
2) скорости газового потока и его характера, w;
3) коэффициента диффузии газа-реагента, D;
4) вязкости η и плотности среды ρ, т.е.:
![]() (7.11)
(7.11)
Вид функции (7.11) только в простейших случаях может быть найден путем аналитического расчета. Задача облегчается, если на основании известных данных найти зависимость между безразмерными величинами - так называемыми критериями подобия:
1) критерий Нуссельта:
![]() ;
(7.12)
;
(7.12)
2) критерий Рейнольдса:
![]() ;
(7.13)
;
(7.13)
где v
- кинематическая вязкость, равная
отношению
![]() ;
;
3) критерий Прандтля:
![]() ;
(7.14)
;
(7.14)
Растворение – гетерогенный процесс, протекающий между твердыми веществами и жидкостью и сопровождающийся переходом этого вещества в раствор.
При растворении твердых тел в растворителях большой интерес представляет определение скорости перехода частиц с поверхности твердого тела в раствор. Здесь имеет место диффузионный перенос частиц твердого вещества в растворитель. Обычно имеют место внешняя диффузия и внутренняя диффузия. Поэтому процесс растворения в простейшем случае будет состоять из 3-х стадий:
1) подвод реагирующих веществ из раствора к поверхности радела;
2) химическая реакция – разрушение кристаллической решетки
твердого тела и переход его частиц из твердой фазы в раствор;
3) перенос растворенных продуктов реакции к поверхности твердого тела в объем раствора.
При этом внешний диффузионный перенос осуществляется двумя путями:
1) молекулярной диффузией (направленный поток вещества из области большей концентрации в область меньшей концентрации);
2) конвекции (за счет перемешивания жидкости).
Совокупность этих двух процессов носит название конвективной диффузии.
Из гидродинамики известно, что скорость жидкости, обтекающей твердую поверхность в непосредственной близости от нее, равна нулю, затем она постепенно возрастает, а за пределами пограничного слоя толщиной δD скорость потока всюду одинакова и имеет величину W.
Скорость диффузии растворителя через пограничный слой равна
![]() (7.15)
(7.15)
где ![]() градиент концентрации, моль/см4
градиент концентрации, моль/см4
или
![]() (7.16)
(7.16)
где ![]() -скорость процесса
(убыль концентрации С растворителя по
-скорость процесса
(убыль концентрации С растворителя по
времени т); |
С0 - концентрация растворителя в объеме раствора;
С - концентрация растворителя на поверхности раздела фаз F;
D - коэффициент диффузии;
δD - толщина диффузионного слоя. Это выражение можно использовать для расчета скорости диффузии реагентов к поверхности растворяющегося твердого тела через диффузионный слой толщиной δD.
Когда скорость химической реакции во много раз больше скорости диффузии реагентов, то концентрация С растворителя на поверхности намного меньше Со (т.к. реагент немедленно вступает в химическую реакцию), тогда
![]() (7.17)
(7.17)
т.е. С0 » С, поэтому концентрацией растворителя на поверхности твердого тела можно пренебречь).
Данное уравнение показывает, что
1) скорость процесса зависит от скорости движения жидкости относительно поверхности твердых частиц (т.е. от интенсивности перемешивания), т.к. δD = f(w), где w - скорость встряхивания.
2) скорость процесса находится в функциональной зависимости от концентрации растворителя.
3) скорость процесса мало зависит от температуры, т.к. Еактив. процесса диффузии невелика – 8-17 кДж/моль.
4) скорость растворения будет возрастать с увеличением поверхности твердого тела.
Это – основные признаки протекания процесс во внешнедиффузионной области. В условиях интенсивного перемешивания гидрохимического процесса внешнедиффузионный процесс фактически исключается.
В случае внешнедиффузионного процесса наблюдается линейная зависимость w от τ.
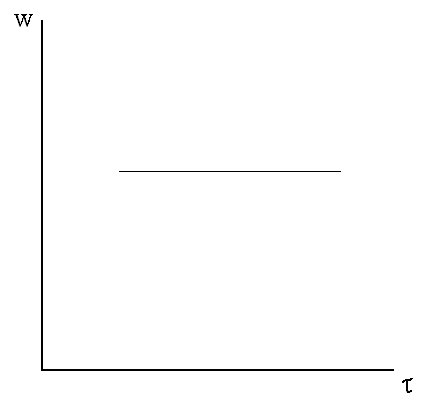
Рис. 7.1. Зависимость w от τ.
Внутренняя диффузия осуществляется через оболочку твердого продукта. В отдельных случаях она может оказаться лимитирующей стадией процесса. Чем плотнее оболочка, тем меньше скорость растворения (чем меньше пористость, тем сильнее затруднена диффузия через оболочку, тем меньше скорость внутренней массопередачи).
Если поверхность
и концентрация растворителя изменяются
незначительно (что справедливо при
небольших степенях извлечения), то
δпрод-![]() ;Спрод
-
;Спрод
-
![]() ,
т.е. количество
вещества, перешедшего из твердой фазы
в раствор, пропорционально корню
квадратному из продолжительности
растворения (τ).
,
т.е. количество
вещества, перешедшего из твердой фазы
в раствор, пропорционально корню
квадратному из продолжительности
растворения (τ).
Удельная скорость растворения вследствие роста диффузионного сопротивления уменьшается во времени и равна
![]() ,
(7.18)
,
(7.18)
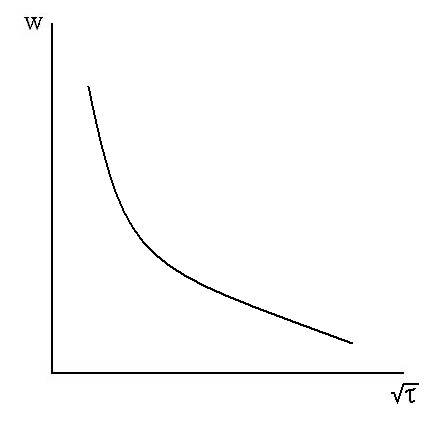
Рис. 7.2. Зависимость
w
от
![]() .
.
Основные признаки для внешней и внутренней диффузии одинаковы. Исключением является зависимость скорости процесса от продолжительности опыта для внутренней диффузии. Скорость процесса за счет внутренней диффузии со временем постоянно уменьшается. Кинетическая кривая в этом случае имеет пологий вид.
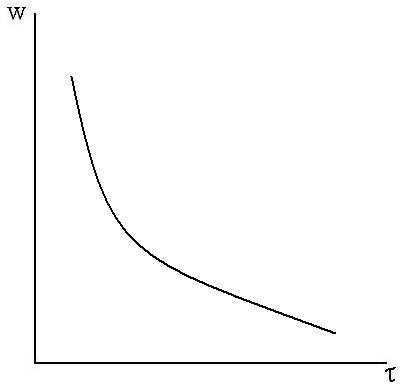
Рис.7.3. Зависимость w от τ.
Таким образом, вид кинетической кривой w от τ дает возможность определить, какая из диффузионных стадий является лимитирующей.
Третья стадия процесса - собственная химическая реакция подчиняется уравнению:
![]() (7.19)
(7.19)
где n - порядок реакции на границе раздела фаз;
w- удельная скорость;
F - удельная поверхность в момент времени т;
С - концентрация растворителя;
К - константа скорости;
dc - количество вещества, перешедшего из твердой фазы в раствор за время dτ.
Химическая реакция, в свою очередь, протекает через определенные стадии и, следовательно, имеет свой собственный механизм.
Рассмотрим случай, когда скорость химической реакции значительно меньше скорости диффузии, т.е. растворение, протекает в кинетической области. В этом случае концентрация растворителя на реакционной поверхности уравнивается с концентрацией в объеме раствора С.
![]() (7.20)
(7.20)
В этом случае, как и при диффузионном контроле, скорость растворения пропорциональна величине поверхности твердого тела F. Однако в данном случае зависимость скорости от концентрации реагента носит более сложный характер и определяется порядком протекающей химической реакции. Только в частном случае, когда n = 1, зависимость скорости от концентрации реагента имеет тот же вид, что и при диффузионном контроле. В данном уравнении δD не входит и, следовательно, скорость растворения в кинетической области не зависит от интенсивности перемешивания.
Интенсивность перемешивания может служить критерием определения области протекания реакции. Если при увеличении интенсивности перемешивания скорость растворения возрастает, то можно полагать, что процес| контролируется диффузионными явлениями (чаще всего подводом исходных реагентов).
Если же изменение интенсивности перемешивания заметно не влияет на скорость растворения, то можно полагать что процесс контролируется скоростью химической реакцией.
Для выяснения
природы лимитирующей стадии изучают
зависимость степени растворения
исследуемого твердого вещества от его
продолжительности при различных
скоростях перемешивания, определяют
начальные скорости растворения и строят
зависимость
![]() от
от![]() ,
гдеω
- число оборотов мешалки.
,
гдеω
- число оборотов мешалки.
1) Линейная
зависимость в координатах
![]() -
-
![]() в
левой части кривой, и ее прохождение
через нуль указывает на наличие
внешнедиффузионного процесса (рис.7.4).
в
левой части кривой, и ее прохождение
через нуль указывает на наличие
внешнедиффузионного процесса (рис.7.4).

Рис.7.4. Зависимость
![]() от
от![]()
2) Линейный участок, не проходящий через начало координат, соответствует переходной области (рис. 7.5)
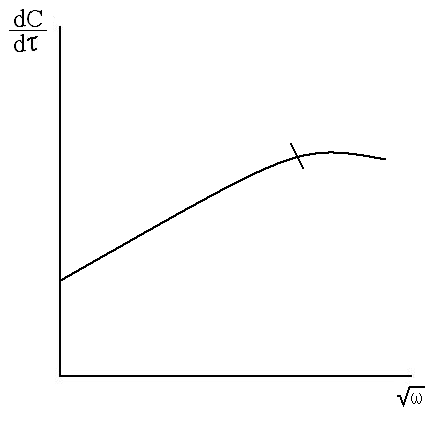
Рис.7.5. Зависимость
![]() от
от![]()
3) Если зависимость
![]() -
-
![]() проходит параллельности абсцисс (т.е.
не зависит от интенсивности перемешивания).
Это указывает на то, процесс протекает
в кинетическом режиме (рис. 7.6).
проходит параллельности абсцисс (т.е.
не зависит от интенсивности перемешивания).
Это указывает на то, процесс протекает
в кинетическом режиме (рис. 7.6).
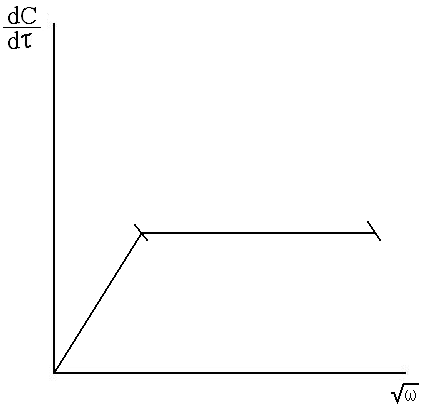
Рис. 7.6. Зависимость
![]() от
от![]()
После того, как выбрано оптимальное число оборотов, соответствующее кинетическому режиму, приступают к определению кинетических параметров (К - константа скорости, удельная скорость, энергия активации и порядок реакции).
Вторым критерием
протекания гетерогенного процесса в
диффузионной или кинетической области
может служить характер изменения
скорости процесса от температуры, т.к.
скорость химической реакции сильнее
зависит от температуры, чем скорость
диффузии. Поэтому для выяснения
лимитирующей стадии протекающих
процессов существенен вид аррениусовского
графика зависимости константы скорости
от температуры и его физическая
интерпретация. Можно проанализировать
физический смысл отклонений от линейности
в аррениусовских координатах
![]() .
Известно, что даже для элементарной
реакции любой аррениусовский параметр
(К0,
Е) зависит от температуры. Однако
отклонение зависимости
.
Известно, что даже для элементарной
реакции любой аррениусовский параметр
(К0,
Е) зависит от температуры. Однако
отклонение зависимости
![]() от линейности обычно нельзя определить
экспериментально, если не провести
измерения скорости в широком интервале
температур, т.к. в узком температурном
интервале отклонения обычно невелики.
от линейности обычно нельзя определить
экспериментально, если не провести
измерения скорости в широком интервале
температур, т.к. в узком температурном
интервале отклонения обычно невелики.
Нелинейный характер указывает на то, что определяемая константа скорости является сложной и относится более чем к одной стадии реакции.
Нелинейность
графика
![]() наблюдается также для определенных
типов реакций. При этом нелинейные
графики делятся на две категории:
наблюдается также для определенных
типов реакций. При этом нелинейные
графики делятся на две категории:
а) выпуклые (или спадающие) кривые, соответствующие изменениям в последовательности лимитирующих стадий реакций (рис. 7.7);
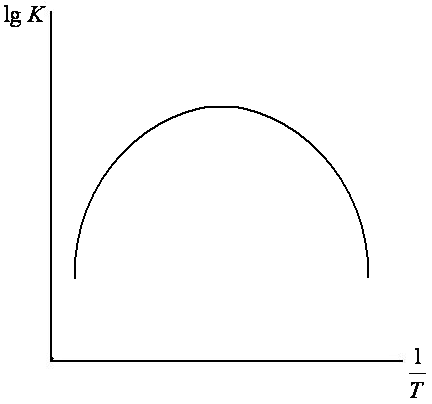
Рис. 7.7. Зависимость
![]()
б) вогнутые (или растущие) кривые, соответствующие параллельным реакциям с различной энергией активации (рис. 7.8).
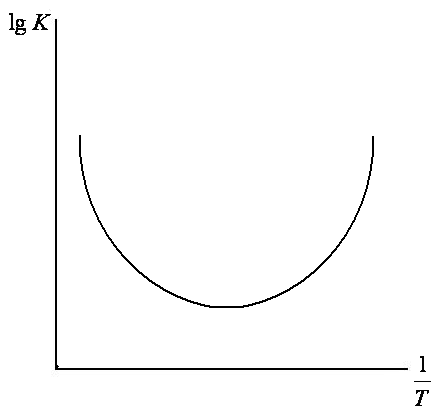
Рис. 7.8. Зависимость
![]()
Определение лимитирующей стадии для гетерогенного процесс, исходя из величины Е, во многих случаях может привести к принципиальным ошибкам (в определении значения К и ее зависимости от параметров системы, а также в понимании механизма процесса). В частности, определение Кэксп, проведенное достаточно тщательно, показывает, что Кэксп. есть функция начальных концентраций реагирующих веществ СА(0) и СВ(0) и времени τ. И не случайно, когда реакция протекает в сильно равновесных условиях, величина константы скорости изменяется даже в зависимости от продолжительности опыта и концентрации раствора.
Кэксп. - всегда является сложной характеристикой, зависящей от многих факторов (адсорбции, десорбции, изменения F - поверхности раздела фаз). Следовательно, нужно учитывать особенности состояния твердого тела, причем в этих условиях F, непрерывно обновляется, и это сопровождается не только изменением ее геометрических форм, но и энергетического состояния.
Обновленные участки поверхности часто обладают большой химической активностью, что неизбежно связано со снижением энергии активации химической реакции во времени.
Следует отметить, что величина кажущейся энергии активации может зависеть и от концентрации реагента (например, при более высокой концентрации Еа намного меньше, чем в разбавленных растворах), от τ и других факторов.
Отклонения от
закона Аррениуса для неравновесных
процессов вполне объяснимы, т.к. закон
Аррениуса ограничен и имеет смысл
только в том случае, если система может
считаться квазиравновесной. При этом
следует подчеркнуть, что теоретическое
обоснование уравнения Аррениуса
получено только для гомогенных реакций
в газовой фазе. Соответственно, если
при исследовании гомогенных реакций
зависимость
![]() не укладывается на прямую, то эксперимент
считают недостаточно точным (некорректным)
или при наличии излома в зависимости
не укладывается на прямую, то эксперимент
считают недостаточно точным (некорректным)
или при наличии излома в зависимости![]() делают вывод об изменении механизма
реакции.
делают вывод об изменении механизма
реакции.

Рис. 7.9. Зависимость
![]()
С другой стороны
в пределах небольшого ΔТ любой
аррениусовский график линеен. Поэтому
линейный график в координатах
![]() не обязательно указывает на элементарность
реакции.
не обязательно указывает на элементарность
реакции.
Примеры задач:
Задача 1. При каталитическом окислении фосфористой кислоты кислородом воздуха при 298°К и 313°К изменение концентрации H3РО3 моль/л. по времени выглядит следующим образом:
|
τ, мин Т, 0К |
3
|
5
|
7
|
10
|
15
|
|
298 |
13,43 |
11,58 |
8,32 |
7,07 |
1,07 |
|
313 |
10,05 |
9,48 |
5,78 |
3,64 |
0,87 |
Определить константу скорости, если исходная концентрация H3РО3 = 20 моль/л.
Задача 2. Каталитическое разложение перекиси водорода является реакцией первого порядка. Кинетика разложения изучалась путем титрования проб одинакового объема раствором KMnO4. Результаты титрования даны в таблице
|
t, мин |
V, мл KMnO4 |
|
0 |
22,8 |
|
10 |
13,8 |
|
20 |
8,25 |
Определить константу скорости реакции разложения перекиси водорода.
Задача 3. При каталитической очистке фосфорной кислоты от фосфорноватистой и фосфористой кислот кислородом воздуха изменение константы скорости реакции окисления от температуры выглядит следующим образом:
|
Т, 0К |
298 |
323 |
333 |
348 |
|
К, мин-1 H3PO2 |
0,19∙10-2 |
0,3∙10-2 |
0,39∙10-2 |
0,5∙10-2 |
|
К, мин-1 H3PO3 |
2,0∙10-2 |
3,6∙10-2 |
5,3∙10-2 |
12,0∙10-2 |
Расчитать предэкспоненциальные факторы константы скорости.
Задача 4. Образование фосгена, протекающее по уравнению
СО + Cl2 = COCl2
является реакцией второго порядка. Изменение концентарции реагирующих веществ со временем показоно в таблице
|
t, мин |
ССО = Cl2, моль/л |
t, мин |
ССО = Cl2, моль/л |
|
0 |
0,01873 |
24 |
0,01734 |
|
12 |
0,01794 |
30 |
0,01704 |
|
18 |
0,01764 |
42 |
0,01644 |
Вычислить константу скорости через 2 часа после начала реакции.
Задача 5. Зависимость константы скорости реакции
С + О2 = СО2
от температуры выражается уравнением lgK = 6,06 – (0,559·104)/T. Определить константу скорости диффузии при 11000С, если эффективная константа скорости реакции КХ при этой температуре равна 23,4.
Контрольные вопросы:
1. Понятие о кинетике физико-химического взаймодействия.
2. Суть учения о скорости процесса.
3. Вид кинетического уравнения реакции.
4. Понятие о константе скорости реакции.
5. Константа скорости диффузии.
6. Особенности химической кинетики гомогенных процессов.
7. Особенности химической кинетики гетерогенных процессов.
Задание для самостоятельной работы
Студент должен выполнить СРС по следующим темам:
1. Основные положения кинетики гомогенных процессов.
2. Основные положения кинетики гетерогенных процессов.
3. Закономерности внешней диффузии.
4. Закономерности внутренней диффузии.
5. Способы и методы оценки константы скорости процесса.
6. О влиянии внешних факторов на скорость процесса.
7. О влиянии внешних факторов на константу скорости процесса.
