
- •Бестереков у.Б., Болысбек а.А., Мылтыкбаев а.Ж.
- •Содержание
- •Введение
- •Цели и задачи практических занятий
- •Содержание практических занятий
- •Порядок для проведения занятий
- •Практические занятия № 1
- •Теоретические основы занятия
- •Практические занятия № 2
- •Теоретические основы занятия
- •Практическое занятие № 3
- •Теоретические основы занятия
- •Практические занятия № 4
- •Теоретические основы занятия
- •Практические занятия № 5
- •Теоретические основы занятия
- •Практическое занятие № 6
- •Теоретические основы занятия
- •Практическое занятие № 7
- •Теоретические основы занятия
- •Практическое занятие № 8
- •Теоретические основы занятия
- •Практическое занятие № 9
- •Теоретические основы занятия
- •Практическое занятие № 10
- •Методологические основы проведения занятия
Практические занятия № 2
Тема: «Тепловой эффект физико-химических превращений. Расчет теплового эффекта процессов»
Цель занятия: - приобретение знаний и умений выполнения расчетов теплового эффекта процессов.
Теоретические основы занятия
Закон Гесса.
Если процесс протекает термодинамически необратимо и при постоянном объеме или давлении, а получаемые продукты имеют ту же температуру, что и исходные вещества, то теплоту, выделяемую или поглощаемую при этом процессе, называют тепловым эффектом.
Закон Гесса гласит: тепловой эффект процесса не зависит от промежуточных стадий, а определяется лишь начальным и конечным состояниями системы. При этом подразумевается, что единственной работой, совершаемой системой, является работа против сил внешнего давления. Давление или объем в течение всего процесса остаются неизменными. Процесс термодинамически необратим.
Из закона Гесса можно сделать следующие выводы:
Теплота образования соединения из исходных веществ не зависит от способа, каким это соединение получено.
Теплота разложения соединения до тех же исходных веществ равна по значению и противоположна по знаку теплоте образования соединения из этих же веществ.
Если из двух разных систем в результате различных процессов образуются одинаковые продукты, то разность между значениями тепловых эффектов этих процессов равна теплоте перехода первой системы во вторую. Если же, наоборот, совершается переход из одинаковых начальных состояний к различным конечным состояниям, то разность между значениями тепловых эффектов процессов равна теплоте превращения одних конечных продуктов в другие. Отсюда вытекают два важных следствия, которые находят широкое применение:
Тепловой эффект реакции равен алгебраической сумме теплот образования реагентов из простых веществ, т. е. сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ:
ΔН = Σ(ΔНобр)прод - Σ(ΔНобр)исх.в (2.1)
2. Тепловой эффект реакции равен алгебраической сумме теплот сгорания реагентов до одинаковых продуктов, т. е. сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов реакции:
ΔН = Σ(ΔНсгор)исх.в - Σ(ΔНсгор)прод (2.2)
Зависимость теплового эффекта химической реакции от температуры (при постоянном давлении или объеме) определяется уравнением Кирхгофа в интегральной форме вида:
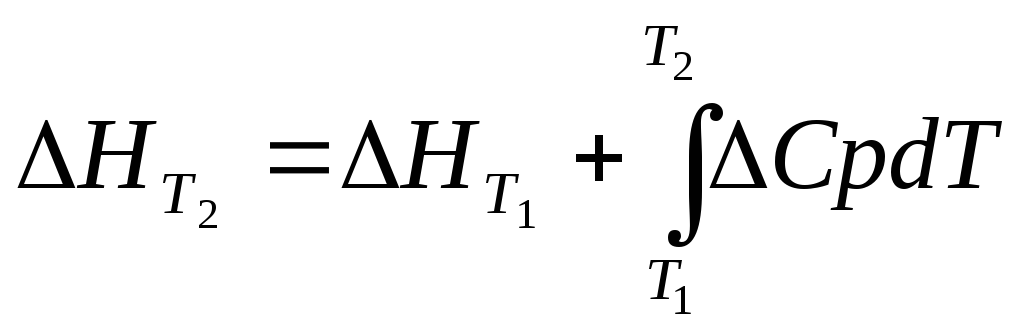 (2.3)
(2.3)
Уравнение дает возможность вычислить тепловые эффекты реакций при любой температуре Т, если известна зависимость теплоемкостей всех реагентов в рассматриваемом интервале температур и тепловой эффект реакции при какой-либо одной температуре.
После интегривования уравнения (2.5) получим зависимость теплового эффекта от температуры в общем виде:
![]() (2.4)
(2.4)
Где![]() - постоянная интегрирования, которая
обычно определяется пополученному
опытному тепловому эффекту при стандартной
температуре Т = 298К по соотношению вида
:
- постоянная интегрирования, которая
обычно определяется пополученному
опытному тепловому эффекту при стандартной
температуре Т = 298К по соотношению вида
:
![]() (2.5)
(2.5)
Уравнение (2.4) справедливо только для того интервала температур, для которого справедливо эмпирическое уравнение (1.4) для теплоемкостей веществ, участвующих в реакции.
Подставляя в интегральное уравнение (2.4) пределы интегрирования от Т1 до Т2 получим конечное расчетное выражение в виде:
![]() (2.6)
(2.6)
Где индекс 1 обычно соответствует стандартной температуре 298 К, а индекс 2 некоторой заданной конечной температуре Т2 в кельвинах.
Примеры задач:
Задача 1. Определить тепловой эффект реакции
2 NaCl
+ H2SO4
Na2SO4
+ 2HCl
NaCl
+ H2SO4
Na2SO4
+ 2HCl
при стандартных услолвиях для температуры 2980К на основании первого следствия из закона Гесса, пользуясь теплотами образования веществ, входящую в данную реакцию
Задача 2. Вывести температурную зависимость теплового эффекта реакции
N2(г) + O2(г) = 2NO(г)
если зависимость мольных теплоемкостей реагентов от температуры выражается уравнениями:
![]() = 29,58
+ 3,85·10-3
Т
–
0,59·105
Т-2Дж/моль·град
= 29,58
+ 3,85·10-3
Т
–
0,59·105
Т-2Дж/моль·град
![]() = 27,87
+ 4,27·10-3
Т
Дж/моль·град
= 27,87
+ 4,27·10-3
Т
Дж/моль·град
![]() = 31,46
+ 3,39·10-3
Т
–
3,77·105
Т-2Дж/моль·град
= 31,46
+ 3,39·10-3
Т
–
3,77·105
Т-2Дж/моль·град
Задача 3. Рассчитать тепловой эффект реакции
С(т) + Н2О(г)) = СО(г) + Н2(г)
при 10000К, если мольные теплоемкости участников реакции выражаются уравнениями:
![]() = 11,19 + 10,95·10-3
Т
– 4,89·105
Т-2Дж/моль·град
= 11,19 + 10,95·10-3
Т
– 4,89·105
Т-2Дж/моль·град
![]() = 28,41 + 4,10·10-3
Т
– 0,46·105
Т-2Дж/моль·град
= 28,41 + 4,10·10-3
Т
– 0,46·105
Т-2Дж/моль·град
![]() = 30,00 + 10,71·10-3
Т
+ 0,33·105
Т-2Дж/моль·град
= 30,00 + 10,71·10-3
Т
+ 0,33·105
Т-2Дж/моль·град
![]() = 27,28 + 3,26·10-3
Т
+ 0,502·105
Т-2Дж/моль·град
= 27,28 + 3,26·10-3
Т
+ 0,502·105
Т-2Дж/моль·град
Задача 4. Вычислить тепловой эффект реакции образования термической фосфорной кислоты при 3500К.
Задача 5.
Вычислить тепловой эффект реакции образования экстракционной фосфорной кислоты при 3700К.
Контрольные вопросы:
Теоретическая сущность первого начала термодинамики.
Термохимические закономерности.
Законы Лавуазье-Лапласа.
Законы Гесса.
Тепловой эффект процесса.
Влияние внешних факторов на тепловой эффект процесса.
Влияние температуры на тепловой эффект процесса.
Задание для самостоятельной работы
Студент должен выполнить СРС по следующим темам:
Расчет теплот образования веществ по энергиям кристаллических решеток, примеры расчетов.
Расчет теплот образования веществ по энергиям связей, примеры расчетов.
Расчет теплот образования веществ с использованием метода ионных инкрементов, примеры расчетов.
Расчет теплот образования веществ с использованием данных о произведении растворимости, примеры расчетов.
Расчет теплот образования веществ по методам Беркенгейма и Капустинского, примеры расчетов.
Расчет теплот образования веществ по методам Лотье-Карапетьянца, Резницкого , примеры расчетов.
Расчет теплот образования сложных соединений, примеры расчетов.
Расчет теплот образования соединений на основе термических и энергетических характеристик.
