
- •Бестереков у.Б., Болысбек а.А., Мылтыкбаев а.Ж.
- •Содержание
- •Введение
- •Цели и задачи практических занятий
- •Содержание практических занятий
- •Порядок для проведения занятий
- •Практические занятия № 1
- •Теоретические основы занятия
- •Практические занятия № 2
- •Теоретические основы занятия
- •Практическое занятие № 3
- •Теоретические основы занятия
- •Практические занятия № 4
- •Теоретические основы занятия
- •Практические занятия № 5
- •Теоретические основы занятия
- •Практическое занятие № 6
- •Теоретические основы занятия
- •Практическое занятие № 7
- •Теоретические основы занятия
- •Практическое занятие № 8
- •Теоретические основы занятия
- •Практическое занятие № 9
- •Теоретические основы занятия
- •Практическое занятие № 10
- •Методологические основы проведения занятия
Практическое занятие № 9
Тема: «Зависимость скорости реакции от температуры. Расчет энергий активации»
Цель занятия – привить студентам навыки и умения по определению кинетических параметров процессов и расчету энергии активации.
Теоретические основы занятия
Скорость химической реакции возрастает с увеличением температуры.
Зависимость скорости реакции от температуры по Вант-Гоффу выражается величиной температурного коэффициента, который определяют как возрастание скорости при увеличении температуры на 10°:
![]() (9.1)
(9.1)
где а(Т) – температурный коэффициент
![]() –скорость
реакции при температуре, Т°К
–скорость
реакции при температуре, Т°К
![]() –скорость реакции
при температуре (Т+10)0К
–скорость реакции
при температуре (Т+10)0К
Если а(Т) = 2 + 4, то говорят, что процесс протекает в кинетической области (т.е. скорость всего процесса лимитируется скоростью химической реакции).
Если а(Т) = 1,2 + 1,4, то говорят, что процесс протекает в диффузионной области (т.е. скорость всего процесса лимитирует перенос – диффузия реагентов).
Обычно для выражения зависимости скорости реакции от температуры используют уравнениеАррениуса вида:
![]() (9.2)
(9.2)
где К – константа скорости реакции;
К0 – предэкспоненциальный множитель, определяющий число соударений реагирующихся веществ;
Е – энергия активации - то избыточное количество энергии (по сравнению со средней величиной для данной реакции), которой должна обладать молекула в момент столкновения, чтобы быть способной к данному химическому взаимодействию;
R – универсальная газовая постоянная;
Т – температура,°К.
Поскольку концентрация реагирующих веществ не зависит от температуры, то такое же соотношение получается и непосредственно для скорости процесса.
![]()
или
![]() (9.3)
(9.3)
где
![]()
А и В – концентрация реагирующих веществ;
n1 и n2 – стехиометрические коэффициенты реагирующих веществ.
Иногда уравнение Аррениуса записывают в виде:
![]() (9.4)
(9.4)
где
![]() ;
;![]()
.Постоянные А
и В
в уравнении
Аррениуса могут быть определены,
если известны константы скорости данной
реакции при двух температурах
![]() и
и![]()
![]()

![]()
или
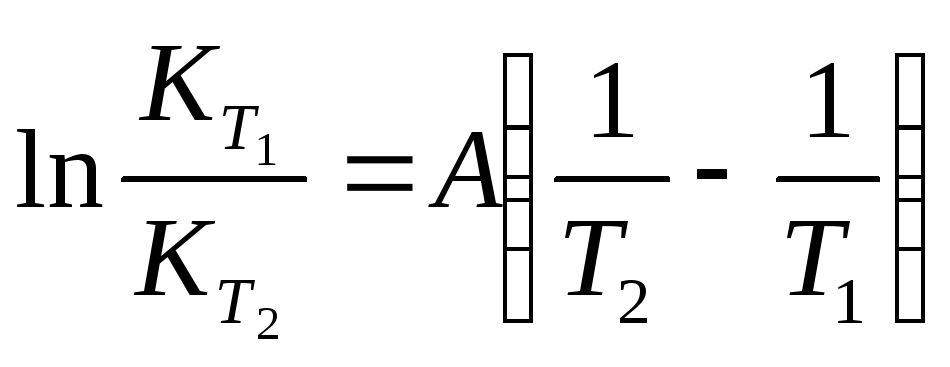 (9.5)
(9.5)
Определив А, можно определить Е-энергию активации по равенству вида: Е=- А * R
Обычно для
нахождения Е
измеряют
константу скорости не менее чем при
четырех температурах. При этом, если
для рассматриваемой реакции применимо
уравнение Аррениуса (простая реакция),
то lgK
должен
линейно зависеть от
![]() (рис. 9.1).
(рис. 9.1).
По наклону этой прямой определяют энергию активации по формуле:
![]()
где α – угол наклона прямой к оси абсцисс;
ξ – отношение масштаба по оси абсцисс к масштабу по оси ординат.
Для сложных реакций
уравнение Аррениуса оказывается
неприменимым. В этих случаях, тем не
менее, пользуются формулами (9.1) и (9.1)
для выражения зависимости скорости
реакции от температуры. При этом
величины К0,
![]() и Е
считаются
переменными, т.е. функциями температуры.
и Е
считаются
переменными, т.е. функциями температуры.
В этом случае
энергия активации находится по наклону
касательной к кривой, изображающей
зависимость
![]() в соответствующей точке (для каждой
температуры будет своя энергия
активации).
в соответствующей точке (для каждой
температуры будет своя энергия
активации).
Примеры задач:
Задача 1. Определить энергию активации реакции восстановления мышьяка фосфорноватистой кислотой в солянокислой среде. Константы скорости данной реакции от температуры при различных начальных концентрациях соляной кислоты представлены в таблице.
|
,0К |
К∙102, л/моль∙мин |
|
[HCl] = 2,0 | |
|
353 |
0,91 |
|
371 |
4,00 |
|
397 |
6,52 |
|
425 |
139 |
Задача 2. При каталитическом окислении фосфористой кислоты кислородом воздуха при 298°К и 313°К изменение концентрации H3РО3 моль/л. по времени выглядит следующим образом:
|
τ, мин Т, 0К |
3
|
5
|
7
|
10
|
15
|
|
298 |
13,43 |
11,58 |
8,32 |
7,07 |
1,07 |
|
313 |
10,05 |
9,48 |
5,78 |
3,64 |
0,87 |
Определить энергию активации реакции, если исходная концентрация H3РО3 = 20 моль/л.
Задача 3. При каталитической очистке фосфорной кислоты от фосфорноватистой и фосфористой кислот кислородом воздуха изменение константы скорости реакции окисления от температуры выглядит следующим образом:
|
Т, 0К |
298 |
323 |
333 |
348 |
|
К, мин-1 H3PO2 |
0,19∙10-2 |
0,3∙10-2 |
0,39∙10-2 |
0,5∙10-2 |
|
К, мин-1 H3PO3 |
2,0∙10-2 |
3,6∙10-2 |
5,3∙10-2 |
12,0∙10-2 |
Определить энергию активации реакции окисления фосфорноватистой и фосфористой кислот кислородом воздуха.
Задача 4. При каталитическом окислении фосфористой кислоты до фосфорной азотной кислотой в среде дистиллированной воды константа скорости реакции при Т = 323°К равна 0,47∙10-2 мин-1, а при Т = 348°К равна 2,32∙10-2. При проведении той же реакции в среде 75% H3PO4 константы скорости снизились и составили соответственно 0,29∙10-2 и 1,44∙10-2 мин-1.
Определить энергии активации реакции окисления азотной кислотой в среде дистиллированной воды и 75%-ной H3PO4.
Контрольные вопросы:
1. Вид зависимости скорости реакции от температуры по Вант-Гоффу.
2. Вид зависимости скорости реакции от температуры по Аррениусу
3. Энергия активации, суть понятия.
4. Истинная энергия активации, суть понятия.
5. Кажущаяся энергия активации, суть понятия.
Задание для самостоятельной работы
Студент должен приготовить СРС по следующим темам:
Способы выражения энергии активации.
Методы оценки энергии активации.
Влияние внешних факторов на энергию активации.
Закономерность влияния температуры на скорость реакции по Вант-Гоффу, примеры расчетов.
Закономерность влияния температуры на скорость реакции по Аррениусу, примеры расчетов.
Способы вычисления энергии активации, примеры расчетов.
