
- •Бестереков у.Б., Болысбек а.А., Мылтыкбаев а.Ж.
- •Содержание
- •Введение
- •Цели и задачи практических занятий
- •Содержание практических занятий
- •Порядок для проведения занятий
- •Практические занятия № 1
- •Теоретические основы занятия
- •Практические занятия № 2
- •Теоретические основы занятия
- •Практическое занятие № 3
- •Теоретические основы занятия
- •Практические занятия № 4
- •Теоретические основы занятия
- •Практические занятия № 5
- •Теоретические основы занятия
- •Практическое занятие № 6
- •Теоретические основы занятия
- •Практическое занятие № 7
- •Теоретические основы занятия
- •Практическое занятие № 8
- •Теоретические основы занятия
- •Практическое занятие № 9
- •Теоретические основы занятия
- •Практическое занятие № 10
- •Методологические основы проведения занятия
Практические занятия № 4
Тема: «Энтропия изобарных процессов, методы ее вычисления»
Цель занятия: – обучить студентов расчетам энтропий изобарных процессов.
Теоретические основы занятия
Данные по энтропии нужны для оценки направленности процесса взаимодействия.
В случае самопроизвольного процесса ΔS > 0. По знаку ΔS судят о направленности, а по абсолютному значению – об интенсивности процесса.
Полное значение
изменения энтропии ΔS
для химико-технологических процессов
включает изменение энтропии, вычисляемое
как алгебраическая сумма энтропий
компонентов реагирующей системы
![]() и изменение энтропии во внешней среде
(ΔSвн.ср.),
обусловленное поглащением или выделением
теплоты в результате химических
взаимодействий:
и изменение энтропии во внешней среде
(ΔSвн.ср.),
обусловленное поглащением или выделением
теплоты в результате химических
взаимодействий:
![]() (4.1)
(4.1)
причем
![]() (4.2)
(4.2)
где ![]() - тепловой эффект реакции при заданной
температуре
- тепловой эффект реакции при заданной
температуре
![]() определяется по
выражению вида:
определяется по
выражению вида:
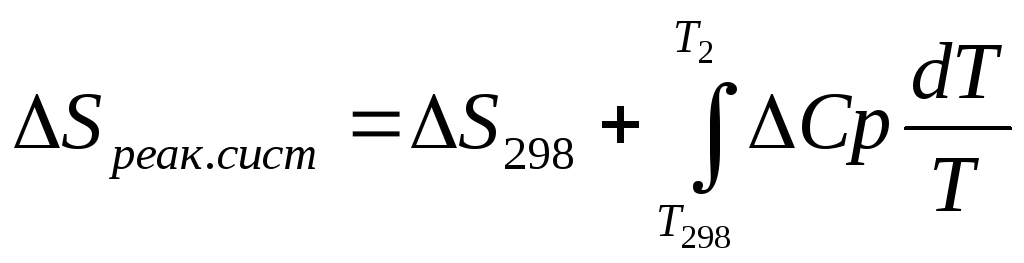 (4.3)
(4.3)
Интегрирурия выражение 4.3 получим расчетное соотношение в конечном виде:
![]() (4.4)
(4.4)
Здесь
![]() - изменение энтропии при стандартных
условиях определяется по выражению
вида:
- изменение энтропии при стандартных
условиях определяется по выражению
вида:
![]() (4.5)
(4.5)
Примеры задач:
Задача 1. Определить вид уравнения температурной зависимости энтропии окисления серы и вычислчить ее значение при 11000К.
Задача 2. Составить уравнение температурной зависимости энтропийных изменении реакции окисления фосфора и вычислить их значения при 13000К и 15000К.
Задача 3. Определить вид уравнения температурной зависимости энтропии для реакции образования азотной кислоты и вычислить ее значение при 3300К.
Задача 4. Вычислить изменение энтропии реакции электротермического разложения фосфорита при 17000К.
Задача 5. Вычислить энтропию реакции образования аммоса при 3700К.
Контрольные вопросы:
Теоретическая сущность второго начала термодинамики.
Теоретическая сущность третьего начала термодинамики, постулаты Планка.
О сути энтропийного показателя процессов.
Характерные изменения энтропии для процессов, протекающих в заданном направлении.
Характерные изменения энтропии для процессов, протекающих в обратном направлении.
Характерные изменения энтропии для процессов, находящихся в равновесии.
Связь энтропии с основными термодинамическими показателями и параметрами.
Влияние температуры на энтропию.
Методы расчета изменений энтропии.
Задание для самостоятельной работы:
Студент должен выполнить СРС по следующим темам:
Расчет стандартных энтропии веществ, примеры расчетов.
Расчет изменений энтропии в окружающей среде, примеры расчетов.
Расчет изменений энтропии процессов при стандарных условиях, примеры расчетов.
Расчет изменений энтропии процессов в эависимости от температуры, примеры расчетов.
Энтропийный анализ процессов, практические примеры.
Практические занятия № 5
Тема: «Свободная энергия Гиббса. Расчет изменений свободной энергии Гиббса физико-химических реакций»
Цель занятия: - обучить студентов расчетам свободной энергии Гиббса
