
- •Бестереков у.Б., Болысбек а.А., Мылтыкбаев а.Ж.
- •Содержание
- •Введение
- •Цели и задачи практических занятий
- •Содержание практических занятий
- •Порядок для проведения занятий
- •Практические занятия № 1
- •Теоретические основы занятия
- •Практические занятия № 2
- •Теоретические основы занятия
- •Практическое занятие № 3
- •Теоретические основы занятия
- •Практические занятия № 4
- •Теоретические основы занятия
- •Практические занятия № 5
- •Теоретические основы занятия
- •Практическое занятие № 6
- •Теоретические основы занятия
- •Практическое занятие № 7
- •Теоретические основы занятия
- •Практическое занятие № 8
- •Теоретические основы занятия
- •Практическое занятие № 9
- •Теоретические основы занятия
- •Практическое занятие № 10
- •Методологические основы проведения занятия
Практическое занятие № 6
Тема: «Константы равновесия физико-химических превращений. Расчет константы равновесия»
Цель занятия – обучить студентов расчетам константы равновесия
Теоретические основы занятия
Вычисление константы равновесия
Константа равновесия химической реакции, протекающей схематично по уравнению вида:
аА + bВ = gG +rR
где a, b, g, r – стехиометрические коэффициенты участвующих в реакции веществ A, B, G, R может быть вычислена по уравнениям:
KР
=![]()
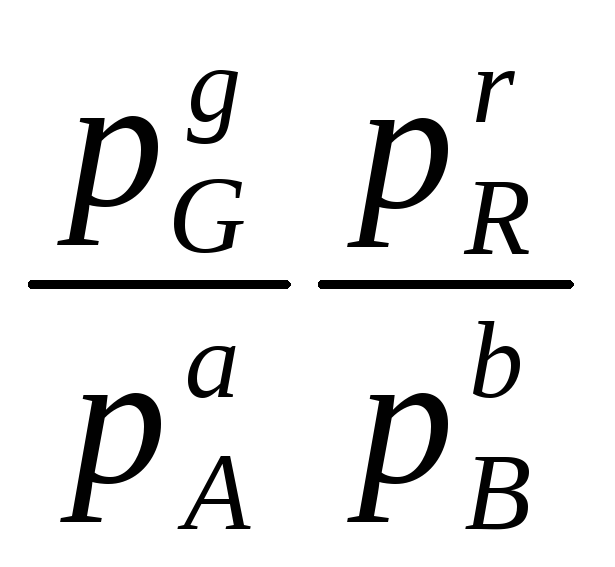 (6.1)
(6.1)
где
Кр![]() – константа химического равновесия;
рG,
рR,
рA,
рB
- равновесные парциальные давления
участников реакции:
– константа химического равновесия;
рG,
рR,
рA,
рB
- равновесные парциальные давления
участников реакции:
KС
=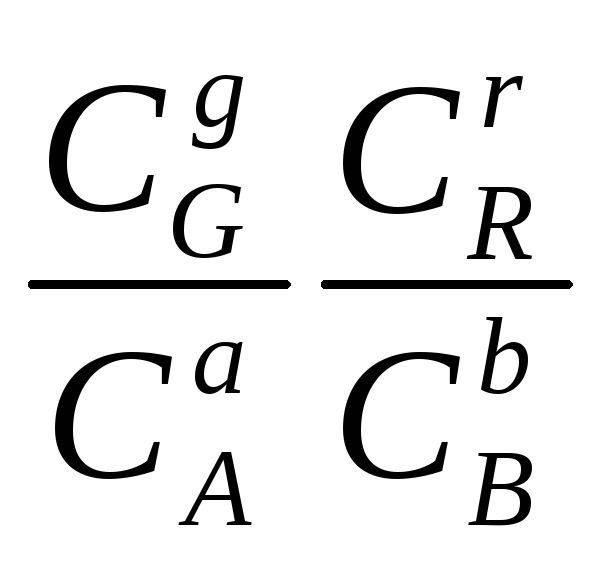 (6.2)
(6.2)
где
Кр![]() – константа химического равновесия;
СG,
СR,
СA,
СB
- равновесные концентрации участников
реакции:
– константа химического равновесия;
СG,
СR,
СA,
СB
- равновесные концентрации участников
реакции:
КN= (6.3)
(6.3)
где
Кр![]() – константа химического равновесия;NG,
NR,
NA,
NB
– равновесные мольные
доли участников
реакции:
– константа химического равновесия;NG,
NR,
NA,
NB
– равновесные мольные
доли участников
реакции:
Константы равновесия КР, КС, КN связаны соотношением:
КР
= КС(RT)![]() =
КNP
=
КNP![]() (6.4)
(6.4)
где
![]() = (g
+ r)
– (a
– b)
–
разность между стехиометрическими
коэффициентами конечных и начальных
веществ в соответствии с уравнением
реакции. Если
= (g
+ r)
– (a
– b)
–
разность между стехиометрическими
коэффициентами конечных и начальных
веществ в соответствии с уравнением
реакции. Если
![]() =0,
то
=0,
то
КР = КС = КN (6.5)
Для
гетерогенных реакций, протекающих с
участием газообразных веществ, константа
равновесия КР
выражается только отношением равновесных
парциальных давлений газообразных
реагентов. Давление насыщенных паров
твердых или жидких веществ, участвующих
в реакции, не зависит от количества
конденсированной фазы и при постоянной
температуре остается постоянным.
Например, для реакции аА(т)
+
bB(г)
![]() gG(г)
gG(г)
KР
=
![]() (6.6)
(6.6)
Константу рановесия химической реакции можно вычислить пользуясь стандартными изменениями изобарных потенциалов по уравнению
![]() (6.7)
(6.7)
где е – основание натурального логарифма, равное 2,71
Расчет константы равновесия можно выполнить по уравнениям изобары химической реакции.
Если
допустить в первом приближении, что
![]() ,
то тогда в интегральгой форме уравнение
имеет следующий вид:
,
то тогда в интегральгой форме уравнение
имеет следующий вид:
lgKp=
-![]() (6.8)
(6.8)
Интегрирование в пределах от Т1 до Т2 дает
lg![]() (6.9)
(6.9)
Уравнения (6.8) и (6.9) позволяют определить достаточно точно Кр2 при Т2 в небольшом интервале температур Т1 – Т2 если известны Кр1 при Т1 и тепловой эффект реакции; или вычислить тепловой эффект,если известны значения констант равновесия при двух температурах.
При
более точном интегрировании следует
учитывать, что
![]() .
Эту зависимость определяют по уравнению
Кирхгофа (2.5).
.
Эту зависимость определяют по уравнению
Кирхгофа (2.5).
Для расчета константы равновесия при любой температуре используют уравнение
lgКр,Т=
-![]() (6.10)
(6.10)
которое можно преобразовать к виду:
lgКр
= -![]() (6.11)
(6.11)
где М0, М1, М2, М-2 – определенные постоянные, которые вычислены и приведены в таблице, составленной М.И. Темкиным и Л.А.Шварцманом.
При
отсутствии данных для СР
= f(T)
иногда для приближенной оценки КР
делают допущение, что ![]() тогда уравнение (6.11) примет вид
тогда уравнение (6.11) примет вид![]()
lgКР=
-![]() (6.12)
(6.12)
Расчет константы равновесия по приближенному уравнению (6.12) не всегда дает удовлетворительные результаты.
Примеры задач:
Задача 1. Для реакции
N2 + 3H2 = 2NH3
при 8930К КР = 7,109·10-16, а при 9730К КР = 2,103·10-16 н/м2. Вычислить константу равновесия при 9330К.
Задача 2. Вычислить константу равновесия по методу Темкина – Шварцмана для реакции
СН4 + СО2 = 2СО + 2Н2О
в газовой фазе при 12000K.
Задача 3. Вычислить константу равновесия реакции
2SO2 + O2 = 2SO3 – 188,5кДж
при 10000К, если при 9000К КР = 2,3·10-7 (н/м2)-1.
Задача 4. Вычислить константу равновесия реакции образования аммиачной селитры из аммиака и азотной кислоты при температуре 4600К.
Задача 5. Для реакции сульфирования
2AgCl(т) + H2S(г) = Ag2S(т) +2HCl(г)
при 2300С КР = 1,662·105 н/м2, а при 4190С КР = 117,8·105 н/м2. Определить константу равновесия при 2800С.
Контрольные вопросы:
Константа химического равновесия, способы ее выражения.
Методы расчета константы химического равновесия.
Влияние внешних факторов на константу химического равновесия.
Зависимость константы химического равновесия от температуры.
Задание для самостоятельной работы
Студент должен приготовить СРС по следующим темам:
Расчет константы химического равновесия по Кирееву, примеры расчетов.
Расчет константы химического равновесия методом комбинирования уравнений химических реакций, примеры расчетов.
Расчет константы химического равновесия по методу Гиршвальда, Кнакке, Райнитцера, примеры расчетов.
Расчет константы химического равновесия по методу Владимирова, примеры расчетов.
Расчет константы химического равновесия по приближенному методу, примеры расчетов.
Расчет константы химического равновесия по абсолютным значениям энтропий, примеры расчетов.
