
- •Бестереков у.Б., Болысбек а.А., Мылтыкбаев а.Ж.
- •Содержание
- •Введение
- •Цели и задачи практических занятий
- •Содержание практических занятий
- •Порядок для проведения занятий
- •Практические занятия № 1
- •Теоретические основы занятия
- •Практические занятия № 2
- •Теоретические основы занятия
- •Практическое занятие № 3
- •Теоретические основы занятия
- •Практические занятия № 4
- •Теоретические основы занятия
- •Практические занятия № 5
- •Теоретические основы занятия
- •Практическое занятие № 6
- •Теоретические основы занятия
- •Практическое занятие № 7
- •Теоретические основы занятия
- •Практическое занятие № 8
- •Теоретические основы занятия
- •Практическое занятие № 9
- •Теоретические основы занятия
- •Практическое занятие № 10
- •Методологические основы проведения занятия
Содержание практических занятий
Практические занятия проводятся согласно силлабусу и включают нижеследующие темы:
Изменение теплоемкости и методы его вычисления;
Тепловой эффект физических и химических превращений. Расчет теплового эффекта процессов;
Тепловой баланс процессов;
Энтропия изобарных процессов, методы ее вычисления;
Свободная энергия Гиббса. Расчет изменений свободной энергии Гиббса физико-химических реакций;
Константа равновесия физико-химических превращений. Расчет констант равновесия;
Кинетика химических реакций. Скорость и константа скорости процесса;
Порядок и молекулярность реакции, методы их определения
Зависимость скорости реакции от температуры. Расчет энергий активации;
Термодинамический анализ параллельно и последовательно протекающих процессов, определение наиболее вероятных взаимодействий.
Порядок для проведения занятий
Требования для выполнения практических занятий:
Выдача студенческого задания;
Обсуждение цели и задачи практических занятий;
Проверка готовности студентов к занятиям: наличие учебников, справочной литературы, методических указаний к самостоятельной работе и практическим занятиям, знание теоретических основ по теме практического занятия (на основе лекционного материала);
Обсуждение алгоритма решения контрольных задач;
Обсуждение и сравнения результатов решения задач, выводы;
Оценка работы каждого студента согласно графику контроля знаний студента (силлабус) принимая во внимание участие студента в аудиторной работе;
Выдача задания на следующее занятие.
Практические занятия № 1
Тема: «Изменение теплоемкости и методы его вычисления»
Цель занятия – обучить студентов расчетам теплоемкости изобарных процессов.
Теоретические основы занятия
Теплоёмкость – количество теплоты, поглощаемой телом при нагревании на 1 градус. Отношение количества теплоты, поглощаемой телом при бесконечно малом изменении его температуры, к единице массы вещества (г, кг) называется удельной теплоёмкостью.
Теплоемкость, соответствующая бесконечному малому изменению температуры, т.е.
![]() (1.1)
(1.1)
называется истинной теплоемкостью.
Применяя уравнение (1.1) к практически наиболее важным процессам, получаем:
для
изобарного процесса в соответсвии с
уравнением
![]()
![]() (1.2)
(1.2)
Из уравнения (1.2) вытекает соотношение
 (1.3)
(1.3)
где QP – расход теплоты на изобарное нагревание 1 моль вещества от Т1 до Т2.
Следует обратить внимание на то, что эта величина обозначается
так же, как и тепловой эффект, но разумеется с ним совпадает по абсолютной величине и отличается по знаку, т.е. QP= -∆Н или -QP= ∆Н
Для неорганических веществ теплоемкость определяется по экспериментальному уравнению:
![]() (1.4)
(1.4)
где а, b,c/ - коэффициенты температурных зависимостей.
В
справочнике [9],
а также в книгах [6-7] приведены значения
![]() и коэффициенты температурных зависимостей
для многих веществ, используемых в
неорганической технологии. Для некоторых
приведены только значения
и коэффициенты температурных зависимостей
для многих веществ, используемых в
неорганической технологии. Для некоторых
приведены только значения![]() и не приводятся значение коэффициентова, b
и с.
Это указывает на то, что такое вещество
устойчиов только в пределах узкого
диапозона изменения температур и вместо
значения а
при расчете изменения теплоемкости
химической системы следует применять
его значения
и не приводятся значение коэффициентова, b
и с.
Это указывает на то, что такое вещество
устойчиов только в пределах узкого
диапозона изменения температур и вместо
значения а
при расчете изменения теплоемкости
химической системы следует применять
его значения
![]() .
.
Теплоемкость веществ, для которых отсутствуют данные в выше указанных справочниках и книгах, может быть рассчитана по правилу Дюлонга и Пти:
![]() (1.5)
(1.5)
где
![]() – атомная теплоемкость атомов;
– атомная теплоемкость атомов;
![]() –
число атомов каждого вида.
–
число атомов каждого вида.
Значение
![]() в основном составляют для твердых
веществ 25,94 – 26,77 Дж/(атом∙К) и для жидких
– 33,47 Дж/(атом∙К). Для некоторых элементов,
входящих в состав твердых или жидких
веществ, значения атомных теплоемкостей
отклоняются от этих величин (таблица
1).
в основном составляют для твердых
веществ 25,94 – 26,77 Дж/(атом∙К) и для жидких
– 33,47 Дж/(атом∙К). Для некоторых элементов,
входящих в состав твердых или жидких
веществ, значения атомных теплоемкостей
отклоняются от этих величин (таблица
1).
Таблица 1
Значение атомных теплоемкостей
|
№ |
Элемент |
Твердое тело |
Жидкое тело |
|
1 |
С |
7,53 |
11,71 |
|
2 |
Н |
9,62 |
17,99 |
|
3 |
N |
11,29 |
18,41 |
|
4 |
B |
11,71 |
19,66 |
|
5 |
Be |
15,89 |
- |
|
6 |
Si |
20,08 |
24,26 |
|
7 |
F |
20,92 |
29,29 |
|
8 |
S |
22,59 |
30,96 |
|
9 |
P |
23,01 |
29,29 |
|
10 |
O |
16,73 |
25,10 |
Теплоемкость твердых веществ при постоянном объеме (СV) в зависимости от температуры может быть вычислена также по Энштейну по формуле:
 (1.6)
(1.6)
Здесь
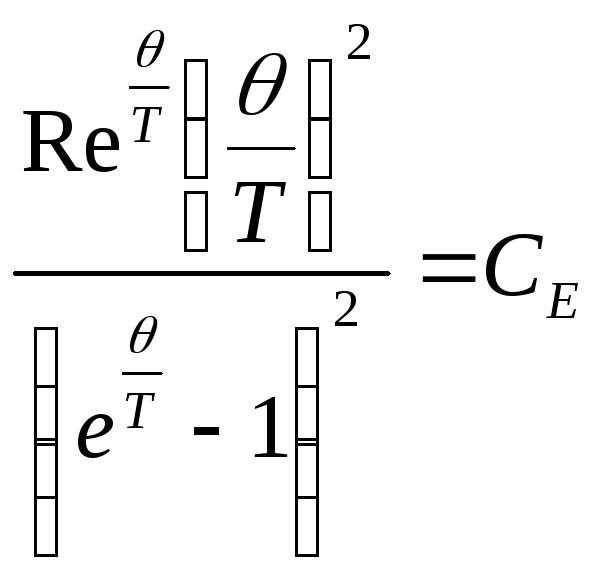 – теплоемкость по Энштейну.
– теплоемкость по Энштейну.
где θ – характеристическая температура, которая находится по выражению вида:
![]() (1.7)
(1.7)
здесь h и К – постоянные Планка и Больцмана;
ν – частота собственных невырожденных колебаний гармоничного осциллятора молекулы твердого вещества:
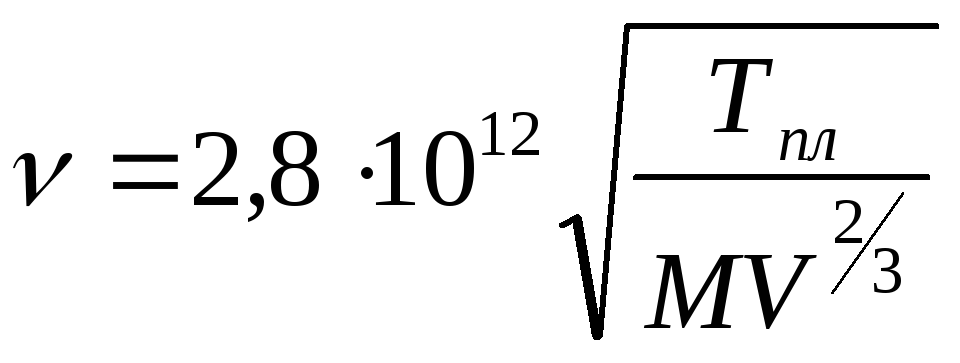 ,
1/сек (1.8)
,
1/сек (1.8)
где Тпл, М и V – температура плавления, молекулярный вес и мольный объем вещества вблизи температуры плавления.
По уравнению Тарасова СV может быть вычислена по соотношениям:
![]() (для одномерных
структур)
(для одномерных
структур)
![]() (для двухмерных
структур)
(для двухмерных
структур)
![]() (для трехмерных
кристаллических решеток)
(для трехмерных
кристаллических решеток)
Для твердых веществ теплоемкость при постоянном давлении связана с их теплоемкостью при постоянном объеме равенством вида:
![]() (1.9)
(1.9)
Для газообразных веществ СР представляет собой сумму поступительной (Спост), вращательной (Свр) и колебательной (Скол) составляющих теплоемкости:
![]() (1.10)
(1.10)
где
![]()
![]() (для простых и
линейных молекул),
(для простых и
линейных молекул),
![]() (для сложных молекул);
(для сложных молекул);![]() (для простых молекул),
(для простых молекул),![]() (для
сложных молекул).Сn
– число атомов в молекулах).
(для
сложных молекул).Сn
– число атомов в молекулах).
Для установления изменения теплоемкости по температуре в ходе протекания тех или иных физико-химических превращений веществ используется расчетное выражение вида:
ΔСр = Δа + ΔbT + Δc//Т2 (1.11)
где:
![]() ,
,
![]() ,
,
![]() ,
,
которые определяются с учетом стехиометрических коэфициентов n участников реакции.
Примеры задач:
Задача 1. Определить вид уравнения температурной зависимости теплоемкости серной кислоты и вычислчить ее теплоемкость при стандартных условиях.
Задача 2. Составить уравнение температурной зависимости теплоемкости реакции окисления аммиака и вычислить теплоемкость при 2980К и 10000К.
Задача 3. Вычислить изменения теплоемкости реакции:
 2Са5(PO4)3F
+ 7H2SO4
+ 3H2O
3Са(H2PO4)2
· H2O
+ 7CaSO4
+ 2HF
2Са5(PO4)3F
+ 7H2SO4
+ 3H2O
3Са(H2PO4)2
· H2O
+ 7CaSO4
+ 2HF
при температуре Т = 3430К, при постоянном давлении. Температурные коэфициенты реагентов приведены в нижеследующей таблице.
|
№ |
Компонент |
Коэффициенты уравнения Ср0=f(T) | ||
|
a |
b·103 |
c/·10-5 | ||
|
1 |
Са(H2PO4)2 · H2O |
258,82 |
- |
- |
|
2 |
CaSO4 |
70,21 |
98,74 |
- |
|
3 |
HF |
26,9 |
3,43 |
1,09 |
|
4 |
Са5(PO4)3F |
42,94 |
- |
- |
|
5 |
H2SO4 |
156,9 |
28,30 |
- 23,46 |
|
6 |
H2O |
39,02 |
76,64 |
11,96 |
Задача 4. Определить вид уравнения температурной зависимости теплоемкости реакции образования азотной кислоты и вычислить количество тепла, необходимого для образования десяти кмоль кислоты при 3200К.
Задача 5. Вычислить изменение теплоемкости реакции образования соляной кислоты при 8000К.
Контрольные вопросы:
Понятие о теплоемкости.
Истинная теплоемкость.
Удельная теплоемкость.
Атомная, молекулярная и мольная теплоемкость.
Единицы измерения теплоемкости. Соотношения между разными единицами измерения.
Влияние внешних факторов на теплоемкость.
Влияние температуры на теплоемкость.
Задание для самостоятельной работы
Студент должен выполнить СРС по следующим темам:
Современные методы расчета теплоемкости веществ.
Расчет теплоемкости веществ по правилам Дюлонга-Пти и Неймана-Коппа,
примеры расчетов.
Температурная зависимость теплоемкости веществ, примеры расчетов.
Расчет теплоемкости веществ по Эйнштейну и Дебаю, примеры расчетов.
Расчет теплоемкости веществ методом ионных инкрементов, примеры расчетов.
Расчет теплоемкости веществ по методам Ландия, Алдабергенова, Ивановой, примеры расчетов.
