
- •Бестереков у.Б., Болысбек а.А., Мылтыкбаев а.Ж.
- •Содержание
- •Введение
- •Цели и задачи практических занятий
- •Содержание практических занятий
- •Порядок для проведения занятий
- •Практические занятия № 1
- •Теоретические основы занятия
- •Практические занятия № 2
- •Теоретические основы занятия
- •Практическое занятие № 3
- •Теоретические основы занятия
- •Практические занятия № 4
- •Теоретические основы занятия
- •Практические занятия № 5
- •Теоретические основы занятия
- •Практическое занятие № 6
- •Теоретические основы занятия
- •Практическое занятие № 7
- •Теоретические основы занятия
- •Практическое занятие № 8
- •Теоретические основы занятия
- •Практическое занятие № 9
- •Теоретические основы занятия
- •Практическое занятие № 10
- •Методологические основы проведения занятия
Практическое занятие № 8
Тема: «Порядок и молекулярность реакции, методы их определения»
Цель занятия – обучить студентов определению порядка и молекулярности реакции.
Теоретические основы занятия
Реакции, протекающие в одну сторону классифицируются:
1) по порядку реакции;
2) по молекулярности реакции.
Порядком реакции (n) называется сумма показателей степеней при концентрациях реагирующих веществ в кинетическом уравнении реакции (8.3)
Т.е. п = а1+а2 если а1 = 1; а2 = 1, то n = 2.
Молекулярность реакции (М) – это число частиц (компонентов), участвующих в элементарном процессе. Так из (8.2) имеем
М = а1+а2 при а1 = а2 = 1 М = 2
Порядок и молекулярность совпадают только в случае простых реакций, протекающих в соответствии с уравнением реакции.
В подавляющем большинстве случаев молекулярность реакции и порядок ее не совпадают. Объясняется это тем, что стехиометрическое уравнение реакции, описывающее процесс в целом, не в состоянии отразить истинного механизма реакции, протекающего, как правило, в особенности у сложных реакций, через ряд последовательных стадий.
Реакции могут быть нулевого, первого, второго и третьего порядка, а также дробного порядка. Выше третьего порядка реакций не бывает, т.к. практически невозможно одновременное столкновение более трех реакционноспособных частичек (куда легче столкнуться двум или трем). Дробный порядок наблюдается у сложных реакций, протекающих через ряд промежуточных стадий, т.е. имеющих более одного элементарного процесса. В реакциях нулевого порядка скорость реакции постоянна во времени. Это наблюдается в таких гетерогенных реакциях, в которых скорость подвода реагирующего вещества во много раз больше скорости химического взаимодействия (т.е. в таких реакциях скорость не зависит от концентрации реагирующих веществ).
![]() (8.1)
(8.1)
По молекулярности реакции подразделяются на моно-, би- и тримолекулярные. Последние вследствие малой вероятности тройных соударений встречаются редко. Реакций дробной молекулярности быть не может.
Формальная кинетика рассматривает процесс, не интересуясь механизмом реакции, чисто количественно описывает результат всех стадий, всех превращений, результат всей реакции в целом. Поэтому конечной задачей формальной кинетики является составление уравнения для расчета константы скорости данной реакции, т.е. уравнения, позволяющего в любой момент времени рассчитать скорость реакции как функцию концентрации.
Чтобы найти зависимость между временем и концентрациями реагирующих веществ, необходимо, прежде всего, составить дифференциальное кинетическое уравнение.
Для составления кинетического уравнения необходимо экспериментально определить порядок реакции по отношению к каждому из реагирующих веществ.
Для этого определяют экспериментальную зависимость концентрации одного из реагирующих веществ от времени (кривую концентрация – время), после чего одним из известных способов вычисляют порядок реакции.
Реакции первого порядка. Константы скорости реакции I порядка К(1) не зависит от концентарции реагирующих веществ и определяется по равенству вида:
![]()
или
![]() (8.2)
(8.2)
где С0 – начальная концентрация вещества;
С – концентрация вещества через время t.
Размерность константы скорости I – порядка
![]() или (мин-1,
час-1).
или (мин-1,
час-1).
Через
время полупревращения (или период
полураспада) вещества
![]() константа скорости выражается следующим
образом:
константа скорости выражается следующим
образом:

или
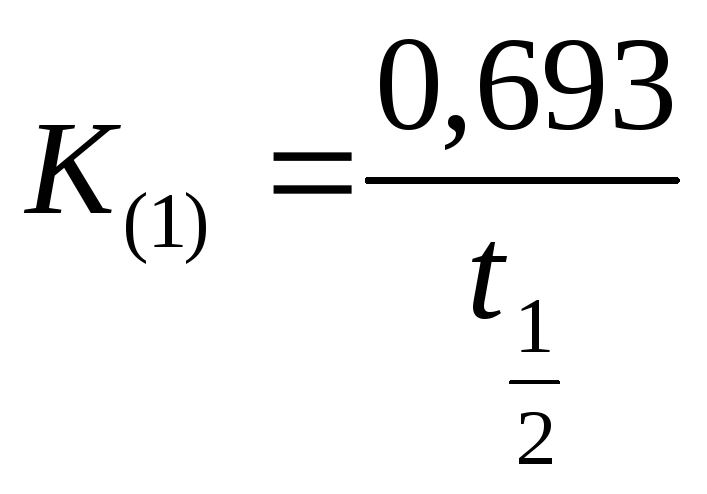 (8.3)
(8.3)
Реакции второго порядка. а) Если начальные концентрации веществ А и В равны а = b,то константа скорости II порядка К(2) может быть определена по выражению:
![]() (8.4)
(8.4)
Если выразить
![]() через период полупревращения вещества,
то есть
через период полупревращения вещества,
то есть![]() тогда:
тогда:
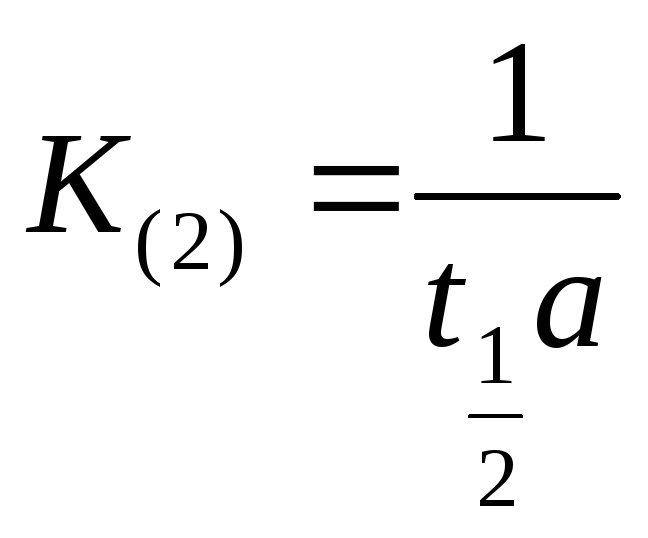 (8.5)
(8.5)
![]() (8.6)
(8.6)
Отсюда:
б) Если начальные
концентрации реагирующих веществ не
равны
![]() ,
тогда константа скорости реакцииII
порядка К(2)
определяется по равенству вида:
,
тогда константа скорости реакцииII
порядка К(2)
определяется по равенству вида:
![]() (8.7)
(8.7)
Размерность константы скорости второго порядка
![]() (сек-1,
моль-1,
литр)
(сек-1,
моль-1,
литр)
(если концентрация выражена в моль/л).
У реакции второго порядка величина костанты скорости зависит от выбора единиц, в которых выражается концентарция.
Реакция третьего порядка. Если а = b = c, то есть начальные концентрации реагирующих веществ равны, то константа скорости реакции III порядка может быть вычислена по выражению:
![]() (8.8)
(8.8)
Если выразим
![]() через период полупревращения реагирующих
веществ
через период полупревращения реагирующих
веществ![]() ,
тогда
,
тогда![]() :
:
и
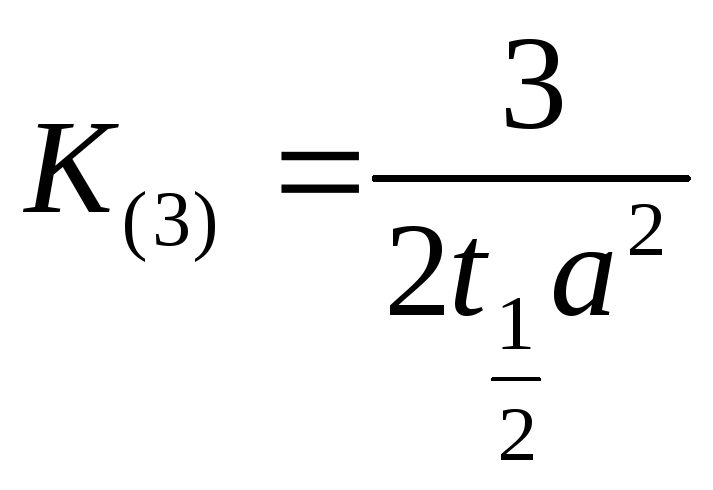
отсюда
![]() (8.9)
(8.9)
Размерность константы скорости третьего порядка
![]() (сек-1,
моль-1,
литр2)
(сек-1,
моль-1,
литр2)
Если начальные концентрации реагирующих веществ не равны, то:
![]() (8.10)
(8.10)
где
![]() ,
,![]() ,
,![]()
Методы определения порядка реакции
8.1 Метод Вант – Гоффа
Этот метод характеризуется тем, что начальные концентрации реагирующих веществ берутся одинаковыми.
Например: А + В = Х (продукт)
Если а – начальная концентрация вещества А,
b – начальная концентрация вещества B, то
a = b
Обозначим через
с1
и с2
концентрации этих веществ в различные
моменты времени (t1
и
t2)
от начала реакции, а
через
![]() и
и![]() – скорости
реакции, тогда:
– скорости
реакции, тогда:
![]() ;
;
![]()
Отношения этих скоростей равно
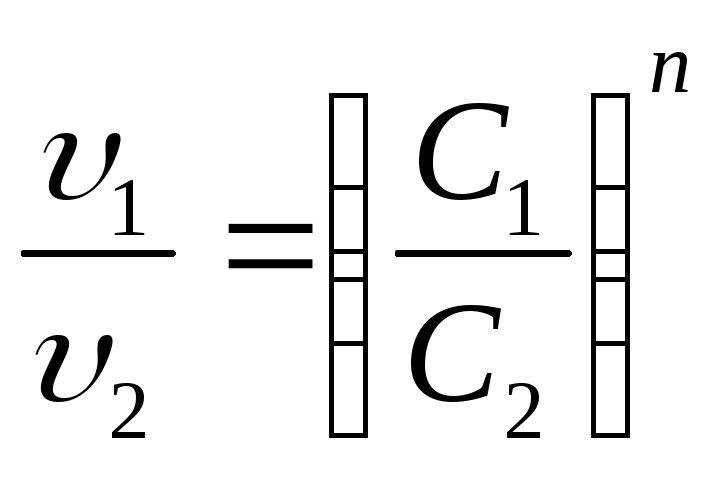 или
или![]()
Из этого уравнения определяем порядок реакции
![]() (8.11)
(8.11)
Значит для определения порядка реакции по методу Вант – Гоффа исходные концентрации реагирующих веществ берутся одинаковыми и через определенное время от начала реакции определяют концентрацию одного из реагирующих веществ и строят график в координатах С – t и методом графического дифференцирования определяют скорости реакции при любых двух значениях времени. Подученные данные подставляют в уравнение (8.11) и определяют порядок реакции п.
8.2 Метод подстановки экспериментальных данных в соответствующие уравнения
Согласно этого метода необходимо последовательно подставлять экспериментальные данные в соотношения, выведенные для реакций различных порядков (1, 2, 3 или нулевого порядка) и выбирать, какое из них выполняется (должно наблюдаться постоянство константы, полученной подстановкой опытных данных в соответствующее уравнение). Если опытные данные не удовлетворяют ни одному из этих уравнений, значит, реакция имеет более сложное, кинетическое уравнение (дробный порядок).
8.3 Метод графического дифференцирования
Если в реакции принимает участие одно исходное вещество, то скорость его расходования в реакции п – го порядка запишется в виде уравнения
![]()
Уравнение может быть непосредственно использовано для определения порядка реакции, для этого запишем его в виде
![]() (8.12)
(8.12)
Скорвсть реакции
может быть определена графическим
дифференцированием кинетической
кривой. Зависимость
![]() представляет
собой прямую линию, угловой коэффициент
наклона которой дает порядок реакции
(п).
представляет
собой прямую линию, угловой коэффициент
наклона которой дает порядок реакции
(п).
8.4 Определение времени полупревращения
Известно, что для
реакции первого порядка время
полупревращения вещества
![]() не зависит от начальной концентрации
реагирующих веществ
не зависит от начальной концентрации
реагирующих веществ
![]() (8.13)
(8.13)
Для реакции второго порядка время полупревращения обратно пропорционально начальной концентрации реагирующих веществ
![]() (8.14)
(8.14)
Для реакции третьего порядка время полупревращения обратно пропорционально квадрату начальной концентрации реагирующих веществ
![]() (8.15)
(8.15)
При соблюдении тех или иных условии можно сделать заключение о порядке реакции.
8.5 Графический метод определения порядка реакции
Порядок реакции можно определить, если построить графики, откладывая по одной оси различные функции от концентрации, а по другой время.
Если получается
прямая линия в координатах
![]() (или
(или![]() ),
то это значит, что реакция относится к
первому порядку.
),
то это значит, что реакция относится к
первому порядку.
Если получается
прямая линия в координатах
![]() ,
то это значит, что реакция относится
ко второму порядку.
,
то это значит, что реакция относится
ко второму порядку.
Если получается
прямая линия в координатах
![]() ,
то это реакция третьего порядка.
,
то это реакция третьего порядка.
8.6 Определение порядка реакции по методу Оствальда–Нойеса.
Метод характеризуется тем, что концентрации реагирующих веществ, кроме того вещества, порядок по которому определяют, берутся с большим избытком (в 10 и более раз по сравнению с теоретически необходимым по условию реакции). Таким образом, создают условия, при которых практически изменяется концентрация одного вещества, а остальные вещества практически не меняют свои концентрации (т.е. их изменениями можно пренебречь).
Если собираются определять порядок реакции по компоненту А, то концентрации компонентов В и С берут с избытком в десять и более раз по сравнению с стехиометрическим количеством.
![]()
где
![]()
Порядок реакции
по компоненту А
(п1)
определяют
одним из известных способов (методом
подстановки в соответствующее уравнение
графическим дифференцированием, методом
Вант-Гоффа и т.д.). Далее порядок реакции
по компоненту В(п2)
определяют
беря в большом избытке компоненты А
и С,
использюя
выражение
![]()
где
![]()
Порядок реакции
по компоненту С(п3)
определяют при большом избытке
компонентов А
и В из
уравнения
![]()
где
![]()
Общий порядок реакции определяют суммированием
![]()
Примеры задач:
Задача 1. При очистке фосфорной кислоты от недоокисленных соединений в качестве окислителя использовали перекись водорода. Определить порядок реакции по методу Вант-Гоффа, если начальная концентрация окислителя и фосфорноватистой кислоты равнялась 0,735 моль/л, а изменение концентрации Н3РО2 по времени от начала опыта составляла, в моль/л:
10 мин. – 0,56; 15 мин. – 0,495; 20 мин. – 0,425;
25мин. – 0,385; 30 мин. – 0,33.
Задача 2. Реакция восстановления соединения мышьяка до элементарного состояния фосфорноватистой кислотой протекал при Т = 3710К. Определить порядок реакции по As. Изменение концентрации [As (III)] по времени представлено в таблице.
Изменение концентрации As (III) по времени
|
t, мин. |
0 |
10 |
15 |
20 |
25 |
30 |
|
[As (III)] |
0,735 |
0,560 |
0,495 |
0,425 |
0,385 |
0,330 |
Задача 3. Определить порядок реакции восстановления As (III) фосфорноватистой кислотой в солянокислой среде (условие в примере 2) методом графического дифференцирования
Задача 4. Определить порядок реакции окисления гидрофосфит-иона в фосфит-ион с исользованием времени полупревращения, если константа скорости реакции при Т = 363°К равна 0,2, а исходные концентрации гипофосфит - иона равны 1,0; 2,0; 4,0 и 6,0 г-ион/л.
Задача 5. Определить графическим методом порядок реакции восстановления As (III) фосфорноватистой кислотой в солянокислой среде. Изменение концентрации [As (III)] по времени представлено в таблице.
Изменение концентрации As (III) по времени
|
t, мин. |
0 |
10 |
15 |
20 |
25 |
30 |
|
[As (III)] |
0,735 |
0,560 |
0,495 |
0,425 |
0,385 |
0,330 |
Контрольные вопросы:
1. Понятие о порядке реакции.
2. Понятие о молекулярности реакц .
3. Особенности реакции первого порядка.
4. Особенности реакции второго порядка.
5. Особенности реакции третьего порядка.
6. Особенности реакции нулевого и дробного порядков.
7. Методы определения порядка реакции.
Задание для самостоятельной работы
Студент должен выполнить СРС по следующим темам
Определение порядка реакции по методу Вант-Гоффа, примеры расчетов.
Определение порядка реакции методом подстановки экспериментальных данных в соответствующие уравнения, примеры расчетов.
Определение порядка реакции методом графического диффереренцирования, примеры расчетов.
Определение порядка реакции графическим методом, примеры расчетов.
Определение порядка реакции с использованием времени полупревращения, примеры расчетов.
Определение порядка реакции по методу Оствальда-Нойеса, примеры расчетов.
