
- •Бестереков у.Б., Болысбек а.А., Мылтыкбаев а.Ж.
- •Содержание
- •Введение
- •Цели и задачи практических занятий
- •Содержание практических занятий
- •Порядок для проведения занятий
- •Практические занятия № 1
- •Теоретические основы занятия
- •Практические занятия № 2
- •Теоретические основы занятия
- •Практическое занятие № 3
- •Теоретические основы занятия
- •Практические занятия № 4
- •Теоретические основы занятия
- •Практические занятия № 5
- •Теоретические основы занятия
- •Практическое занятие № 6
- •Теоретические основы занятия
- •Практическое занятие № 7
- •Теоретические основы занятия
- •Практическое занятие № 8
- •Теоретические основы занятия
- •Практическое занятие № 9
- •Теоретические основы занятия
- •Практическое занятие № 10
- •Методологические основы проведения занятия
Теоретические основы занятия
Вычислить значение
![]() можно с применением следующих методов:
можно с применением следующих методов:
При Т = 298К
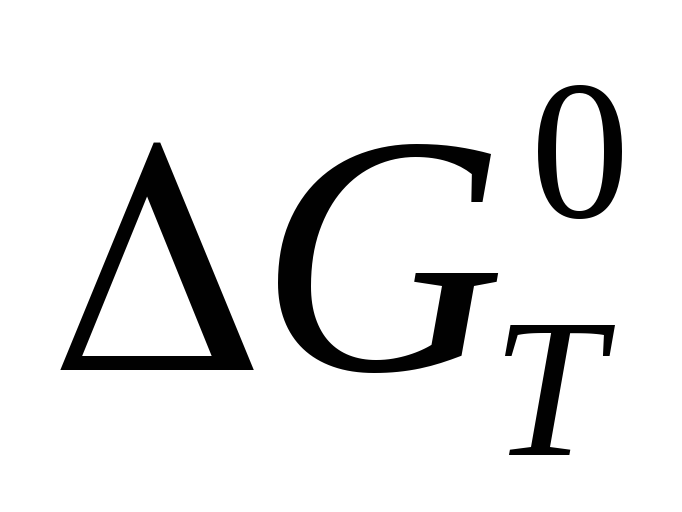 вычисляется на основе стандартных
табличных данных:
вычисляется на основе стандартных
табличных данных:
![]() (5.1)
(5.1)
При учете температурной зависимости теплоемкости (∆СР) для расчета
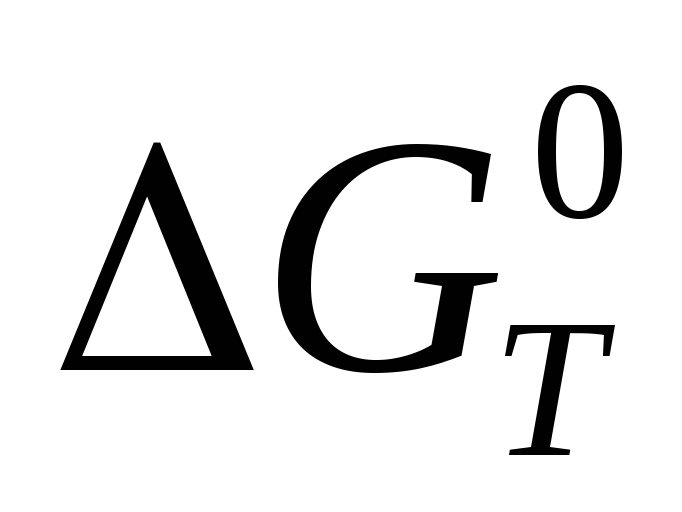 используют уравнение:
используют уравнение:
![]() (5.2)
(5.2)
Далее используя
вместо ![]() алгебраическую сумму средних теплоемкостей
алгебраическую сумму средних теплоемкостей
![]() в интервале Т – 298К,
в интервале Т – 298К,![]() находят
находят
![]() (5.3)
(5.3)
При наличии данных по теплоемкости компонентов реакции лишь для отдельных температур внутри интервала Т – 298К графическим интегрированием определяют значение
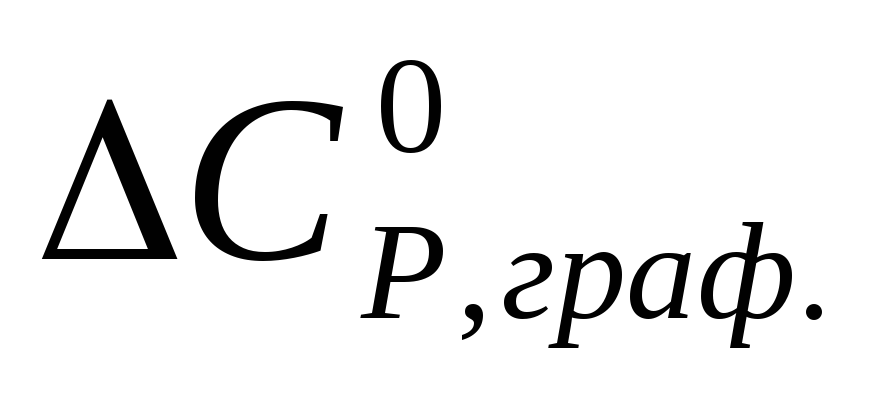 и
вычисляют
и
вычисляют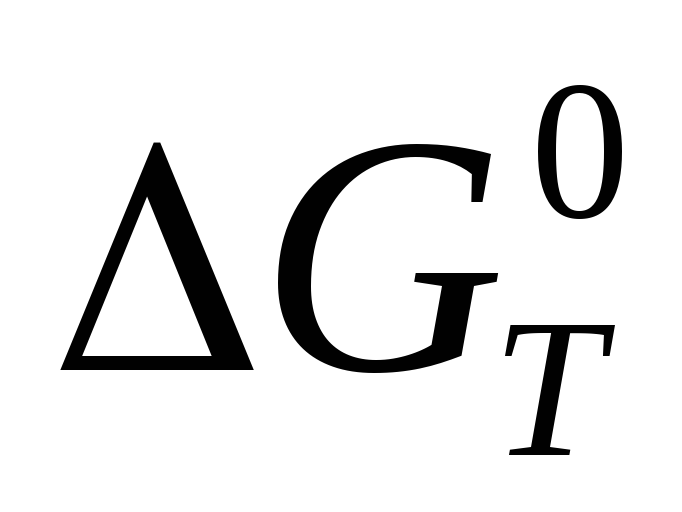 по уравнению:
по уравнению:
![]() (5.4)
(5.4)
Способом Тёмкина-Шварцмана [1,6], используя предворительно табулированные значения температурных параметров
 ,
, ,
,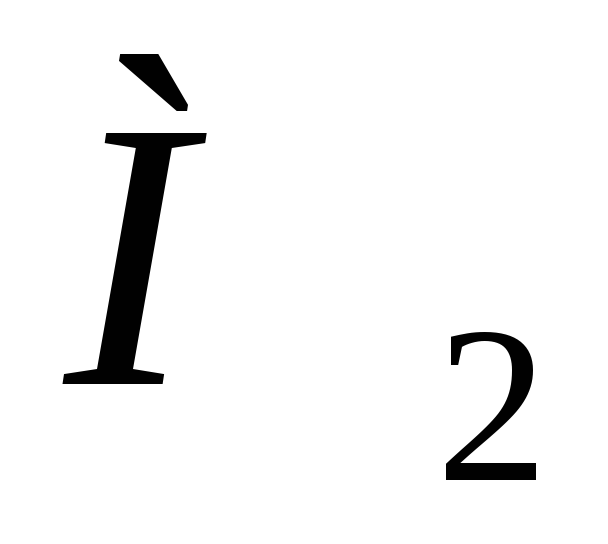 и
и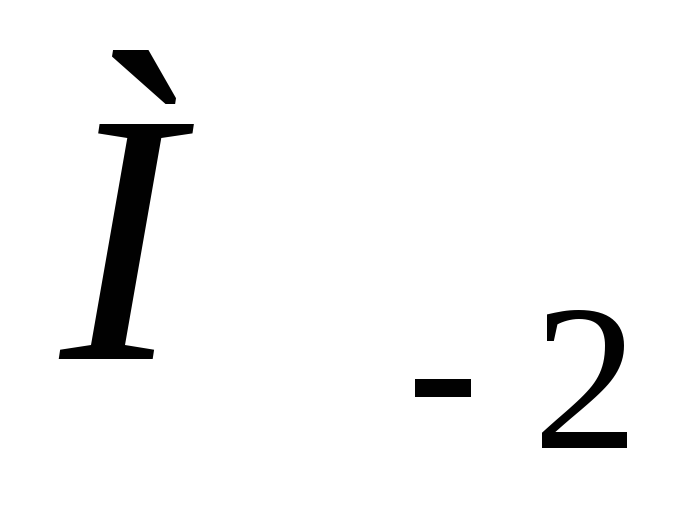 по уравнению:
по уравнению:
![]() (5.5)
(5.5)
где α, β, γ, γ/ - алгебраические суммы численных коэффициентов в уравнениях зависимости тепоемкости от температуры, рассчитываемые с учетом стехиометрических коэффициентов реакций, а Мо, М1, М2 и М-2 – составляющие, определяемые только величиной температуры.
Спосом Киреева, учитывая высокотемпературные составляющие энтальпии
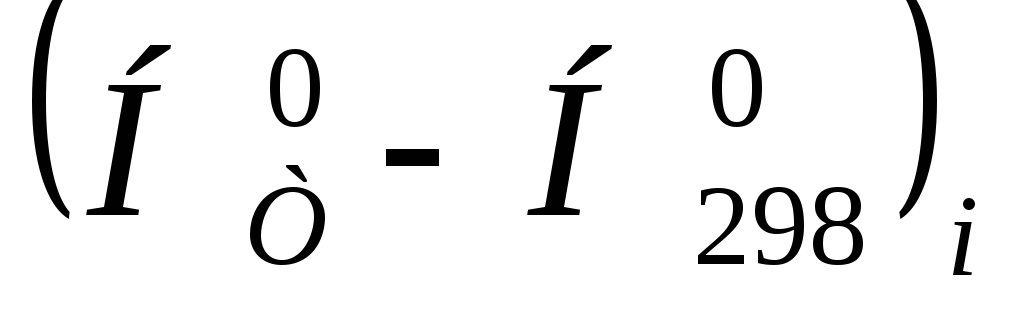 и энтропии
и энтропии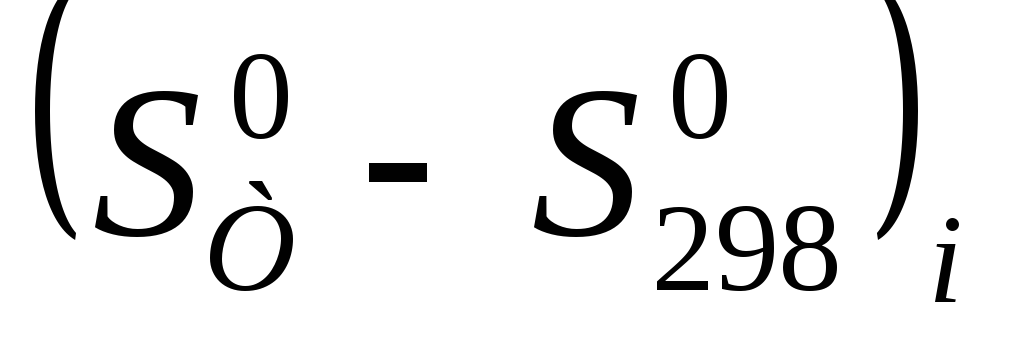 каждого компонента и заменяя их
алгебраическими суммами
каждого компонента и заменяя их
алгебраическими суммами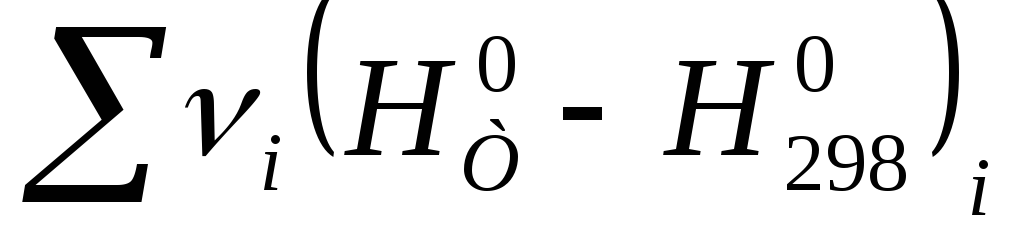 и
и значения
значения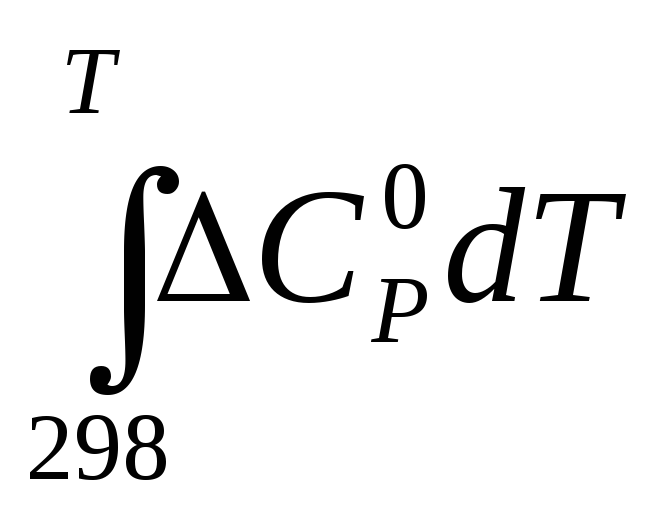 и
и 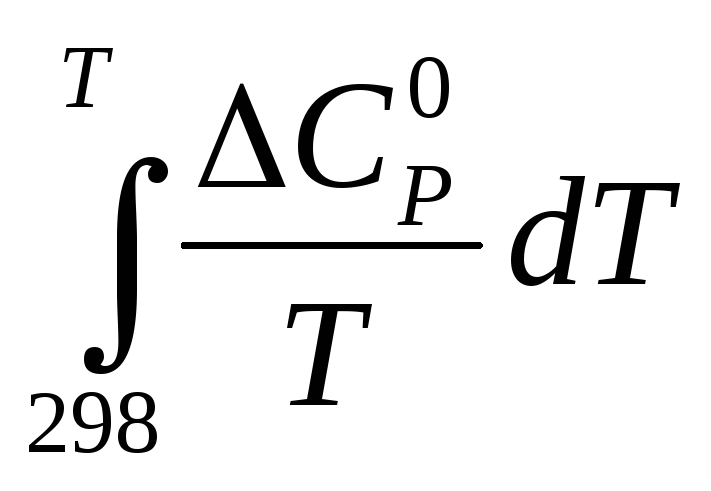 :
:
![]() (5.6)
(5.6)
Данным методом
находят значения температурных
составляющих энтальпии и энтропии по
таблицам [6]. Этод метод удобен при
расчете процессов, протекающих выше
400К. При расчетных температурах,
находящихся между температурами,
приведенными в таблицах Киреева,
составляющие определяются интерполированием.
Расчет
![]() и
и![]() для химической реакции в виде
алгебраической суммы:
для химической реакции в виде
алгебраической суммы:
![]() =
=
![]() кон.
–
кон.
–
![]() исх.
(5.7)
исх.
(5.7)
![]() =
=
![]() кон.
–
кон.
–
![]() исх.
(5.8)
исх.
(5.8)
Метод Ф* - потенциала для широкого диапазона температур от 0К до высоких Т [1,6] по равенству вида:
![]() (5.9)
(5.9)
Вычислить
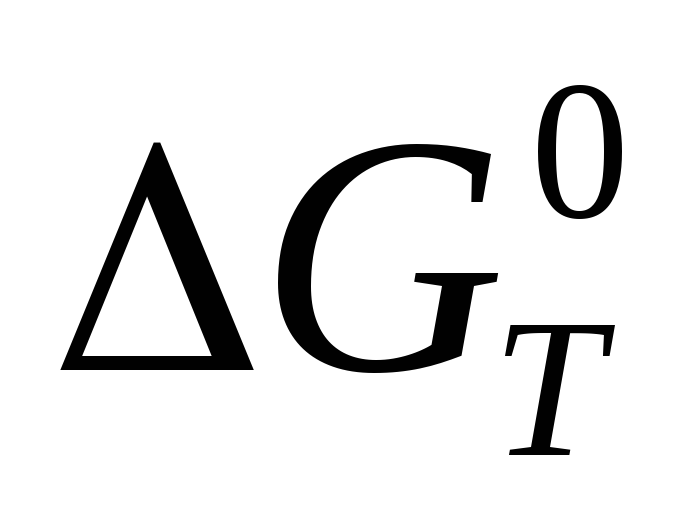 можно также на основе константы
равновесия (КР)
по уравнению:
можно также на основе константы
равновесия (КР)
по уравнению:
![]() (5.10)
(5.10)
Примеры задач:
Задача
1. Вычислить
значения
![]() для реакции окисления фосфора при
стандартных условиях.
для реакции окисления фосфора при
стандартных условиях.
Задача
2. Вычислить
значения
![]() для реакции образования аммиачной
селитры при 3600К
с учетом температурной зависимости
теплоемкости.
для реакции образования аммиачной
селитры при 3600К
с учетом температурной зависимости
теплоемкости.
Задача
3. Вычислить
значения
![]() для реакции образования аммиака при
4500К
по методу Тёмкина-Шварцмана.
для реакции образования аммиака при
4500К
по методу Тёмкина-Шварцмана.
Задача
4. Вычислить
значения
![]() для реакции конверсии метана водяным
паром при 9000К
по методу Киреева.
для реакции конверсии метана водяным
паром при 9000К
по методу Киреева.
Задача
5. Вычислить
значения
![]() для реакции образования аммиака при
4500К
по методу Ф*
- потенциала.
для реакции образования аммиака при
4500К
по методу Ф*
- потенциала.
Контрольные вопросы.
О сути свободной энергии Гиббса.
Характерные изменения свободной энергии Гиббса для процессов, протекающих в заданном направлении.
Характерные изменения свободной энергии Гиббса для процессов, протекающих в обратном направлении.
Характерные изменения свободной энергии Гиббса для процессов, находящихся в равновесии.
Связь сводной энергии Гиббса с основными термодинамическими показателями и параметрами.
Влияние температуры на свободную энергию Гиббса.
Методы расчета иэменений свободной энергии Гиббса.
Задание для самостоятельной работы
Студент должен выполнить СРС по следующим темам:
Расчет изменений свободной энергии Гиббса при стандартных условиях, примеры расчетов.
Расчет изменений свободной энергии Гиббса с учетом температурной зависимости теплоемкости, примеры расчетов.
Расчет изменений свободной энергии Гиббса по известным данным по теплоемкости участников реакции, примеры расчетов.
Расчет изменений свободной энергии Гиббса по методу Темкина-Шварцмана, примеры расчетов.
Расчет изменений свободной энергии Гиббса по методу Киреева,
примеры расчетов.
Расчет изменений свободной энергии Гиббса по методу Ф* - потенциала, примеры расчетов.
Расчет изменений свободной энергии Гиббса на основе данных о константе равновесия, примеры расчетов.
Расчет изменений свободной энергии Гиббса по величине ЭДС гальванического элемента, примеры расчетов.
