
Ошурков П.А. - Объемные образования головного мозга - 2019
.pdf4. Посттравматические лептоменингеальные кисты
Подавляющее большинство посттравматических кист выявляются у детского населения, поскольку для их формирования требуется быстрорастущий мозг. Формирование посттравматических лептоменингеальных кист у взрослых крайне редко (вероятно, в таких случаях имеет место внутричерепная гипертензия). В генезе формирования кисты лежит травма, сопровождающаяся переломом черепа (необходима широкая линия перелома) и разрывом твердой мозговой оболочки. С течением времени за счет роста вещества головного мозга и увеличения внутричерепного объема может происходить медленное расширение места перелома с последующим формированием подапоневротического скопления.
Клинически посттравматические лептоменингеальные кисты могут быть асимптомными и представлять собой мягкое пальпируемое и визуально различимое подкожное образование на голове. Однако же известны случаи возникновения массэффекта и появления неврологического дефицита.
КТ и МРТ диагностика возможна по показаниям и без труда может установить соответствующий диагноз. Рентгенологическим признаком (краниография) будет являться расширение линии перелома и появление «изъеденности» костных краев.
В ситуациях, когда расширение линии перелома возникает изолированно, без последующего формирования подапоневротической арахноидальной кисты, речь идет о «псевдорастущих переломах». Такие переломы в большинстве случаев не нуждаются в коррекции.
Лечение истинных посттравматических лептоменингеальных кист исключительно хирургическое и предполагает обязательное выполнение костно-пластической трепанации черепа с пластикой твердой мозговой оболочки.
5. Расширение пространств Вирхова-Робина
По факту не являются как таковыми арахноидальными кистами, представляя собой щелевидные пространства вокруг сосудов головного мозга (в т.ч. мелкого калибра) и сообщающиеся с субарахноидальным пространством.
Существующие в норме пространства Вирхова-Робина вовлечены в ряд физиологических процессов и выполняют ряд функций:
•Поток ликвора циркулирует на фоне сердечных сокращений из субарахноидального пространства в пространства Вирхова-Робина, осуществляя условия для осуществления обмена веществ.
•Пространства Вирхова-Робина являются важной составляющей частью гемато-энцефалического барьера.
•Принимают участие в иммунорегуляции, поскольку содержат иммунокомпетентные клетки (в том числе макрофаги, не преодолевшие гемато-энцефалический барьер), вазоактивные нейропептиды, регулирующие артериальное давление и частоту сердечных сокращений, деятельность микроглиоцитов.
•Участвуют в передаче сигналов и участвуют в предотвращении развития воспаления (путем активации фермента аденилатциклазы, которая затем производит цАМФ, участвующей в модуляции аутореактивных и
регуляторных Т-клеток).
Пространства Вирхова-Робина, как правило, микроскопически малы, в связи с чем трудно различимы при нейровизуализации. Однако пространства могут становиться более заметными с увеличением возраста пациента, особенно это актуально для
100
пространств, расположенных у основания мозга. Также пространства могут становиться заметными в белом веществе головного мозга в центральных его отделах, а также в среднем мозге. Диаметр периваскулярных пространств обычно не более 3 мм., однако по данным некоторых авторов расширение их у здоровых лиц может достигать 5-ти мм. в диаметре.
Чаще всего, расширение пространств Вирхова-Робина является асимптомной находкой. Однако же в рядее ситуаций они могут оказаться клинически значимыми и сопровождаться нарушениями функций мозга.
По локализации выделяют три типа расширенных пространств Вирхова-Робина:
•вокруг лентикулостриальных артерий базальных ганглиев (чаще всего);
•в коре головного мозга вокруг мозговых артерий;
•в среднем мозге.
Резкое расширение пространства Вирхова-Робина, достигающее в диаметре 1-5 мм, с четко очерченными стенками и без выраженных изменений окружающей ткани называется «криблюра». При большом количестве криблюр в различных отделах головного мозга формируется так называемое криброзное состояние (status cribrosus).
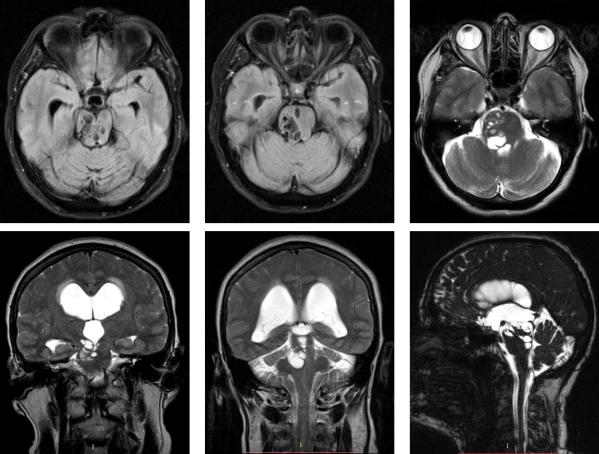
Рис. 85. МРТ головного мозга пациента, демонстрирующее расширенные пространства Вирхова-Робина.
Расширение пространств Вирхова-Робина чаще свидетельствует о наличии атрофии головного мозга, в ряде ситуаций ассоциированной с когнитивным дефицитом, однако могут наблюдаться и у здоровых людей. Расширение периваскулярных пространств чаще связано с наличием сопутствующих факторов, таких как сосудистая гипертензия, атеросклероз, лейкоареоз и др.
101
РАЗДЕЛ 4 ПАРАЗИТАРНЫЕ ИНВАЗИИ ГОЛОВНОГО МОЗГА
___________________________________________________________________________
1. Общие сведения
Среди объемных образований головного мозга, с которыми можно столкнуться в клинической практике помимо абсцессов, опухолей и кист, отдельным блоком стоят паразитарные инвазии. Это относительно редкий вариант патологии, однако же являющийся более частым в некоторых эндемичных районах и странах.
Наиболее частыми вариантами паразитарной инвазии центральной нервной системы являются:
•цистицеркоз;
•токсоплазмоз;
•эхинококкоз;
•амебиаз;
•шистосомоз.
2. Цистицеркоз головного мозга
Цистицеркоз головного мозга представляет собой наиболее частую паразитарную инвазию центральной нервной системы. Эндемичными районами для цистицерка (свиной цепень, Taenia solium) являются Восточная Европа, Мексика, Южная и Центральная Америка, страны Азии и некоторые другие. Средняя продолжительность инкубационного периода до клинических проявлений составляет 7 лет (однако варьирует от нескольких месяцев до десятков лет).
Человек может заразиться цистицеркозом при употреблении в пищу свинины, содержащей цистицерков в мышечной ткани при недостаточной термической обработке. Цистицерк высвобождается в тонком кишечнике, где живет и развивается. При помощи специальных присосок и крючьев взрослая особь живет в тонком кишечнике человека, являющегося единственным постоянным хозяином взрослого организма цистицерка. Особь питается непосредственно через поверхность своего тела и имеет уплощенную сегментированную форму. Зрелые сегменты (проглоттиды), содержащие репродуктивные органы, вырабатывают яйца, свободно выделяющиеся с калом в окружающую среду. Крупный рогатый скот или свиньи заражаются, употребляя в пищу корм, содержащий яйца или зрелые проглоттиды цепня. Цикл замыкается. Таким образом, обычный вариант существования свиного цепня не предполагает инвазии центральной нервной системы человека. Этот путь реализуется в том случае, когда человек становится не постоянным, а промежуточным хозяином паразита.
Существуют три основных пути возникновения нейроцистицеркоза:
•Алиментарное заражение через пищу (чаще овощи) или воду, зараженную яйцами, попавшими из человеческого кала.
•Фекально-оральный путь от носителя взрослого организма при несоблюдении санитарных норм и условий.
•Самозаражение при обратном направлении перистальтики и попадании проглоттидов со зрелыми яйцами из тонкой кишки в желудок (редкий вариант).
102
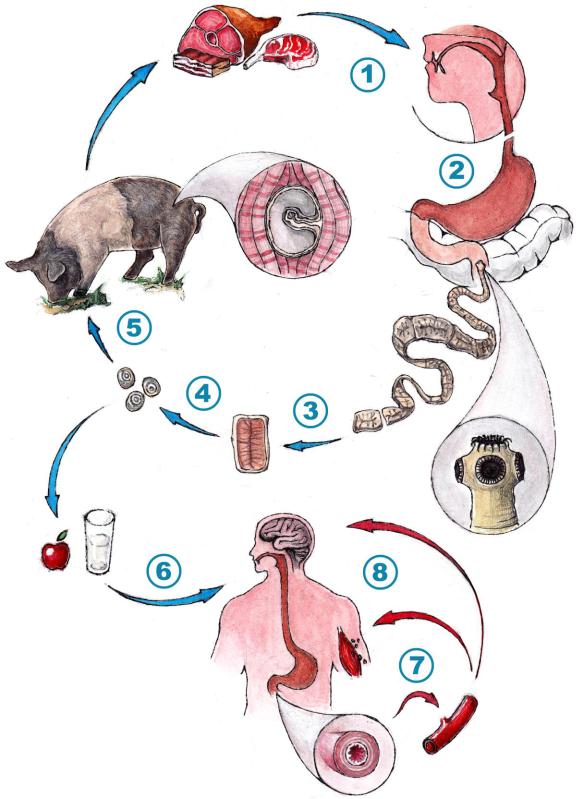
Рис. 86. Цикл развития свиного цепня и пути заражения человека цистицеркозом. Художник Гаев А.А., 2019 г.
Пояснения: 1) Употребление человеком в пищу свинины, содержащей цистицерков в мышечной ткани при недостаточной термической обработке; 2) Развитие цистицерка в организме человека (постоянного хозяина паразита); 3) Отделение зрелых сегментов цепня, содержащих яйца; 4) Выход яиц в окружающую среду; 5) Заражение крупного рогатого скота; 6) Заражение человека в качестве промежуточного хозяина (тупиковая ветвь развития цепня); 7) Вышедшая из яйца личинка прободает стенку тонкой кишки, попадая в кровоток; 8) Поражение органов-мишеней.
103
Попадая в желудок и двенадцатиперстную кишку человека, яйцо подвергается химической обработке, его оболочка растворяется, и созревшая личинка проникает через стенку тонкой кишки в системный кровоток, а далее в скелетные мышцы, глаза, подкожно-жировую клетчатку и головной мозг (60-92% случаев цистицеркоза). В ткани хозяина личинка созревает и образует стенку цистицерка, а далее формирует эмбрион. Эмбрион может самопроизвольно погибнуть в течение 5-7 лет, а также подвергнуться кальцификации.
Выделяют два типа поражения головного мозга при нейроцистицеркозе:
•Целлюлозный цистицерк. Представляет собой равномерные круглые или овальные тонкостенные кисты размерами 3-20 мм, локализующиеся чаще в паренхиме или узких субарахноидальных пространствах. Чаще эти кисты статичны, вызывают лишь реактивное воспаление и содержат в себе сколекс (головной участок паразита).
•Рацемозный цистицерк. В отличие от предыдущего варианта чаще имеет тенденцию к быстрому росту, крупных размеров (4-12 см), образует гроздеобразные группы в базальном субарахноидальном пространстве, вызывает реактивное воспаление. Кисты не содержат личинок.
Вотношении клинической картины на первое место выступают фокальные и генерализованные припадки, симптоматика внутричерепной гипертензии, очаговый неврологический дефицит, обусловленный топическим поражением нервной системы.
Врамках диагностических мероприятий имеют значение следующие:
•Неврологический осмотр.
•Выявление плотных на ощупь узлов в подкожной жировой клетчатке.
•В общем анализе крови обращает на себя внимание умеренная периферическая эозинофилия.
•Анализ цереброспинальной жидкости может быть нормальным, может отмечаться эозинофилия.
•При анализе кала можно обнаружить яйца гельминта.
•При выполнении серологического анализа крови и ликвора определяется титр антител к цистицерку (положительный при титре 1:64 в плазме и 1:8 в цереброспинальной жидкости).
•Близкой к 100% специфичностью обладает лишь новый иммуноэлектротрансферный анализ. Однако в случаях единичных кист его специфичность и чувствительность также ниже.
•При рентгенографическом исследовании мягких тканей можно обнаружить калицификаты в подкожной жировой клетчатке, а также мышцах бедра и плеча.
•При выполнении краниографии иногда также можно обнаружить кальцинаты.
•При выполнении компьютерной томографии и магнитно-резонансной томографии головного мозга можно обнаружить кисты различной величины с кольцевидным повышением плотности, представляющие собой живых цистицерков. Характерными являются кисты небольшого размера, низкой плотности с эксцентричными пятнистыми зонами повышенной плотности (сколекс). Могут также выявляться зоны низкой плотности с кольцевидным повышением плотности и кальцифицированными остатками. Существуют также иные варианты вида кист при нейровизуализации, а также различные локализации патологического процесса, зачастую базальные.
104
Лечение нейроцистицеркоза:
•Симптоматическая и патогенетическая терапия. Сводится к адекватному обезболиванию и назначению стероидных препаратов. На фоне снижения отека головного мозга (дексаметазон 16-24 мг/сут.) у пациента может уменьшаться неврологический дефицит, повышаться уровень сознания.
•Противогельминтные препараты. Назначаются на фоне начала приема кортикостероидов (назначают за 2-3 дня до начала лечения и продолжают в течение курса).
1.Празиквантел – противогельминтный препарат. Имеет активность в отношении всех известных видов шистосом. Назначается по 50 мг/кг, разделенный на 3 приема в течение 15 дней. В большинстве случаев отмечается положительная динамика по данным нейровизуализации.
2.Албендазол. Назначают в дозе 15 мг/кг/сут., разделяя на три приема. Принимается с жирной пищей для улучшения абсорбции. Терапия продолжается 3 мес.
3.Никлозамид. Назначается внутрь для элиминации взрослых паразитов из ЖКТ (препаратом выбора является празиквантел). Дизирование: 1 г. (2 таблетки), курс два приема с разницей 1 час. Общий объем курса – 2 г.
•Хирургическое лечение. Не является основным методом лечения. В основе терапии цистицеркоза лежит назначение адекватной противогельминтной терапии. Однако оперативное лечение возможно как для уточнения диагноза (как тотальная резекция, так и варианты открытой и стереотаксической биопсии), так и для случаев, не имеющих адекватного ответа на консервативную терапию.
3.Эхинококкоз
Еще одним из вариантов паразитарного поражения центральной нервной системы является эхинококкоз головного мозга. Заболевание вызывается представителем рода ленточных червей отряда циклофиллид (Cyclophyllidea)- эхинококком (Echinococcus granulosa и др.).
Половозрелые особи эхинококка, длина которых достигает 3-5 мм. паразитируют в тонком кишечнике собак, лис, песцов, шакалов и реже кошек. Половозрелые особи, имеющие название стробил, состоят из головки (сколекса) с четырьмя присосками и двумя венчиками из крючьев, а также члеников (проглоттид), последняя из которых составляет около половины длины тела паразита, содержит развитую половую систему и яйца. Следует также отметить, что зрелые членики способны к самостоятельному передвижению и могут вызывать зуд. При разрыве члеников яйца эхинококка с испражнения попадают в окружающую среду и контаминируют шерсть животного, а также траву, воду, окружающие предметы.
В большинстве случаев цикл развития эхинококка не предполагает участие в нем человека, являющегося для паразита тупиковой ветвью. Так, попадая в окружающую среду, яйца эхинококка могут оказаться проглоченными промежуточным хозяином, которыми являются свиньи, овцы, коровы, лошади. В двенадцатиперстной кишке промежуточного хозяина из яйца выходят личинки, представляющие собой онкосферу с крючьями. Личинка перфорирует стенку кишки и попадает в венозный кровоток. Далее с венозной кровью онкосфера разносится во внутренние органы, в частности в печень, а также в легкие, селезенку, почки, мышечную ткань, кости и вещество мозга.
105
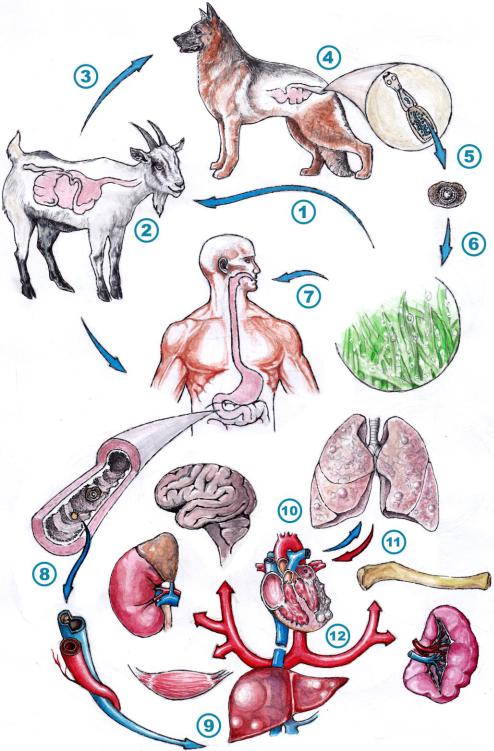
Рис. 87. Цикл развития эхинококка и пути заражения человека эхинококкозом. Художник Гаев А.А., 2019 г.
Пояснения: 1) Проглатывание яиц эхинококка промежуточным хозяином; 2) Выход личинок в двенадцатиперстной кишке промежуточного хозяина, инвазия стенки, и разнос онкосфер по внутренним органам с венозной кровью, образование эхинококковых пузырей; 3) Поедание финнозного мяса хищниками при гибели животного; 4) Развитие половозрелых особей и их паразитиврование в тонком кишечнике постоянного хозяина; 5) Выход яиц эхинококка в окружающую среду; 6) Варианты контаминации; 7) Проглатывание яиц человеком (тупиковая ветвь); 8) Попадание личинки в системный кровоток; 9) Через портальную вену поражение печени (первый орган-мишень); 10) Проникновение личинок в малый круг кровообращения и инвазия в легкие (второй орган-мишень); 11) Проникновение в большой круг кровообращения; 12) Поражение органов-мишеней.
106
В органах-мишенях личинки образуют эхинококковые пузыри, окружаясь хитиновой оболочкой, так называемые лавроцисты или финны. Эти пузыри способны увеличиваться в размерах и отпочковываться, образуя своеобразные грозди. При гибели животных (промежуточных хозяев), финны могут быть съедены волками, собаками и другими хищниками. Цикл замыкается.
Заражение человека может произойти пероральным путем в том случае, если яйца эхинококка, попавшие в окружающую среду, окажутся проглоченными. Эндемичными районами для эхинококкоза являются Уругвай, Австралия, Новая Зеландия. Случаи выявления эхинококкоза в России считаются казуистикой, однако именно поэтому заслуживают внимания, поскольку вызывают вопросы способы диагностики и лечения их как редких заболеваний. В случае проглатывания человеком яиц, в желудочнокишечном тракте, в частности в желудке и двенадцатиперстной кишке оболочка яйца растворяется, и из него выходят жизнеспособные личинки, вооруженные крючьями. Пробуравливая стенку кишечника, личинки попадают в системный кровоток (венозная кровь). Венозная кровь от кишечника через портальную вену попадает в печень. Это первый орган-мишень, имеющий наибольшую частоту поражения. Далее кровь с личинками, преодолевшими печень, оттекает в сердце и попадает в малый круг кровообращения. Таким образом, легкие являются вторым органом-мишенью. В редких случаях, преодолевая и их, личинки могут попасть в большой круг кровообращения и вновь через сердце быть разнесенными уже в остальные органы. Так, поражены могут оказаться само сердце, почки, селезенка, поперечно-полосатая мышечная ткань, кости, некоторые другие органы и, в частности, головной мозг. Частота поражения нервной системы составляет около 3% случаев. Чаще всего кисты головного мозга первично одиночные, однако с течением времени они могут отпочковываться. Множественные кисты в головном мозге могут образовываться также при разрыве сердечных кист и разносе паразита вместе с кровью, а также при ятрогенном повреждении стенки кисты во время нейрохирургического вмешательства.
Диагностика эхинококкоза сводится к сбору эпидемиологического анамнеза, оценке общего анализа крови (характерна эозинофилия), оценке неврологического статуса (симптоматика повышения внутричерепного давления, эписиндром, очаговый неврологический дефицит). При выполнении нейровизуализации на КТ-снимках кисты имеют плотность содержимого, сходную с церебро-спинальной жидкостью. Накопление контрастного вещества не является характерным признаком (кисты не копят контраст). Однако при наличии перифокальной зоны воспаления может присутствовать кольцевидное накопление. Простые эхинококковые кисты может быть трудно дифференцировать от доброкачественных кист, абсцессов или доброкачественных или злокачественных опухолей. Следует обращать внимание на наличие дочерних кист, а также на наличие созревающих паразитарных частиц в кистах («эхинококковый песок» (протосколицы и дебрис)). Присутствие эхинококкового песка в аспирируемой жидкости кисты является диагностическим показателем. Дополнениями к диагностике являются рентгенография и ультразвуковая диагностика иных органов-мишеней, которые могут быть также поражены кистами. Целесообразно и показано выполнение серологических тестов (иммуноферментный анализ, иммунофлуоресцентный анализ, непрямая гемагглютинация). Однако следует обратить внимание, что эти тесты не обладают 100% специфичностью и чувствительностью. Показательным является анализ на наличие хитина в кистах (положительный гидативный тест).
107
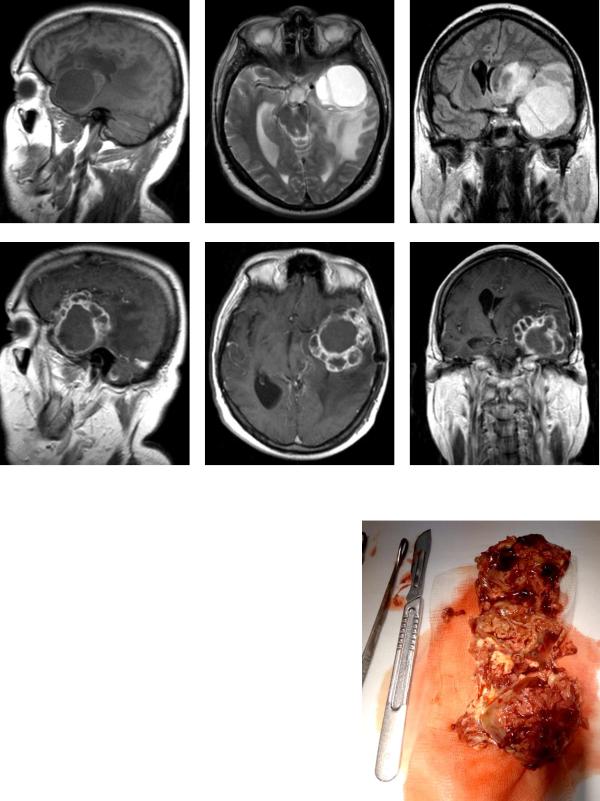
Рис. МРТ головного мозга пациента с эхинококкозом головного мозга.
Рис. 88. МРТ того же пациента с рецидивом и диссеминацией эхинококковых кист после их интраоперационного вскрытия и распространения содержимого
В |
отличие |
от |
цистицеркоза, |
при |
||
эхинококкозе головного мозга лечение сводится |
||||||
в первую очередь не к назначению |
||||||
противопаразитарных |
препаратов, |
а |
к |
|||
хирургическому удалению кист. Следует |
||||||
обратить внимание, что ключевой позицией при |
||||||
хирургии эхинококкоза является необходимость |
||||||
иссечения кист без повреждения их стенки. При |
||||||
повреждении кисты и выходе ее содержимого, |
||||||
создаются условия для быстрого поражения их |
||||||
сколексами |
и |
последующего |
развития |
|||
множественных кист. Если во время операции |
||||||
разрыв кисты все же произошел, следует |
||||||
отсосать все ее содержимое, удалить капсулу, |
||||||
промывать |
сформировавшуюся |
полость |
||||
физиологическим раствором в течение не менее 5 |
Рис. 89. Интраоперационный |
|
минут, полностью сменить инструменты и |
||
снимок. |
||
перчатки. Более того, в литературе встречаются |
||
Удаленные из ткани головного |
||
указания на необходимость помещения в полость |
||
мозга рецидивные эхинококковые |
||
ватных тампонов, пропитанных 10% раствором |
||
множественные пузыри |
||
формалина. Однако целесообразность и оправ- |
||
|
108
данность последнего действия весьма спорна. Хирургическое лечение при эхинококкозе целесообразно дополнить назначением албендазола 400 мг. 2 раза в день в течение 28 дней. С противоотечной целью в рамках симптоматической терапии можно применять стероиды (дексаметазон) и диакарб под прикрытием аспаркама.
4. Токсоплазмоз
Токсоплазма (Toxoplasma gondii) является облигатным внутриклеточным паразитом, встречающийся повсеместно, однако вызывающий заболевание у людей только при скомпрометированном иммунном статусе. Токсоплазмоз представляет собой антропозооноз, природно-очаговое заболевание и распространен повсеместно. Наиболее часто токсоплазмоз является СПИД-ассоциированным заболеванием, также известны случаи внутриутробного заражения. У здоровых людей токсоплазмоз весьма редок.
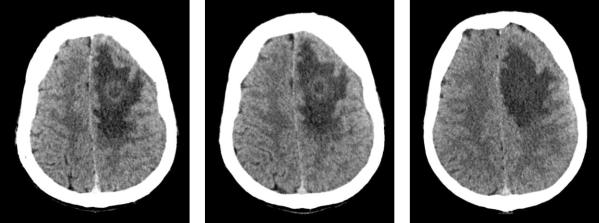
Рис. 90. Данные КТ головного мозга пациента с типичным токсоплазменным абсцессом левой лобной доли.
Токсоплазмоз может поражать клетки различных органов человека: головной мозг, ткани глаза, сердечную и скелетную мышцы, матку, легкие, оболочки плода и др. Токсоплазмоз ЦНС вместе с первичными лимфомами ЦНС представляют собой наиболее часто встречающиеся заболевания (32% и 4,7% соответственно), при которых возникают очаговые изменения центральной нервной системы при СПИДе.
Источником заражения токсоплазмозом являются кошки, зараженные Т. gondii, и рассеивающие паразитов в окружающую среду с фекалиями, мочой, слюной. Круг промежуточных хозяев очень широк, что свидетельствует о практическом отсутствии хозяинной специфичности токсоплазмы.
Окончательным хозяином для токсоплазмы являются представители семейства кошачьих (чаще домашние кошки). Вслед за сложной серией циклов шизогонии в тканях кошек последовательно происходят гаметогония, оплодотворение и спорогония в клетках кишечника. В результате в фекалиях зараженного животного можно обнаружить ооцисты. Промежуточным хозяином являются мышевидные грызуны, человек и другие млекопитающие, птицы, пресмыкающиеся.
Инвазионными считаются зрелые ооцисты (со спорозоитами), находящиеся во внешней среде и распространяемые кошками, а также все стадии бесполого размножения, происходящего в тканях промежуточного хозяина. Кошки заражаются ооцистами, поедая мышей. Заражение человека возможно тремя способами: 1) ооцистами перорально при несоблюдении правил гигиены; 2) алиментарно – при
109
