
3440
.pdf
ISSN 2225-1995
НАУЧНЫЙ ВЕСТНИК
ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ
АРХИТЕКТУРНО-СТРОИТЕЛЬНЫЙ
УНИВЕРСИТЕТ
Серия:
Физико-химические проблемы и высокие технологии
строительного материаловедения
•МАТЕРИАЛОВЕДЕНИЕ. СТРОИТЕЛЬНЫЕ МАТЕРИАЛЫ
•ТЕХНОЛОГИЯ СТРОИТЕЛЬНЫХ ИЗДЕЛИЙ И КОНСТРУКЦИЙ
•ФИЗИЧЕСКАЯ ХИМИЯ СТРОИТЕЛЬНЫХ И ТЕХНИЧЕСКИХ МАТЕРИАЛОВ
•МЕТОДЫ КОНТРОЛЯ И ДИАГНОСТИКИ МАТЕРИАЛОВ И ИЗДЕЛИЙ
•ПОЖАРНАЯ, АВАРИЙНАЯ И ЭКОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ
•ХРОНИКА, БИБЛИОГРАФИЯ
Выпуск № 2 (7)
2013 г
Научный Вестник Воронежского государственного архитектурно-строительного университета
УДК 54 |
ISSN 2225-1995 |
ББК 24 |
|
ФИЗИКО-ХИМИЧЕСКИЕ ПРОБЛЕМЫ И ВЫСОКИЕ ТЕХНОЛОГИИ СТРОИТЕЛЬНОГО МАТЕРИАЛОВЕДЕНИЯ
Редакционный совет Научного вестника: Д-р хим. наук, проф. Рудаков О.Б.
Д-р техн. наук, проф. Суровцев И.С. Канд. физ.-мат. наук Проскурин Д.К.
Редакционная коллегия серии:
Главный редактор ‒ д-р хим. наук, проф. О.Б. Рудаков Зам. главного редактора ‒ д-р хим. наук, проф. Г.В. Славинская
Зам. главного редактора ‒ д-р техн. наук, проф. В.Т. Перцев Ответственный секретарь ‒ канд. физ.-мат. наук, ст. преп. Никишина А.И.
Члены редколлегии:
Д-р техн. наук, проф. В.В. Белов (г. Тверь, ТвГТУ); д-р техн. наук, проф. А.Н. Бобрышев (г. Пенза, ПГУАС); к.т.н., проф. В.В. Власов (г. Воронеж, Воронежский ГАСУ); д-р техн. наук, проф. Гаркави М.С. (г. Магнитогорск, МГТУ им. Г.И. Носова); д-р техн. наук, проф. С.С. Глазков (г. Воронеж, Воронежский ГАСУ); д-р физ.-мат. наук, проф. П.А. Головинский (г. Воронеж, Воронежский ГАСУ); д-р техн. наук, проф. Ю.Г. Иващенко (г. Саратов, СГТУ им. Ю.А. Гагарина); д-р хим. наук, проф. А.В. Калач (г. Воронеж, ВИ ГПС МЧС России); д-р техн. наук, проф. В.И. Калашников (г. Пенза, ПГУАС); д-р техн. наук, проф. А.Д. Корнеев (г. Липецк, ЛГТУ); д-р техн. наук, проф. Л.В. Моргун (г. Ростов, РГСУ); д-р техн. наук, проф. Ю.В. Пухаренко (г. Санкт-Петербург, СПбГАСУ); д-р техн. наук, проф. Ш.М. Рахимбаев (г. Белгород, БГТУ им. В.Г. Шухова); д-р хим. наук, проф. В.Ф. Строганов (г. Казань, КГАСУ); д-р техн. наук, проф. А.А. Трещев (г. Тула, ТулГТУ); д-р техн. наук, проф. Е.М. Чернышов (г. Воронеж, Воронежский ГАСУ); д-р физ.-мат. наук, проф. Шитикова М.В.; д-р техн. наук, проф. В.П. Ярцев (г. Тамбов, ТГГУ).
Технический редактор выпуска − м.н.с. департамента науки и инноваций Альбинская Ю.С.
В серии публикуются результаты научных исследований и производственного опыта сотрудников университета и других организаций по проблемам физической химии строительных и технических материалов; химической технологии и физико-химическим методам контроля качества материалов, применяющихся в строительстве; по экологии и химической безопасности строительных технологий и др.
Издание рекомендуется специалистам по промышленному и гражданскому строительству, материаловедам, технологам, инженерам, научным сотрудникам, преподавателям, аспирантам, магистрантам и студентам архитектурно-строительных и технических учебных заведений.
АДРЕС РЕДАКЦИИ 394006 г. Воронеж, ул. 20-летия Октября, 84, ком. 6419
тел.: (473) 2369350, (473)2717617 E-mail: chemistry@vgasu.vrn.ru
Воронежский государственный архитектурно-строительный университет
Перепечатка материалов журнала допускается только с разрешения редакции
2

Научный Вестник Воронежского государственного архитектурно-строительного университета
МАТЕРИАЛОВЕДЕНИЕ. СТРОИТЕЛЬНЫЕ МАТЕРИАЛЫ
УДК 542.913
О.В. Артамонова
ИССЛЕДОВАНИЕ ПРОЦЕССА ОБРАЗОВАНИЯ ГИДРАТИРОВАННЫХ ОКСИДОВ НА НАНОМАСШТАБНОМ УРОВНЕ
В работе предложена феноменологическая модель образования наносистем гидратированных оксидов, включающая следующие стадии: гидролиз акваионов, их поликонденсацию с образованием полимерных оксогидроксокомплексов, формирование зародышей, их дальнейший рост, агрегацию и кристаллизацию.
Ключевые слова: наноразмерные оксиды, золь-гель технология, зарождение фазы
O.V. Artamonova
RESEARCH OF PROCESS OF HYDRATED OXIDES FORMATION AT
NANOSCALE LEVEL
The paper proposed a phenomenological model of the formation of hydrated oxides nanosystems comprising the following steps: Hydrolysis aqua ions, their polycondensation to form polymer oxohydroxocomplexes, formation of nuclei and their subsequent growth, aggregation and crystallization.
Keywords: nano-oxides, sol-gel process, the nucleation phase
Введение. В химической технологии конденсации веществ из гомогенных систем различают три определяющих метода синтеза и зародышеобразования твердых частиц (в том числе наночастиц): метод осаждения из жидкой (как правило, водной) фазы, основанный на использовании различных химических реакций взаимодействия двух или более веществ, приводящих к образованию новой фазы; метод, основанный на организации высокотемпературных реакций взаимодействия двух или более веществ, приводящих к образованию нерастворимого продукта; метод конденсации из газовой фазы, когда в результате окислительно-восстановительных реакций или реакций гидролиза, протекающих в газовой фазе, выделяется твердая фаза.
Настоящее исследование, направленно на установление корреляций между условиями получения, составом, структурой, дисперсностью, морфологией и свойствами оксидных наносистем на всех этапах их образования и эволюции, начиная с формирования гидрозолей и суспензий гидратированных оксидов из растворов солей. Все исследуемые системы получены золь-гель методом.
Сначала целесообразно провести теоретический анализ эволюции твердого состояния. При раскрытии общей эволюционной модели образования твердого вещества можно следовать трактовкам И.В. Мелихова [1]. В соответствии с современными представлениями, применимыми для систем любого состава, в образовании твердого вещества можно выделить следующие основные стадии эволюции субстанции: зарождение твердой фазы, рост частиц, агломерацию, самопроизвольное превращение во времени. При этом следует говорить о трех эволюционных переходах между стадиями и соответственно о явлениях
молекулярного, топологического и морфологического отбора.
© Артамонова О.В., 2013
3
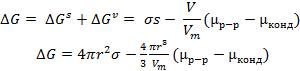
Научный Вестник Воронежского государственного архитектурно-строительного университета
Очень важно раскрытие процесса эволюции структуры твердого вещества на стадии фазообразования (зародышеобразование – наномасштабный уровень), где наиболее существенную роль играют механизмы, предопределяемые структуру и свойства твердого тела. Очевидно, что на наномасштабном уровне образование материалов подчиняется единым фундаментальным закономерностям формирования структуры.
Современные теории фазообразования основаны на представлениях о растворимости вещества, образовании насыщенных и пересыщенных систем. В зависимости от концентрации растворы могут быть ненасыщенными, насыщенными и пересыщенными. В первых преобладают процессы растворения, во вторых вероятность растворения и фазообразования одинакова, а в третьих происходит образование зародышей новой фазы [2]. Образование новой фазы в пересыщенных растворах происходит за счет флуктуации концентраций или плотности вещества.
Термодинамическая теория образования новой фазы в пересыщенных растворах разработана Гиббсом – Фольмером [3]. Образование новой фазы возможно при определенной критической степени пересыщения, которая зависит как от природы веществ, так и от наличия ядер конденсации. При гомогенной конденсации происходит самопроизвольное образование зародышей критического размера.
Энергия Гиббса образования центров конденсации G включает объемную G и поверхностную Gs составляющие. Величина G соответствует изменению энергии перехода одного моля вещества из пересыщенного раствора в конденсированное состояние. Этот переход сопровождается уменьшением энергии. Приращение объемной составляющей при образовании зародыша определяется разностью химических потенциалов вещества в растворе р-р и в объеме зародыша (в более конденсированной фазе) конд:
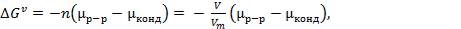 (1)
(1)
где n — число моль вещества в зародыше; Vm— молярный объем вещества в конденсированном состоянии; V— объем зародыша.
Формирование зародыша, содержащего п молей вещества, требует затраты энергии на
образование новой поверхности: |
|
Gs = s, |
(2) |
где — поверхностное натяжение на границе раздела зародыш/среда; s - площадь поверхности зародыша.
Общая энергия Гиббса Gобразования зародыша при конденсации составляет:
. (3)
Поверхностная и объемная составляющие энергии Гиббса образования зародыша имеют различный характер зависимости от радиуса частиц (рис. 1). Величина Gs положительная и растет при увеличении радиуса пропорционально r2. Вторая составляющаяG отрицательная, и по абсолютной величине растет пропорционально r3 (объему частицы). Это определяет появление максимума на зависимости полной энергии Гиббса от радиуса. Положение максимума соответствует критическим условиям фазообразования.
Образование зародышей становится возможным при достижении определенной (критической) степени пересыщения раствора тем веществом, молекулы которого участвуют в образовании новой фазы. Пересыщение необходимо потому, что образование новой фазы
4
Научный Вестник Воронежского государственного архитектурно-строительного университета
сопровождается резким увеличением поверхностной энергии, что делает невозможным самопроизвольное течение этого процесса.
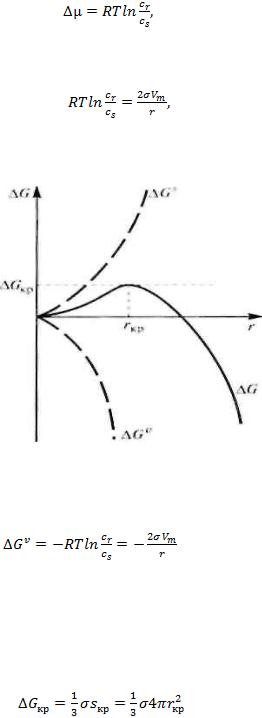
Изменение химического потенциала в процессе фазообразования в пересыщенном растворе (без учета его неидеальности) может быть выражено как:
(4)
Критическая степень пересыщения соответствует равновесным условиям уравнения Кельвина [4]:
(5)
где сrи сs - - растворимость вещества в высокодисперсном состоянии с радиусом сферических частиц и растворимость при равновесии с крупными частицами этого вещества соответственно.
Рис. 1. Зависимость энергии Гиббса образования зародыша от его радиуса
Учитывая уравнение Кельвина, объемная составляющая энергии Гиббса образования критического зародыша новой фазы в растворе составляет:
, |
(6) |
а уравнение полной энергии Гиббса образования зародыша критического размера выражается соотношением:
Gкр = Gsкр + G кр . |
(7) |
Проведя математические преобразования с учетом площади поверхности sкр = 4 r2кр, получим выражение для критической энергии Гиббса образования зародыша
. |
(8) |
Анализ этого соотношения показывает, что возникновение новой фазы зависит от поверхностной энергии, следовательно, от радиуса зародыша. Если степень пересыщения превышает критическую величину, то энергия Гиббса уменьшается при самопроизвольном росте зародышей, при этом пересыщение системы снижается, и образование новых центров конденсации прекращается.
5

Научный Вестник Воронежского государственного архитектурно-строительного университета
С учетом коэффициента пересыщения из уравнения (6) можно выразить величину критического размера зародыша и записать в виде:
. |
(9) |
С учетом этого соотношения уравнение полной энергии Гиббса образования зародыша критического размера будет равно:
. |
(10) |
Таким образом, энергия Гиббса образования зародышей при гомогенной конденсации равна одной трети его поверхностной энергии, а остальные две трети энергии компенсируются энергетической выгодностью фазового перехода. Из соотношения (10) следует, что энергия образования зародыша и размер критического зародыша зависят от степени пересыщения системы: чем она выше, тем меньше размеры образующихся зародышей, способных к дальнейшему росту. Непрерывное повышение пересыщении сопровождается спонтанным образованием новой фазы в форме мельчайших зародышей. Образование новой фазы можем протекать по гетерогенному механизму, когда вещество конденсируется на предварительно сформированных поверхностях (стенках сосуда, посторонних включениях (добавках), ядрах конденсации). Гетерогенный процесс протекает при значительно меньших степенях пересыщения. Особую роль в этом случае играют смачивание и адгезия конденсирующегося вещества на центрах инородной поверхности.
Экспериментально был исследован процесс фазообразования нескольких наноразмерных систем (табл. 1).
Таблица 1
Параметры золь-гель процессов синтеза наноразмерных модификаторов
|
Прекурсоры |
|
Параметры синтеза |
, |
Методы |
||||
системыНомер |
|
,Концентрация %,л/моль |
размерСредний нм,частиц |
мин,Время |
|
,Температура |
окончаниипорН синтеза |
агломерацииНачало суток |
исследования |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С |
|
|
Analyzette 22, Photocor, |
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
РФА, ПЭМ и |
|
Формулы |
|
|
|
|
|
|
|
микрофотографии |
|
|
|
|
|
|
|
|
|
систем |
|
|
|
|
|
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
|
6 |
7 |
8 |
9 |
|
|
|
Система SiO2·nH2O |
|
|
||||
1 |
Na2SiO3·5H2O |
1,0 М |
|
|
|
|
|
|
|
|
|
|
5 |
65 |
|
21 |
11 |
16 |
|
|
HCl |
0,1 М |
|
|
|||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Система AlOOH |
|
|
||||
|
Al(NO3)3·9H2O |
0,1 M |
|
|
|
|
100 |
нм |
|
2 |
|
|
15 |
60 |
|
25 |
12 |
5 |
|
NH4OH |
2 % |
|
|
||||||
|
|
|
|
|
|
|
|
||
|
HNO3* |
4 % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|

Научный Вестник Воронежского государственного архитектурно-строительного университета
Система FeOOH
|
Fe(NO3)3·9H2O |
0,1 M |
|
|
|
|
|
|
|
3 |
NH4OH |
0,1 M |
5 |
60 |
25 |
|
4 |
5 |
|
|
|
|
|
|
|
|
|
||
|
HNO3* |
4 % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
7 |
8 |
9 |
|
|
|
Цеолит типа NaX |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
Na2SiO3·5H2O |
0,1 M |
|
|
|
|
|
|
|
|
|
|
5 |
25 |
25 |
|
9 |
3 |
|
4 |
Al2(SO4)3 |
0,1 M |
|
|
|||||
|
|
|
|
|
|
|
|||
NaOH* |
0,1 M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
* электролит-пептизатор
Системы синтезировали золь-гель методом по методике, описанной в работе [5]. Золь- гель-процесс – удобный метод получения наноматериалов через рост металлооксополимеров в растворах; он основан на неорганических реакциях полимеризации [6].
В задачи исследования входило изучение физико-химических характеристик полученных систем: размера, роста и агломерации полученных наночастиц. В работе были использованы: рентгенофазовый анализ (дифрактометр ARL X’TRA), который применяли для установления фазового состава полученных систем; метод лазерной дифракции (лазерный анализатор размера частиц «Анализетте 22») для определения формы и размера частиц в полученных системах; метод просвечивающей электронной микроскопии (ПЭМ –
Transmission Electron Microscope H - 9500 с 75 кВ) для оценки размера частиц; метод динамического светорассеяния (спектрометр Photocor Complex) для изучения процессов агломерации частиц в полученных системах.
Экспериментально была выявлена корреляция между способностью осадков к кристаллизации и гидратным потенциалом (Z2/r) (таблица 2).
Таблица 2 Зависимость фазового состава и размера кристаллитов (ОКР), синтезируемых гидратиратированных оксидов от вида образующего их гидролизуемого иона
Вид |
Z2/r |
Вид |
Способность к образованию |
|
иона |
|
синтезируемого |
кристаллической структуры |
|
|
|
вещества |
|
|
1 |
2 |
3 |
4 |
|
Si4+ |
40,00 |
SiO2-x/2(OH)x |
При комнатной температуре независимо от условий |
|
|
|
|
осаждения образуется рентгеноаморфный гель или |
|
|
|
|
гидрозоль. Фазовый состав и размер ОКР зависят от рН. |
|
Zr4+ |
22,22 |
ZrO(OH)2 |
При комнатной температуре независимо от условий |
|
|
|
|
осаждения образуется рентгеноаморфный осадок. |
|
Al3+ |
16,82 |
Al(OH)3 / |
При комнатной температуре методом прямого |
|
|
|
AlOOH |
осаждения возможно образование |
как рентгено- |
|
|
|
аморфного, так и нанокристаллического осадка. |
|
|
|
|
Фазовый состав и размер ОКР зависят от рН. |
|
Fe3+ |
16,36 |
Fe(OH)3 |
При комнатной температуре методом прямого |
|
|
|
|
осаждения образуется рентгеноаморфный осадок, |
|
|
|
|
термообработка которого при 90 °С в течение 3-5 ч |
|
|
|
|
приводит к началу образования нанокристаллитов – |
|
|
|
|
Fe2O3 (ОКР 46 нм). |
|
|
|
|
7 |
|
Научный Вестник Воронежского государственного архитектурно-строительного университета
1 |
2 |
3 |
|
|
4 |
|
|
|
|
|
|
|
|
||
Fe2+ |
5,13 |
Fe(OH)2 |
В слабощелочной среде (рН ~ 7,8 |
– |
8,2) образуются |
||
|
|
|
нанокристаллиты с ОКР 10 – 12 нм, в сильнощелочной |
||||
|
|
|
среде (рН 13,65) при 40 °C – Fe(OH)2 |
с ОКР 16 нм. |
|||
Mg2+ |
5,56 |
Mg(OH)2 |
При |
комнатной |
температуре |
образуются |
|
|
|
|
нанокристаллиты с ОКР 6 нм. |
|
|
||
Са2+ |
3,78 |
Са(ОН)2 |
При комнатной температуре образуются кристаллиты с |
||||
|
|
|
ОКР 5 – 10 нм. |
|
|
|
|
Показано, что чем более гидролизующийся ион (больше величина Z2/r) участвует в формировании осадка гидратированного оксида, тем меньше полученное вещество склонно к образованию кристаллической фазы. Все экспериментальные данные хорошо согласуются с теоретическим моделированием стадии фазообразования, рассмотренной выше. Полученные результаты позволили сделать вывод: способность гидратированных оксидов к кристаллизации обратно пропорциональна величине Z2/r и энергии связи Mn+ – О2-, что обусловлено необходимостью перестройки структуры осадков в процессе упорядочения локальной структуры ближнего порядка с возникновением дальнего порядка (кристаллической решетки).
Детальное исследование, проведенное для каждой системы, позволило выявить общие закономерности образования твердого состояния вещества и предложить феноменологическую модель образования частиц гидратированных оксидов на наномасштабном уровне.
Рассмотрим детально стадию зародышеобразования, протекающую в растворе. Она проходит в несколько этапов (рис. 2).
Образующиеся ионы различных металлов (элементов) в пересыщенном растворе (ионы М2+, М3+, М4+), подвергаются гидратации с образованием мономерного акваиона, например для двухвалентного металла, М2+ nН2О, далее протекает частичный или полный гидролиз с образованием растворимого мономерного гидроксокомплекса [(H2O)n-1М – ОН]+, причем гидроксокомплексы образуются из аквакомплексов в результате реакции кислотноосновного взаимодействия при удалении протона из внутренней сферы комплексного иона. Далее протекает гомогенная гидролитическая поликонденсация с образованием полиядерных оксогидроксокомплеков (полимерная молекула). Следующий этап - образование флуктационного ассоциата, который представляет собой конгломерат полимерных молекул, образующийся за счет водородной химической связи.
Димер в результате дегидратации может также вызывать образование оловых соединений. Следующая стадия - образование зародыша (первичной частицы) за счет поликонденсации внутри ассоциата. Затем этап гетерогенной поликонденсации (лимитируемая стадия - диффузный рост), заканчивающейся образованием НРЧ, которые в свою очередь под действием процесса коагуляции могут образовывать далее различные системы: гидрозоль, гель, рентгеноаморфный или кристаллический осадки.
Таким образом, в данной работе рассмотрены теоретические аспекты и результаты экспериментальных исследований формирования твердой фазы гидратированных оксидов на наномасштабном уровне в различных оксидных системах. Выявлена корреляция между теоретическими модельными представлениям и полученными практическими результатами. На основании экспериментальных исследований предложена общая модель образования наносистем гидратированных оксидов.
8
Научный Вестник Воронежского государственного архитектурно-строительного университета
Ионы: М2+, М3+, М4+
Гидратация
Мономерный акваион: М3+·nH2O
Частичный или полный гидролиз
Растворимый мономерный гидроксокомплекс: M3+·nH2O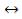 [(H2O)n-1M–OH]2+ + H+
[(H2O)n-1M–OH]2+ + H+
Гомогенная гидролитическая поликонденсация
Полиядерный оксогидроксокомплекс (полимерная молекула):
Обратимое флуктационное образование ассоциатов
Флуктационный ассоциат (конгломерат полимерных молекул):
Поликонденсация внутри ассоциата
Зародыш (первичная частица)
Гетерогенная поликонденсация (диффузионный рост)
Наноразмерная частица
Коагуляция
|
|
|
|
|
|
|
|
|
|
|
|
Рентгеноаморфный осадок |
|
|
|
Гидрозоль |
|
|
|
Гель |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2. Феноменологическая модель образования частиц гидратированных оксидов на наномасштабном уровне
9
Научный Вестник Воронежского государственного архитектурно-строительного университета
Список литературы
1.Мелихов И.В. Физико-химическая эволюция твердого вещества. – М.: БИНОМ. Лаборатория знаний, 2009. – 309 с.
2.Вест А. Химия твердого тела. Теория и приложения в 2-х ч. - Ч. 1, 2: Пер. с англ. – М.: Мир, 1988. – 336 с.
3.Шабанова Н.А., Попов В.В., П.Д. Саркисов. Химия и технология нанодисперсных оксидов: Учеб. пособие. − М.: ИКЦ «Академкнига», 2006. − 309 с.
4.Гусев А.И., Ремпель А.А. Нанокристаллические материалы. – М.: Физматлит, 2000.
–224 с.
5.Артамонова О.В., Коротких Д.Н., Чернышов Е.М. Золь-гель синтез наноразмерных
частиц SiO2 для модифицирования структуры цементного камня // Нанотехнологии в строительстве: научный Интернет – журнал. – 2010. - № 1. - С. 97 – 105.
6.Пул Ч., Оуэнс Ф. Нанотехнологии. Пер. с англ. под ред. Ю.И. Головина. - М.: Техносфера, 2004. - 328 с.
____________________________________________________________
Артамонова Ольга Владимировна - к.х.н., доцент кафедры химии Воронежского государственного архитектурно-строительного университета. E-mail: Ol_artam@rambler.ru
10
