
3440
.pdf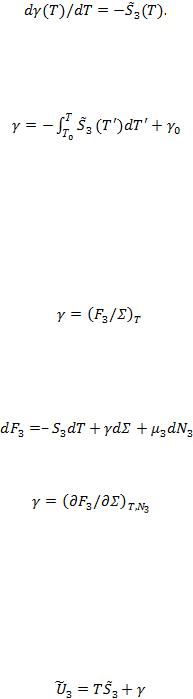
Научный Вестник Воронежского государственного архитектурно-строительного университета
Нетрудно видеть, что уравнение (13) является полной аналогией уравнения (1), полученного для открытой объемной системы.
6.Уравнение состояния поверхностной фазы как открытой системы. Из μЗ = 0 и
(8)следует, что
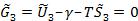 . (14)
. (14)
Дифференцируя (14) по T и учитывая (13), получим следующее уравнение:
(15)
Уравнение (15) и является уравнением состояния однокомпонентной поверхностной фазы, записанным в неявной форме. Интегрируя это уравнение, получим уравнение состояния для поверхностной фазы в его обычной явной форме
. |
(16) |
где T0 – минимальная температура, при которой образуется равновесная двухфазная система. Уравнение (16), согласно [2], является в то же время и уравнением единственного процесса, который можно осуществить в поверхностной фазе, не нарушая равновесия двух объемных фаз. Видно, что уравнение (16), полученное для поверхностной фазы, является аналогией уравнения (3), полученного для открытой объемной системы.
7. О некорректности определения коэффициента межфазного натяжения.
Обычное определение коэффициента межфазного натяжения дается в работе [8]:
, |
(17) |
т.е. он равен свободной энергии FЗ поверхностной фазы, приходящейся на единицу площади поверхности при изотермическим процессе. Это обнаруживается, если основное уравнение термодинамики (7) для поверхностной фазы представить так:
. |
(18) |
Из (18) следует, что
. |
(19) |
Условие NЗ = const в (19) говорит о том, что авторы [8] превратили поверхностную фазу в закрытую систему, не связанную с двумя объемными фазами. Условие T = const подтверждает, что поверхностная фаза создана вне равновесной двухфазной системы, так как в равновесной двухфазной системе осуществить изотермический процесс без нарушения ее фазового равновесия нельзя. Следовательно, определение коэффициента межфазного натяжения в [8] следует признать некорректным.
8. Определение коэффициента межфазного натяжения. Из (14) следует, что
. |
(20) |
Как известно, для закрытой объемной системы
91

Научный Вестник Воронежского государственного архитектурно-строительного университета
. |
(21) |
Аналогией уравнения (21) для открытых объемных фаз будет следующее уравнение:
. |
(22) |
Тогда, очевидно, для поверхностной фазы как открытой системы имеем
. |
(23) |
Сравнивая (23) и (20), видим, что
. |
(24) |
Уравнение (24) как раз и представляет собой определение коэффициента межфазного (поверхностного) натяжения. Очевидно, он равен поверхностной плотности свободной энергии поверхностной фазы при условии, когда фазовое равновесие двух объемных фаз не нарушается.
9.Об измерении коэффициента межфазного натяжения. Измерение коэффициента поверхностного натяжения без нарушения фазового равновесия представляет собой трудную задачу. Методика его измерения для жидкостей, которая существует сегодня [9], совершенно не учитывает в процессе его измерения фазового равновесия. Необходима разработка иной методики измерения коэффициента поверхностного натяжения.
10.Поверхностная плотность теплоемкости поверхностной фазы. Введем понятие поверхностной плотности теплоемкости [5]:
. |
(25) |
Уравнение (20) с учетом (15) можно представить так:
. |
(26) |
Дифференцируя уравнение по T, получим
. |
(27) |
Уравнение (27) устанавливает связь между поверхностной плотностью теплоемкости 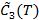 поверхностной фазы и равновесным значением коэффициента межфазного натяжения γ(T). Уравнение (27) аналогично уравнению (5), полученному для открытой объемной
поверхностной фазы и равновесным значением коэффициента межфазного натяжения γ(T). Уравнение (27) аналогично уравнению (5), полученному для открытой объемной
системы. Нечто подобное уравнению (27) получено в работе [10]
, |
(28) |
где в авторских обозначениях Eпов – внутренняя энергия поверхностной фазы, а CΣ – теплоемкость, полученная при изопроцессеΣ=const. Как показано в [2], в открытой системе, которой является и поверхностная фаза, осуществить такой процесс нельзя, поэтому уравнение (28) лишено смысла.
92
Научный Вестник Воронежского государственного архитектурно-строительного университета
11. Условия равновесия двухфазной системы с учетом межфазного натяжения.
Общепринятые в физике условия равновесия двухфазной системы имеют вид:
, |
, |
. |
(29) |
Эти условия были установлены Дж. У. Гиббсом при разработке им общей теории термодинамического равновесия. Условия того, что каждая из фаз в равновесной двухфазной системе должна быть открытой системой [5, 7] приводит к изменению условий равновесия
(29):
, |
, |
. |
(30) |
Двухфазная равновесная система с учетом межфазного натяжения представляет собой на самом деле трехфазную равновесную систему: две объемные фазы и одну поверхностную. Тогда условия равновесия этих трех фаз с учетом того, что все они являются открытыми системами, запишутся так
, |
, |
. |
(31) |
Список литературы
1.Термодинамика. Терминология. - М.: Наука, 1973. - Вып. 85. - С. 7.
2.Павлов Б.Л., Белко В.Н. Уравнение состояния открытых систем. - Воронеж. инж. - строит. ин-т. - Воронеж. - 1993. - Деп. В ВИНИТИ 29.06.93, № 1792- В 93.
3.Павлов Б.Л., Белко В.Н. Термодинамика открытых систем // Тез. док. XXXIV науч. внутривуз. конф. - Воронеж. технолог. ин-т. - Воронеж. - 1993. - Т. 3. - С. 34.
4.Павлов Б.Л., Белко В.Н. К теории равновесных систем // Научный Вестник Воронеж. госуд. архит. – строит. ун-та. Серия: Физико-химические проблемы и высокие технологии строительного материаловедения. - Воронеж, 2012. - № 5. - С. 33.
5.Павлов Б.Л., Белко В.Н. Уравнение состояния поверхностной фазы / Воронеж
.госуд. архит.- строит. ун-т. - Деп. в ВИНИТИ 26.01.10, № 42-В. - 2010.
6.Базаров И.П. Термодинамика. - М.: Наука, 1964. - С. 92.
7.Павлов Б.Л., Белко В.Н. Уравнение равновесного процесса в двухфазной системе. – Воронеж. госуд. архит. - строит. университет. - Воронеж. - 2008. - Деп. в ВИНИТИ 28.03.08,
№264. В 2008.
8.Ландау Л.Д., Лифшиц Е.М. Теоретическая физика. Статистическая физика. - Ч. 1. - М.: ФИЗМАТЛИТ, 2005. - С. 591.
9.Герасимов Я.И., Древинг и др. Курс физической химии. - Т. I. - М.: Химия, 1964. -
С. 474.
10.Левич В.Г. Курс теоретической физики. Теория электромагнитного поля. Теория относительности. Статистическая физика. - Т. I. - М.: Госуд. изд-во физ.-мат. лит.,
1962. - С. 581.
____________________________________________________________
Павлов Борис Леонидович – ассистент кафедры физики Воронежского государственного университета инженерных технологий.
Белко Владимир Николаевич – к.ф.-м.н., доцент кафедры физики и химии Воронежского государственного архитектурно-строительного университета. Тел.(473)2715004
93

Научный Вестник Воронежского государственного архитектурно-строительного университета
УДК 536.75
Б.Л. Павлов, В.Н. Белко, А.И. Никишина.
СТАТИСТИЧЕСКАЯ ТЕОРИЯ ДИССОЦИАЦИИ ДВУХАТОМНОГО ГАЗА
Теория открытых равновесных систем была применена к вырожденным идеальным бозе- и ферми-газам, состоящим из частиц, равновесному с веществом фотонному газу, равновесному вырожденному фононному газу в твѐрдых телах, двухфазной равновесной системе, поверхностной равновесной системе. В данной работе показано применение этой теории уже в химии – разделе, связанном с диссоциацией молекул.
Ключевые слова: открытые равновесные системы
B.L. Pavlov, V.N. Belko, A.I. Nikishina
STATISTICAL THEORY OF DISSOCIATION OF DIATOMIC GAS
The theory of open equilibrium systems has been applied to degenerate ideal Bose and Fermi gases, consisting of particles, photon gas equilibrium with substance, equilibrium degenerate phonon gas in solids, two-phase equilibrium system, surface equilibrium system. In this paper it is shown the application of mentioned theory in the chemistry – section associated with the dissociation of molecules.
Keywords: open equilibrium systems
Введение. Все термодинамические системы можно разделить на два типа: закрытые (системы с постоянным числом частиц N0) и открытые (системы с переменным числом частиц N). Теория открытых равновесных систем была развита в работах [1, 2]. В них показано, что условием для того, чтобы однокомпонентная система была открытой, является равенство нулю химического потенциала еѐ частиц (µ = 0). Вводятся термодинамические параметры открытых системы: давление P, абсолютная температура T (объѐм V не является термодинамическим параметром открытой системы).
Вместо таких обычных термодинамических характеристик закрытой системы, как свободная энергия F, внутренняя энергия U, энтропия S, число частиц N0, для открытой системы вводятся еѐ термодинамические характеристики, которые представляют собой
плотности 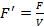 ,
, 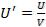 ,
,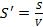 ,
, 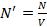 , являющиеся функциями только абсолютной
, являющиеся функциями только абсолютной
температуры. В работе [1] показано, что все изопроцессы (изотермический, изохорический, изобарический, адиабатический), которые можно совершить в закрытых системах, осуществить в открытых системах невозможно. В открытой системе существует только один равновесный процесс P = P(T), который связан с изменением числа частиц в ней при изменении еѐ температуры. В работе [1] выведено уравнения их состояния (равновесного процесса, происходящего в них)
(1)
в неявной форме. Вводится понятие плотности теплоѐмкости
____________________________________________________________________
©Павлов Б.Л., 2013
94

Научный Вестник Воронежского государственного архитектурно-строительного университета
Краткий обзор применения этой теории к различным разделам физики дан в [3].
Применение теории открытых систем к диссоциации двухатомного газа. В
данной работе показано применение данной теории уже в химии при изучении вопроса диссоциации молекул. Действительно, при диссоциации молекул на атомы число последних с увеличением температуры растѐт, поэтому термодинамическая система, состоящая из молекул и атомов, на которые они распались, представляет собой систему с переменным числом частиц, т.е. открытую систему.
В качестве примера можно взять диссоциацию двухатомной молекулы водорода Н2. Химическая реакция в этом случае запишется так: Н2+ γ = Н + Н. Здесь мы учли, что до распада на атомы молекула Н2 поглотила фотон (γ – квант), энергия которого равна энергии диссоциации молекулы εд. Обратный процесс диссоциации двухатомной молекулы на атомы носит название рекомбинации. Очевидно, что при этом процессе согласно (3) два атома молекулы объединяются в двухатомную молекулу, испуская фотон. Согласно законам сохранения энергии и импульса имеем: εм + εγ = 2εн, pм + pγ = pн + pн′. Если выбрать систему координат, связанную с двухатомной молекулой, то εм = 0, рм = 0 и мы получим уравнения: εγ = 2εн, рγ = pн + pн′, причѐм, так как система координат связана с двухатомной молекулой, то при разлѐте двух атомов водорода после поглощения молекулой фотона должно выполняться условие рн + рн′ = 0.
Тогда прежние уравнения можно переписать так εγ = 2εн, рγ = 0. Из второго уравнения видно, что для записанной выше химической реакции не выполняется закон сохранения импульса: импульс фотона должен быть равен нулю. Для того, чтобы выполнялся закон сохранения импульса, следует предположить, что при химической реакции излучается не один, а два фотона с противоположными импульсами: Н + Н = Н2 + 2γ. Аналогией такой рекомбинации является аннигиляция пары электрон - позитрон [4]: e+ +e− = 2γ.Температуру диссоциации Тд можно найти, полагая εд = 2εγс, где εγс − средняя энергия фотона, а εд − энергия диссоциации двухатомной молекулы. Средняя энергия фотона согласно [5]
(3)
где ζ(3)=1,202. Следовательно, Тд = εд (5,40 k)-1. Подставляя в эту формулу значения k =
1,38∙10−23 Дж·K−1, εд=4,48эВ= 4,48∙1,6∙10−19 Дж = 7,17∙10−19 Дж, получим Тд = 0,962∙104K. Из закона сохранения энергии следует, что εм + 2εγс = 2εн. В системе координат, связанной с
двухатомной молекулой, следует, что εн =  . Будем считать, что двухатомные молекулы и их атомы подчиняются распределению Больцмана [6]
. Будем считать, что двухатомные молекулы и их атомы подчиняются распределению Больцмана [6]
(4)
где nm, εm − соответственно среднее число частиц и энергия в m - ом квантовом состоянии, k − постоянная Больцмана. Согласно сказанному выше для открытых систем µ = 0, поэтому для них распределение Больцмана принимает следующий вид
Согласно [7], число квантовых состояний частицы с импульсом p, движущейся в
объѐме куба периодичности V = L3 (L − длина ребра куба) в квазиклассическом случае равно V(p /h)3. Учитывая, что ε = p2/2m, перепишем это выражение в терминах ε: V(2m)3/2 h-3ε3/2.
Дифференцируя его, получим элементарное число квантовых состояний частицы с импульсом p, движущейся квазиклассически в объѐме куба периодичности:
95

Научный Вестник Воронежского государственного архитектурно-строительного университета
3∙21/2m3/2Vh-3εdε, где m − масса частицы. Тогда распределение Больцмана в (5) запишется в дифференциальной форме так
Из сказанного выше следует, что если в ε = εн, то величина ε изменяется в пределах от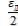 до ε = ∞. Введѐм переменную z =
до ε = ∞. Введѐм переменную z =  , где ε′ = ε –
, где ε′ = ε –  , которая уже изменяется в пределах
, которая уже изменяется в пределах
от 0 до ∞. Тогда дифференциальное распределение Больцмана для открытых систем принимает следующий вид
где для краткости записи введено обозначение T* =  . Ввиду сложности полученного выражения в (7) мы ограничимся рассмотрением только двух предельных случаев: случай, когда T<<T*(низкие температуры) и случай, когда T>>T*(высокие температуры). При высоких температурах (
. Ввиду сложности полученного выражения в (7) мы ограничимся рассмотрением только двух предельных случаев: случай, когда T<<T*(низкие температуры) и случай, когда T>>T*(высокие температуры). При высоких температурах ( << 1) величиной
<< 1) величиной  в (7) можно пренебречь и распределение Больцмана для открытых систем в (7) принимает следующий вид
в (7) можно пренебречь и распределение Больцмана для открытых систем в (7) принимает следующий вид
Тогда мы можем записать термодинамические характеристики газа, состоящего из атомов водорода
Коэффициент 2 в (9) учитывает, что при диссоциации двухатомной молекулы последняя распадается на два одинаковых атома.
где при высоких температурах ε(z) = kT(z + 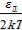 ) ≈ zkT. Далее
) ≈ zkT. Далее
Согласно [8]
96

Научный Вестник Воронежского государственного архитектурно-строительного университета
Тогда уравнения (9) – (11) принимают следующий вид
В (15) мы получили уравнение состояния идеального газа, состоящего из атомов диссоциировавших двухатомных молекул, при высоких температурах. Это уравнение представляет собой аналог уравнения Клапейрона-Менделеева (PV= kTN0) уже для открытых систем. Заметим, что переписать это уравнение в виде уравнения PV= NkT мы уже не можем, так как в открытых системах объѐм V как термодинамический параметр не существует. В классической физике отношение 2U к PV определяет число степеней свободы частицы или молекулы
где i=3 для частицы, i=5 для двухатомной молекулы, i= 6 для многоатомной несимметричной молекулы. Подставляя значения U и P из (14) и (15) в уравнение (17), получим i=3. Очевидно, что при высокой температуре атомы, на которые распалась при диссоциации двухатомная молекула, представляют собой обыкновенные частицы, у которых число степеней свободы i=3. Плотность энтропии газа, образовавшегося из атомов двухатомных молекул вследствие их диссоциации при высоких температурах можно найти из (2) и (15):
Плотность теплоѐмкости газа, образовавшегося из атомов двухатомных молекул вследствие их диссоциации при высоких температурах, можно найти из (3) и (14) - следует, что
При низких температурах (T<<T*) можно сделать следующие приближения
Тогда получим следующее распределение
Для краткости введѐм обозначение
97
Научный Вестник Воронежского государственного архитектурно-строительного университета
Тогда (21) можно записать так
Очевидно, что в терминах открытых систем имеем
В последнем уравнении сделано приближение |
. Далее |
Учитывая, что |
, получим |
Уравнение (29) представляет собой уравнение состояния идеального газа, состоящего из атомов двухатомных молекул, которые диссоциировали при низких температурах. Это уравнение, согласно сказанному выше, также является аналогом уравнения КлапейронаМенделеева (PV = kTN0) для открытой системы. Из (26) и (28), согласно (17), следует, что для каждого атома, на которые распались при диссоциации двухатомные молекулы при низких
температурах, число степеней свободы равно i = 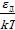 =
= 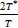 . При низких температурах T<<T*,
. При низких температурах T<<T*,
поэтому значение i представляет очень большую величину (в пределе равную ∞). Таким образом, атомы, на которые распались при диссоциации двухатомные молекулы, при низких температурах ведут себя как объекты с бесконечным числом свободы. Плотность числа атомов, на которые диссоциировали двухатомные молекулы при низких температурах можно
найти, полагая в (27) h=6,62∙10−34 Дж с,  =30, mн=1,67∙10−27 кг. После вычислений получим Nʹ = 3,4∙10−5 м−3. Разумеется, что при температуре Т =
=30, mн=1,67∙10−27 кг. После вычислений получим Nʹ = 3,4∙10−5 м−3. Разумеется, что при температуре Т =  говорить о каком-либо газе из атомов водорода, образовавшегося после диссоциации молекул водорода на атомы, не имеет смысла. Однако уже при температуре Т =
говорить о каком-либо газе из атомов водорода, образовавшегося после диссоциации молекул водорода на атомы, не имеет смысла. Однако уже при температуре Т = 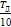 величина Nн резко возрастает и становится
величина Nн резко возрастает и становится
равной 3∙1019 м−3.
Плотность энтропии газа, образовавшегося из атомов двухатомных молекул вследствие их диссоциации при низких температурах, можно найти из уравнений (2) и (29)
При дифференцировании в (30) учтено, что 2 << . Плотность теплоѐмкости газа,
. Плотность теплоѐмкости газа,
образовавшегося из атомов двухатомных молекул вследствие их диссоциации при низких температурах можно найти из уравнений (3) и (28)
98

Научный Вестник Воронежского государственного архитектурно-строительного университета
В уравнении (31) учтено, что 1 << .
.
Список литературы
1.Павлов Б.Л., Белко В.Н. Уравнение состояния открытых систем. Воронеж. госуд. инжен.-строит. институт. – Воронеж, 1993. – Деп. в ВИНИТИ 29.06.93, № 1792 – В93.
2.Павлов Б.Л., Белко В.Н. Термодинамика открытых систем. – Воронеж. госуд. технологический институт. – Воронеж, 1993. – Тезисы докл. XXXIV науч. внутривуз. конф. – Т. 3. – С. 34.
3.Павлов Б.Л., Белко В.Н. К теории открытых систем. – Воронеж. госуд. архит.- строит. университет. Научный Вестник. Серия: Физико-химические проблемы и высокие технологии строительного материаловедения. - 2012. - № 5. – С. 33.
4.Физический энциклопедический словарь. – М.: Советская энциклопедия, 1983. – С. 23.
5.Павлов Б.Л., Белко В.Н. Спектральные и интегральные законы излучения. – Воронеж. госуд. архит.-строит. университет. – Воронеж, 2011. – Деп. в ВИНИТИ 5.05.11,
№209 – В2011.
6.Ландау Л.Д., Лифшиц Е.М. Теоретическая физика. Статистическая физика. – Т. V. Ч. I. – М.: ФИЗМАТЛИТ, 2005. – С. 140.
7.Павлов Б.Л., Белко В.Н. Связь между квазиклассическим и квантовым фазовыми пространствами частицы. – Воронеж. госуд. архит.-строит. университет. – Воронеж, 2011. – Деп. В ВИНИТИ 15.01.11, № 293 – В2011.
8.Двайт Г.Б. Таблицы интегралов и другие математические формулы. – М.: Наука, 1983. – С. 154.
Павлов Борис Леонидович – ассистент кафедры физики Воронежского государственного университета инженерных технологий. Тел. (473) 2538054.
Белко Владимир Николаевич – к.ф.-м.н., доцент кафедры физики Воронежского государственного архитектурно-строительного университета. Тел.(473)2715004.
Никишина Анна Игоревна ‒ к.ф.-м.н., старший преподаватель кафедры физики Воронежского государственного архитектурно-строительного университета. Е-mail: ann-nikishina@yandex.ru;
тел.(473)2715004.
99

Научный Вестник Воронежского государственного архитектурно-строительного университета
УДК 631.95
С.С. Глазков, А.А. Измайлов, В.К. Астанин
ВЛИЯНИЕ ФРАКЦИОННОГО СОСТАВА НАПОЛНИТЕЛЕЙ НА ФИЗИКОХИМИЧЕСКИЕ СВОЙСТВА КОМПОЗИЦИОННЫХ МАТЕРИАЛОВ
Повышение качества композиционных материалов на основе вторичного полиэтилена и древесного наполнителя достигается использованием экструзионного способа получения в сравнении с методом плоского прессования.
Ключевые слова: композит, наполнитель, связующее, прессование , экструзия
S.S. Glazkov, A.A. Izmaylov, V.K. Astanin
INFLUENCE OF FRACTIONAL STRUCTURE NAPOLNITELEJ ON PHYSICAL AND CHEMICAL PROPERTIES OF COMPOSITE MATERIALS
Improvement of quality of composite materials on the basis of secondary polythene and wood filler is reached by use extrusion a way of reception in comparison with a method of flat pressing.
Keywords: a composite, filler, binder, pressing, extrusion
Введение. Свойства композиционного материала зависят главным образом от размера и площади поверхности частиц наполнителя, их объемной доли и распределения в синтетической полимерной матрице. Опираясь на многочисленные исследования [1, 2], можно заключить, что большое влияние на эксплуатационные показатели оказывают физико-химические свойства как полимерной матрицы, так и наполнителя. Однако существуют два принципиально разных метода получения композитов: прессование и экструзия, которые отличаются технологическим оформлением и соответственно весьма различным влиянием на формирование структуры и свойства композиционных материалов [3]. Поэтому в данной работе наряду с оценкой структуры и химического состава наполнителей и полимерного связующего основное внимание уделено сравнению разных методов получения композитов.
Экспериментальная часть. В выполняемой работе для создания древеснополимерных материалов (ДПМ) предложено использование различных видов растительных наполнителей, являющихся отходами сельскохозяйственной и лесоперерабатывающей промышленности. В качестве наполнителей были исследованы следующие виды растительных материалов: древесные опилки, подсолнечная лузга, оболочки семян гречихи.
Измельчение исходного древесного материала осуществляли с использованием лабораторной шаровой мельницы. Разделение на фракции проводили методом сит с величиной отверстий от 0,25 до 5 мм. В качестве связующего использовали вторичный полиэтилен (ВПЭ) по ТУ 63-473-32-90. Изготовление прессованных композитов на основе ВПЭ и древесных частиц осуществлялось методом прессования в специально разработанных пресс-формах с формующими прокладками при ограниченном контакте с кислородом воздуха [4]. В сравнении с плоским прессованием изготовление образцов осуществлялось поршневым экструзионным методом с предварительным смешением ингредиентов в шнековом смесителе. Для определения физико-механических свойств образцы изготавливали с соблюдением требований ГОСТ 14359–69 и ГОСТ 26277.
© Глазков С.С., 2013
100
