
3440
.pdf
Научный Вестник Воронежского государственного архитектурно-строительного университета
УДК 541.11
Г.В. Славинская, О.В. Куренкова, В.С. Трифонов
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ ВЕЩЕСТВ, СНИЖАЮЩИХ ВОДОПРОНИЦАЕМОСТЬ ЦЕМЕНТНЫХ БЕТОНОВ
Рассчитаны параметры растворов, характеризующие количество воды, средний свободный молярный объем пустот, количество замещенных моль воды при растворении электролитов, степень сжатия воды. Предполагается, что наименьшей водопроницаемостью обладают бетоны, пропитанные растворами солей, в которых больше свободного объема и меньше воды.
Ключевые слова: растворы электролитов, свойства, бетоны, водопроницаемость
G.V. Slavinskaya, O.V. Kurenkova, V.S. Trifonov
PHYSICOCHEMICAL PROPERTIES OF SOLUTION OF THE SUBSTANCES REDUCING WATER PERMEABILITY OF CEMENT CONCRETES
The parameters of the solution, characterizing the amount of water, the average free volume of voids, the amount of the substituted mole of water when dissolved electrolytes compression water. It is assumed that the lowest permeability for concrete, impregnated with solutions of salts, which contain less amount of free water.
Keywords: electrolyte solutions, properties, concrete, water permeability
Введение. Долговечность бетонов, которые эксплуатируются в условиях контакта с водой и действия знакопеременных температур, зависит от пористости цементного камня. Чем она меньше, тем дольше строительные конструкции сохраняют свои прочностные характеристики и устойчивость к замораживанию и высушиванию. Особенно важной является низкая водопроницаемость для мостовых, берегоукрепительных, канализационных, водопропускных и очистных сооружений, бетонных сооружений, соприкасающихся с подземными и поверхностными водами [1].
Для снижения водопроницаемости цементных бетонов и изделий из них ГОСТ [2] предусматривает составы гидроизоляционных смесей, которые предназначены для заполнения пор и небольших изъянов в готовых конструкциях. Смысл таких добавок заключается в том, что растворенное в воде вещество в результате осмотических явлений проникает в поры цементного камня и образует с его компонентами трудно растворимые кристаллогидраты, которые заполняют свободный объем пор, тем самым препятствуя проникновению воды извне. Это приводит к уменьшению водопроницаемости конструкций, тем самым увеличивая их устойчивость к действию воды и перепада температур.
Для решения этой проблемы исследователи испытывают разные вещества, которые, на наш взгляд, выбирают без теоретического обоснования, скорее всего эмпирическим путем [1, 3]. Такие вещества могут взаимодействовать с Са(ОН)2, образуя сложные соединения, в состав которых входят в разной комбинации Al2O3, CaO, CaCO3, CaSO4 2H2O, CaCI2 10H2O, Ca(NO3) 14-16H2O и т.д. [1]. Можно предположить, что не все количество израсходованного вещества вступает во взаимодействие с компонентами цементного камня. Каковы структура и свойства внутрипорового раствора в этом случае?
© Славинская Г.В., 2013
11
Научный Вестник Воронежского государственного архитектурно-строительного университета
Такой анализ можно провести, используя концентрационную зависимость плотности растворов от концентрации и температуры, рассчитав некоторые параметры.
Теоретическая часть. Установлено, что вода представляет собой единую, трижды координированную сетку водородных связей, в узлах которой располагаются молекулы воды [4]. В структуре воды имеются полости диаметром 0,156 нм, которые могут заполняться как молекулами воды, так и ионами или молекулами, если нет стерических препятствий. Причем каркас водородных связей сохраняется и в довольно концентрированных растворах [5]. Согласно [6], растворы организуются по типу внедрения и замещения. Возможен смешанный вариант, когда одна часть ионов располагается в пустотах, другая замещает молекулы воды в каркасе. Этот способ образования раствора реализуется, когда радиус одного из ионов меньше 0,156 нм, другого – больше этой величины.
Идею заполнения пустот в ажурном каркасе воды свободными молекулами Н2О выдвинул Самойлов еще в 1946 г [4]. Позднее эта модель была рассмотрена Форшлингом [7], который установил степень заполнения пустот равной 16 % при 273 К. По данным Крестова она составляет 31,7 % при 293 К [8]. По расчетам Лященко в интервале температур 283-333 К в чистой воде и свободной воде раствора электролита степень заполнения пустот молекулами Н2О примерно одинакова и укладывается в диапазон =0,2-0,3 [5]. В результате рентгеновских исследований Андриановой и Фишером [9] получены близкие (0,15-0,33) значения при 273-353 К. Из этих данных следует, что до 30 % полостей в структуре свободной воды раствора вакантны.
Вопрос заполнения пустот в ажурном каркасе воды не только молекулами Н2О, но и другими растворенными частицами, обсуждали и развивали применительно к неэлектролитам и электролитам многие исcледователи [5, 6, 8-10]. Авторы статьи [11] считают, что чистая вода по сравнению с растворами имеет более ажурную структуру. К этому выводу они пришли на основании того, что внешние воздействия, например наличие твердой фазы, искажает структуру прилегающих областей раствора и изменяет долю свободных пустот в сторону увеличения. Так как вода обладает наиболее ажурной конструкцией, то, по мнению [11], в растворах априори пустот должно быть меньше, чем в чистой воде.
Это чрезвычайно важное свойство, так как для перехода кинетической единицы из ионита в раствор необходимо свободное место в его структуре. Высказанная в [11] мысль о наиболее ажурной структуре воды и роли полостей в обмене ионов была нами проверена на примере растворов соединений щелочных металлов. При этом мы исходили из следующих соображений.
Согласно современным представлениям, льдоподобная структура воды является той матрицей, на которой в растворе развертываются все межчастичные взаимодействия [4]. При этом образованный сеткой водородных связей каркас остается достаточно устойчивым. Ионы, а также сформировавшиеся аквачастицы, встраиваются в водную матрицу и становятся элементами единой структуры.
Количество воды в растворах. Нами ранее показано, что о характере раствора (тип
внедрения или замещения) можно судить по количеству воды (Срω) в растворе |
[12, 13]. Его |
можно рассчитать по уравнению: |
|
Срω= ( раств. 1000 - cэ Мэ) : 18, моль/л, |
(1) |
где раств. – плотность раствора вещества, г/см3; cэ – концентрация вещества в растворе, моль/л;
Мэ – молярная масса вещества, г/моль.
Если количество воды в растворе меньше, чем таковое в таком же объеме чистой воды при той же температуре, значит часть молекул воды замещена ионами – имеет место
12
Научный Вестник Воронежского государственного архитектурно-строительного университета
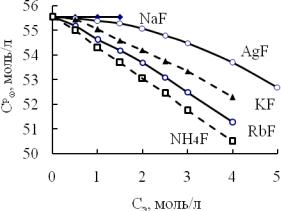
раствор замещения. Если количество воды такое же, можно предположить, что ионы разместились в вакантных полостях каркаса водородных связей - образовался раствор по типу внедрения. Сказанное иллюстрирует рис. 1.
Рис. 1. Зависимость содержания воды в растворах электролитов от их концентрации
Из положения кривых следует, что в растворе NaF при 298 К количество воды (Cpw) такое же, что и в чистой воде (C0 =55,55 моль/л). Следовательно, оба иона при растворении занимают полости в структуре воды. Фториды всех других щелочных металлов располагаются по смешанному принципу образования раствора.
Количество моль воды, замещенных молекулами растворенного вещества, равно:
С |
|
/с = {С0 |
|
- [( |
1000 - c |
М |
):18]}: с |
э |
(2) |
|
э |
раств. |
э |
э |
|
|
где С /сэ, моль Н2О/ моль электролита; С0 - количество моль Н2О в 1 л чистой воды при данной температуре, моль/л;
раств. – плотность раствора вещества, г/см3; 18 – молярная масса воды, г/моль.
Свободный объем в растворах. В работе [11] авторы высказали мнение, что вода является более ажурной структурой, чем водные растворы. Степень ажурности или плотности структуры можно оценить, на наш взгляд, величиной свободного пространства, то есть суммарным объемом пустот в единице объема раствора. Этот объем целесообразно отнести к одному моль вещества в растворе, включая воду: Vf, см3/моль [12-13].
Величина V f ‒ это разность между объемом раствора V p (см3) и объемом всех находящихся в нем частиц v (см3), отнесенная к общему содержанию всех компонентов,
включая воду ( с , моль): |
|
|
|
Vf Vp v / с . |
|
|
|
|
|
|
|
|
|
|
|
|
|
Для расчета величины V |
f |
удобно исходить из объема раствора V |
p |
1000 см3: |
||||
|
|
|
|
|
m |
|
|
|
|
|
Vf |
1000 срастvраст |
сivi / с , |
|
(3) |
||
|
|
|
|
|
i 1 |
|
|
|
13
Научный Вестник Воронежского государственного архитектурно-строительного университета
где сi , сраст
объем частиц
‒ содержание вещества и растворителя (моль), а vi , v раст растворенного вещества и молекул растворителя, см3/моль.
|
|
c |
i |
|
|
|
|
100 c |
i |
|
|
|
|||
|
1000 10d |
|
vi |
|
|
|
|
|
v |
раст |
|||||
|
|
|
|
M раст |
|
|
|||||||||
|
M i |
|
|
|
|
|
|
|
|
||||||
V f |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
c |
i |
|
100 c |
i |
|
|
|
|
|
||||
|
|
|
|
|
|
||||||||||
|
10d |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
M i |
|
|
M раст |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Геометрический объем (см3/моль) ионов растворенного вещества:
‒ геометрический
(4)
vi |
4 |
rк3 |
rа3 N A , а растворителя: |
v раст |
4 |
rраст3 |
N A , |
|
|
|
|||||
3 |
|
|
|
|
|||||||||||
|
|
|
i |
i |
|
|
3 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где rк , ra , vраст - |
|
радиусы катиона и |
аниона |
растворенного |
вещества |
и |
молекул |
||||||||
растворителя, см; |
N |
A |
- число Авогадро (6,023 1023) моль-1. |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Значение |
V o |
|
воды |
зависит |
от |
температуры и степени |
заполнения |
пустот |
|||||||
|
f |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
молекулами Н2О. В интервале температур 273-373 К величина |
V fo |
равна |
11,37-12,16 |
||||||||||||
см3/моль. Объем молекул воды ( r |
1,38 10 8 см) в одном ее моле постоянен: v |
H 2O |
=6,63 |
||||||||||||
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
|
|
|
см3/моль. Отсюда следует, что коэффициент упаковки молекул воды при 0 оС=0,368. То есть примерно 73 % объема воды – пустоты структуры.
Для расчета |
V f |
водных |
растворов в |
результате подстановки в |
уравнение (4) |
||||||||||||
значений v раст vН |
О =6,63 см3/моль и M раст |
М Н |
О =18,00 г/моль получено выражение |
||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
(5) [13]: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
1000 |
10dc |
v |
3,683d 100 c |
|
|
|||||||||
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
Mi |
|
i |
|
|
|
|
|
|||
|
|
Vf |
|
|
|
|
|
|
|
|
|
|
(5) |
||||
|
|
|
10dc |
0,555d 100 c |
|
|
|||||||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
Mi |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
где d – плотность раствора вещества при данной температуре, г/см3; |
|
||||||||||||||||
с - массовая доля вещества, %; Мi |
- молярная масса растворенного вещества, |
моль/л. |
|||||||||||||||
Расчеты среднего свободного объема показали, что раствор может быть по структуре |
|||||||||||||||||
как более ажурным, так и менее ажурным чем структура воды (рис. 2, 3). |
|
||||||||||||||||
Согласно данным рис. 2, растворы соединений натрия имеют более плотную |
|||||||||||||||||
упаковку, чем сама |
вода. |
|
Причина |
– заполнение |
|
катионами вакантных полостей в |
|||||||||||
структурной сетке воды. |
Это возможно в связи с тем, |
что ионы Na+, ОН-- и F-- ионы имеют |
|||||||||||||||
радиусы 0,098; 0,143; 0,133 нм [14], что позволяет им встраиваться в пустоты с радиусом 0,156 нм. Такая же зависимость V f для растворов LiOH - кривая расположена между кривыми 1 и 2 (рис. 2), и практически накладывается на кривую 1 для растворов NaF, и нами не приведена на обсуждаемом рис. 2. Поэтому значение V fo воды при растворении
веществ уменьшилось, в результате этого Vfр <V fo .
Но структура раствора может быть более ажурной, чем структура воды. Такая ситуация возникает в том случае, если образуется раствор по типу замещения молекул воды молекулами или ионами других веществ. Как показали наши расчеты [12], замещающими частицами могут быть не только ионы или молекулы, размеры которых превышают радиус полостей. Например, ионы калия (радиус 0, 133 нм) могли бы все встраиваться в полости,
14
Научный Вестник Воронежского государственного архитектурно-строительного университета
однако только часть их замещает молекулы воды в структуре системы, остальные внедряются в вакантные пустоты. В такой ситуации ажурность воды, тем не менее, возрастает, например как показано на рис. 3.
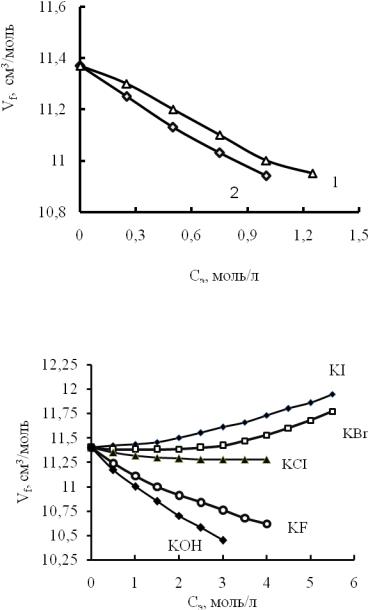
Рис. 2. Зависимость свободного среднего молярного объема от концентрации растворов солей: 1 - NaF; 2-NaOH
Рис. 3. Свободный средний молярный объем в растворах солей калия
взависимости от их концентрации
Врастворах KI и KBr (рис. 3) происходит разрыхлении структуры за счет замещения молекул воды ионами солей, то есть это растворы замещения. В растворах внедрения (KF и KOH) структура менее ажурна, чем структура чистой воды, так как не только часть ионов калия, но также фторид- и гидроксид-ионы размещаются в полостях структуры воды. В
растворах КCI пустот немного меньше, чем в чистой воде:Vfр <V fo . По нашим расчетам
хлорид-ион встраивается в структуру воды, вытесняя одну молекулу воды, при этом он частично занимает некоторую долю сводного пространства. Но при таком способе
15
Научный Вестник Воронежского государственного архитектурно-строительного университета
вхождения в воду концентрация частиц в воде не изменяется, так как происходит замещение одной молекулы воды одним хлорид-ионом.
Степень сжатия воды в растворах электролитов. Ионы имеют определенный заряд,
поэтому в растворах происходит сжатие молекул воды в их электрическом поле за счет
явления электрострикции [15, 16]. |
Чем сильнее сжатие, |
тем больше воды должно быть в |
||||||||||||||
растворе. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для оценки сжимаемости |
воды |
в растворах Здановский А.Б. |
[17] |
предложил |
||||||||||||
величину относительного сжатия ( V/V) воды при введении некоторого ее количества в |
||||||||||||||||
раствор электролита концентрации с1. |
Искомая величина, представляющая собой степень |
|||||||||||||||
сжатия добавленной воды: |
|
|
c2 Ho 2O 1 2 |
|
|
|
|
|
|
|||||||
|
V |
1 |
|
Ho 2O |
|
(6) |
||||||||||
|
V |
c |
c |
2 |
|
1 |
|
2 |
|
|
2 |
|
|
|||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
||||
где с1 и с2 – массовая доля электролита (%), причем с1>с2; 0, 1 |
и 2 |
– плотность |
||||||||||||||
добавленной воды, исходного и конечного растворов. |
|
|
|
|
|
|
|
|
|
|
||||||
Здесь V ,% 100 V /V.
Экспериментальная часть. Для характеристики солей, которые предположительно могут использоваться или используются для снижения водопроницаемости бетонов (NaCI, Na2CO3, Na2SO4, NaNO3, AI2(SO4)3) [1, 3] рассчитаны указанные параметры.
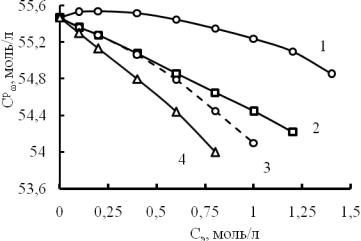
По уравнению (1) рассчитали и сопоставили количество воды при разном содержании данных электролитов в растворах (рис. 4).
Рис. 4. Содержание воды в растворах солей разной концентрации:
1- Na2CO3; 2 - NaCI; 3 - Na2SO4; 4 - NaNO3
На рис. 4 выявляется не уменьшение, а увеличение содержания воды в растворе Na2CO3 в интервале концентраций, ограниченных цифрой 0,75 моль/л. В данном случае очевидно, что карбонат-ион радиусом 0,185 нм не может размещаться в полостях структуры воды. Тогда нужно допустить, что в разбавленных растворах этот анион вытесняет, то есть замещает молекулы воды в каркасном положении. Даже если замещение осуществляется в соотношении 1:1, то в растворе, содержащем, например 0,5 моль/л, должно стать воды на 0,5 моль меньше. Но ее становится больше, чем было в чистой воде до растворения соли Na2CO3. Даже если предположить, что какая-то доля молекул воды вытеснена карбонат-
16
Научный Вестник Воронежского государственного архитектурно-строительного университета
анионами из раствора в континуум, трудно себе представить, что этот объем компенсируется за счет электрострикции молекул воды двумя катионами натрия и самим анионом. Поэтому данный факт, на наш взгляд, можно объяснить тем, что карбонат-ионы, частично располагаются между слоями воды. Так как в молекуле карбоната натрия два иона натрия, вместе с карбонат-ионом они обусловливают значительный электрострикционный эффект, поэтому в разбавленных растворах количество воды больше или равно таковому в чистой воде. При увеличении концентрации соли в растворе образовавшиеся аква-комплексы, включающие ионы соли и гидратную воду, становятся менее комплементарными, поэтому происходит вытеснение молекул воды, но в незначительном количестве: один моль ионов вытесняет примерно 0,25 моль воды.
Врастворах NaCI один моль замещает один моль воды независимо от концентрации соли (рис. 4, кривая 2). В данном случае ионы натрия локализуются в пустотах, а хлоридионы вытесняют молекулы воды в континуум. Поэтому в растворе NaCI воды меньше, чем в растворах Na2CO3.
Врастворах Na2SO4 и NaNO3, судя по рис. 4, воды еще меньше. Это может быть только в том случае, если данные соли образуют растворы замещения. Чтобы это предположение подтвердить и выяснить количество моль воды, замещаемых одним моль
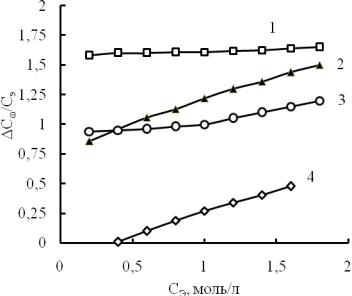
солей, рассчитали величину С /Сэ для растворов. Данные представлены на рис. 5.
Рис. 5. Зависимость количества вытесненной воды от концентрации солей:
1 - NaNO3; 2 - Na2SO4; 3- NaCI; 4 - Na2CO3
Кривые на рис. 5 расположены в порядке, обратном порядку расположения кривых на рис. 4. Действительно, чем больше замещено ионами растворенной соли молекул Н2О, тем меньше в растворе воды. То есть по этому параметру лучшими солями, снижающими водопроницаемость бетонов должны быть соли сульфат- и нитрат натрия. Но в растворах нитрата натрия мало воды потому, что много вакантных пустот; в растворах же сульфата натрия мало воды из-за того, что тетраэдрические сульфат-ионы заполняют часть полостей и вытесняют молекулы воды. То есть растворы этих солей должны значительно отличаться величиной свободного среднего молярного объема.
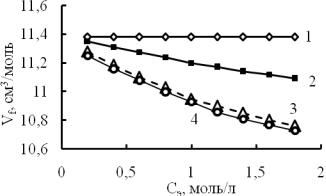
По уравнению (5) рассчитан свободный средний молярный объем в растворах солей (рис. 6) по концентрационным зависимостям их плотности при температуре 298 К [18, 19].
Положение кривых на рис. 6 свидетельствует о том, что в растворах NaNO3 свободный средний молярный объем равен таковому в чистой воде, то есть вода и данный
17
Научный Вестник Воронежского государственного архитектурно-строительного университета
раствор обладают одинаковой степенью ажурности. Менее ажурная структура определяется в растворе NaCI (кривая 2, рис. 6). Растворы ионов натрия в сочетании с двухзарядными сульфат- и карбонат-ионами представляют собой более уплотненную структуру, чем растворы вышеупомянутых солей и самой воды. То есть в растворах NaNO3 мало воды и много свободного пространства, в то время как в растворах карбоната натрия много воды и мало свободного пространства (рис. 4 и 5).
Рис. 6. Зависимость среднего свободного объема от концентрации солей:
1 – NaNO3; 2- NaCI; 3- Na2SO4; 4- Na2CO3
Представляется интересным факт сильного различия свойств растворов солей NaNO3 и Na2CO32. Анионы NO3- и CO32- - это плоские ионы треугольной конфигурации [20]. Кроме того они имеют близкий размер ионов: 0,181 и 0,189 нм.
Можно предположить, что нитрат-ион располагается не между слоями воды, как карбонат-ион, а в растворе вращается вокруг связи Na-NO3, при этом замещая молекулы воды в каркасе, занимая большой объем пространства и сильно разрыхляя структуру системы. Карбонат-ион не может совершать вращательных движений, так как он соединен двумя связями с двумя ионами натрия, при этом в поле двух ионов натрия должна проявляться заметная электрострикция гидратных молекул воды. Подтверждением такого
поведения анионов можно считать значения изменения энтропии S`II, которая |
||
характеризует изменения структуры воды при гидратации ионов. Так, для NO3- - ионов |
||
величина S`II= + 2,2 э.е., для СО32-: S`II= - 44,6 э.е., что означает |
рост |
степени |
неупорядоченности в растворе в присутствии ионов NO3- - ионов, |
и |
сильное |
структурирование воды в растворах с СО32- -ионами (э.е. – энтропийные единицы [8]). |
||
Электрострикция молекул воды в поле ионов обусловливает сжатие воды. |
С целью |
|
оценки влияния вида катиона на относительное сжатие воды значения V/V нами ранее были рассчитаны для растворов хлоридов щелочных металлов [15]. Кроме того, влияние на степень сжатия температуры рассмотрено на примере растворов NaCI при 273-353 К. Выбор этих солей обусловлен тем, что CI--ионы практически не искажают структуру Н2О.
Установлено, что последние располагаются в каркасе ее трехмерной тетраэдрической структуры [15, 21] и не приводят к существенному изменению ближней упорядоченности последней. Слабое влияние CI--ионов на воду подтверждается незначительным изменением энтропии ( S`II = +1,5 э.е.), характеризующей структурную перестройку Н2О в присутствии иона [8], а также термодинамическими расчетами [22]. На основании сказанного, отличия в свойствах выбранных растворов могут быть с полным правом отнесены только к влиянию на воду катионов.
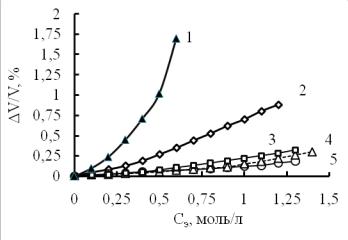
Степень сжатия воды в растворах рассчитана по уравнению (6). Результаты расчетов представлены на рис. 7.
18
Научный Вестник Воронежского государственного архитектурно-строительного университета
Оказалось, что наиболее сильно сжимаются молекулы воды в растворах Al2(SO4)3. Это ожидаемый результат, так как в молекуле два трехзарядных иона алюминия и 3 сульфатаниона, причем изменение энтропии при встраивании одного иона S`II = - 30 э.е.
Рис. 7. Зависимость степени сжатия воды в растворах солей:
1- Al2(SO4)3; 2 - Na2SO4; 3 - Na2CO3; 4 - NaNO3; 5 – NaCI
Значительна степень сжатия также в растворах Na2SO4. В растворах этой соли мало вакантных пустот, так как тетраэдрический сульфат-ион встраивается не только замещая молекулы воды в каркасе, но и заполняя полости. Но процесс электрострикции имеет место, поэтому молекулы гидратной воды должны сильно уплотняться в связи с отсутствием достаточного объема в структуре воды.
Следует отметить следующее. По уравнению (6) можно рассчитать относительное сжатие воды в растворе с принятой массовой долей растворенного вещества при добавлении к нему определенного объема воды. В начальном состоянии ионы вещества уже гидратированы, то есть электрострикция уже завершилась. При добавлении воды сжимается только эта вода. Степень сжатия этой воды и рассчитывается.
Выводы. Исследования, проведенные в [1], показали, что наиболее водонепроницаемыми являются образцы бетонов, поры которых заполнены растворами солей Na2SO4 и NaNO3. Они отличаются от других солей тем, что, образуя растворы замещения, уменьшают содержание воды в растворе. Чем меньше воды, тем больше доля гидратных молекул от общего количеств молекул воды в порах твердой фазы. Такая вода выдерживает перепады температур, так как гидратная вода обладает большей плотностью и более низкой температурой замерзания, чем вода свободная.
На основании полученных результатов можно сделать вывод: менее водопроницаемыми являются бетоны, обработанные растворами солей, в структуре которых меньше воды. Если сказанное действительно является решающим фактором, обусловливающим меньшую водопроницаемость бетонов, то можно предположить, что более заметный положительный эффект должен быть получен при использовании солей, образующих растворы замещения, в которых при этом становится меньше воды, чем в таком же объеме чистой воды. Для выявления таких солей было рассчитано количество моль воды, вытесняемых при растворении разных электролитов. Оказалось, что имеются соли, при
растворении которых замещается несколько моль воды. |
Например, в растворах солей |
(NH4)2SO4, NH4CNS, Fe2(SO4)3, SnCI4, Fe(NO3)3, ZnI2 и |
др. с концентрацией 1 моль/л |
вытеснены 3,2 моль Н2О/моль соли. До 4-х моль воды вытесняется при растворении Cs(SO4)2. Возможно, именно эти соли в состоянии уменьшить водопроницаемость бетонов, однако для подтверждения этого вывода требуется экспериментальная проверка
19

Научный Вестник Воронежского государственного архитектурно-строительного университета
Список литературы
1.Бровкина Н.Г. Повышение водонепроницаемости и морозостойкости цементных бетонов пропиточными солевыми растворами. – Автореф. дисс. …канд. техн. наук. – Новосибирск, 2012. - 18 с.
2.ГОСТ 31189-2003 «Смеси сухие строительные. Классификация».
3.Овчаренко Г.И., Бровкина Н.Г., Быков В.Г., Изосимов М.П. Роль солей в составах гидроизоляции проникающего действия для бетонов // Известия вузов. Строительство. –
2010. – С. 28-34.
4.Самойлов О.Я. Структура водных растворов электролитов и гидратация ионов. - М: Изд-во АН СССР, 1957. - 182 с.
5.Лященко А.К. Размещение ионов и гидратных комплексов в структуре водного раствора // Журн. структур. химии. - 1968. - Т. 9, № 3. - С. 760-768
6.Измайлов Н.А. Электрохимия растворов. - М.: Химия, 1976. - 488 с.
7.Forsling E. // Acta Politech. - 1952. - №. 5. - P. 9.
8.Крестов Г. А. Термодинамика ионных процессов в растворах. - Л.: Химия, 1973. -
304 с.
9.Фишер И.Э. О степени заполнения пустот в квазикристаллической структуре воды // Журн. структурной химии. - 1966. - Т. 7, № 3. - С. 337-341.
10.Маленков Г.Г. Геометрические аспекты явления стабилизации структуры воды молекулами неэлектролитов // Журн. структурн. химии. - 1966. - Т. 7, № 3. - С. 331-336.
11.Яшкичев В.Н., Дергачев Ю.М. Ионный обмен в рамках коллективного движения молекул воды // Журн. физ. химии. - 1990. - Т. 64, № 5. - С. 1294-1298.
12.Славинская Г.В. Моделирование структуры водных растворов фтористых соединений // Журн. физ. химии. - 2001. - Т. 75, № 9. - С. 1600-1605.
13.Славинская Г.В. Влияния вида коиона на десорбцию фульвокислот из анионита // Сорбционные и хроматографические процессы. - 2002. - Т. 1. - Вып. 1. - С. 243-252.
14.Краткий справочник физико-химических величин / Под. ред. А.А. Равделя и А.М. Пономаревой. - Л.: Химия, 1983. - 232 с.
15.Лященко А. К. Физическая химия растворов / Под ред. О.Я. Самойлова. - М.: Наука, 1972. - С. 5-12.
16.Робинсон Р., Стокс Р. Электролиты. - М.: ИЛ., 1963. - 646 с.
17.Здановский А.Б. // Журн. физ. химии. - 1984. - Т. 58, № 3. - С. 775.
18.Справочник химика. Второе издание. Л.: Химия. - 1964. - Т. 3. - С. 504.
19.Техническая энциклопедия. Справочник физических, химических и технологических величин. - М.: Советская энциклопедия. - 1930. - С.194 - 215.
20.Турова Н.Я. Таблицы по курсу неорганической химии. – M.: МГУ, 1971. – 43 с.
21.Лященко А.К. // Журн. структур. химии. - 1992. - Т. 66. - № 1. - С. 167.
22. Мищенко К.П., Полторацкий Г.М. Термодинамика и строение водных и неводных растворов электролитов. - Л.: Химия, 1976. – 328 с.
Славинская |
Галина |
Владимировна |
|
- |
д.х.н., |
профессор |
кафедры |
химии |
Воронежского государственного |
архитектурно-строительного университета. Е-mail: slavgv@mail.ru. |
|
||||||
Куренкова Ольга Валерьевна |
- к.х.н., ст. препод. |
|
кафедры |
химии Воронежского государственного |
||||
архитектурно-строительного университета. Е-mail: kovov84@mail.ru. |
|
|
|
|||||
Трифонов Владислав Сергеевич – студент 1 |
курса факультета инженерных сетей и сооружений |
|||||||
Воронежского государственного |
архитектурно-строительного университета. |
|
|
|||||
20
