
Биотехнология природного альфа-интерферона и лекарственные формы на
..pdf
Основываясь на результатах исследований С. Bogedain с соавторами [88] о возможности использования мембранных фильтров с разным размером пор для разделения вирусов различной величины, а также широком использовании ультрафильтрации для концентрирования микробных клеток в условиях крупномасштабного производства, мы провели исследования по определению оптимальных условий концентрации вируса Сендай путем ультрафильтрации на установке «Сартакон-мини» (рис. 4).
Рис. 4. Установка «Сартакон-мини»
Фильтрацию проводили через мембранные полисульфоновые пластины с номинальным отсечением в 300 кд при скорости перистальтиче- ского насоса, равной 170 об/мин, и давлении 0,1–0,2 МПа, номинальная площадь фильтрации соответствовала 0,1 кв.м. Предварительно вируссодержащую аллантоисную жидкость пропускали через фильтрующие пластины «Cuno LP 60», а затем проводили концентрирование фильтрата с помощью вышеуказанных пластин по объему в 5 раз. В ходе всего эксперимента полученный концентрат вируса, а также фильтраты оценивали по гемагглютинирующей активности в РГА, содержание белка по Лоури и овальбумина – в РНГА.
Очистку концентрата вируса Сендай осуществляли диафильтрацией, то есть путем промывания вируссодержащей взвеси за счет непрерывной подачи свежего растворителя при постоянном рабочем объеме. При этом концентрация задержанных надмембранных веществ не возрастает, так как они непрерывно разбавляются свежим буферным рас-
41
твором. С целью эффективной очистки концентрата вируса Сендай для диафильтрации использовали стерильный фосфатный буфер в объеме, равном пятикратному объему исходного концентрата.
При ультрафильтрации вируса Сендай происходит удаление ФБР
èнизкомолекулярных соединений через мембранные пластины, тогда как вирус и сопутствующие высокомолекулярные вещества концентрируются над мембранами. Процесс ультрафильтрации осуществляется следующим образом: из модуля откачивают стерильную воду
èзатем заполняют его стерильным ФБР. В мерную бутыль стерильно вносят осветленную вируссодержащую взвесь в объеме 1500 мл и че- рез систему сифонов соединяют с входным концом шланга модуля. Выходной шланг фильтрата опускают в бутыль для сбора. При вклю-
чении насоса фильтруемую вируссодержащую взвесь из бутыли с ВАЖ по входному шлангу закачивают в модуль, и она, пройдя через мембраны, по выходному шлангу поступает снова в мерную бутыль. Концентрацию ВАЖ осуществляют до тех пор, пока объем концентрата не достигает 300 мл. После каждой отмывки концентрата для анализа отбирают пробы как надмембранных (концентрат), так и подмембранных (фильтрат) фракций. Полученные результаты представлены в табл. 6. Контролем служили качественные показатели исходного образца ВАЖ. Полученные результаты свидетельствуют о том, что показатели удельной гемагглютинирующей активности надмембранной фракции вируса Сендай после 4-й и 5-й отмывки ФБР не имеют статистически достоверных отличий.
Сочетание метода диафильтрации для очистки ВАЖ и ультрафильтрации с целью концентрирования вируса позволяет не только повысить удельную гемагглютинирующую активность вируса Сендай в 26,76 раза (139405,9 ГАЕ/мг белка против 5209,3 ГАЕ/мг исходных показателей ВАЖ), но и сконцентрировать его в 12,57 раза, исходя из уровня ГАА вируса Сендай в надмембранной фракции после 4-го отмывания, равной 140800 ГАЕ/мл и исходным значением активности ВАЖ 11200 ГАЕ/мл.
Сопоставительный анализ результатов экспериментов, проведенных по очистке и концентрации вируса Сендай методом центрифугирования ВАЖ при 10000 об/мин и диаультрафильтрации, показал более высокую эффективность последнего, благодаря которому достигается высокая очистка и концентрация вируса Сендай.
42
|
|
|
|
|
Ò à á ë è ö à 6 |
|
Оценка эффективности концентрации вируса Сендай методом ультрафильтрации |
||||||
вируссодержащей аллантоисной жидкости |
|
|
||||
|
|
|
|
|
|
|
|
|
Качественная характеристика полученных фракций |
|
|||
Исследуемые фракции |
Уровень гемагглютини- |
Кратность |
Содержание бел- |
Удельная ГАА |
Количество ОВА, |
|
концентрации по |
предельно допусти- |
|||||
ÂÀÆ |
||||||
рующей активности, |
отношению |
êà, |
вируса, ГАЕ/мг |
мое значение |
||
|
||||||
|
ÃÀÅ/ìë |
ìã/ìë |
белка |
|||
|
к контролю |
0,03íã/ìë |
||||
|
|
|
|
|||
Исходный образец ВАЖ |
11200,0 |
- |
2,2 0,02 |
5209,3 |
0,05 |
|
Сконцентрированный исходный ма- |
179200,0 31350,0** |
16 |
2,3 0,05* |
77241,4 |
0 |
|
териал в 5 раз |
|
|
|
|
|
|
Надмембранная после 1-й отмывки |
89600,0 |
8 |
1,8 0,02 ** |
50621,5 |
0 |
|
|
|
|
|
|
||
Подмембранная после 1-й отмывки |
0 |
0 |
1,1 0,04** |
0 |
0 |
|
Надмембранная после 2-й отмывки |
70400,0 15680,0** |
6,2 |
1,4 0,02** |
52148,1 |
0 |
|
Подмембраннаяпосле 2-й отмывки |
0 |
0 |
0,8 0,04** |
0 |
0,078 |
|
Надмембраннаяпосле 3-й отмывки |
70400,0 23520,0* |
6,2 |
1,0 0,03** |
52148,1 |
0 |
|
Подмембранная после 3-й отмывки |
0 |
0 |
0,5 0,07** |
0 |
0,078 |
|
Надмембраннаяпосле 4-й отмывки |
140800,0 31350,0* |
12,57 |
1,0 0,03** |
69702,97 |
0 |
|
Подмембранная после 4-йотмывки |
0 |
0 |
0,5 0,07** |
0 |
0,05 |
|
Надмембранная после 5-й отмывки |
140800,0 31350,0* |
12,5 |
0,9 0,02** |
142222,2 |
0 |
|
Подмембранная после 5-й отмывки |
0 |
0 |
0,4 0,01** |
|
0,03 |
|
43
* р <0,05; ** р <0,005 по отношению к исходному образцу вирусаллантоисной жидкости.
Таким образом, на основании результатов проведенных исследований нами определены оптимальные условия концентрации и очистки аллантоисной культуры вируса Сендай, как то: очистка в режиме диафильтрации с использованием мембраны с ретенцией 300 кД при скорости пропускания перестальтического насоса 170 об/мин; 4-кратное промывание ВАЖ при общем объеме диализирующего раствора 1500 мл; концентрация вируса
â12,5 раза методом ультрафильтрации. В дальнейшем полученная очищенная и концентрированная культура вируса Сендай использовалась нами
âкачестве интерфероногена.
2.3.Разработка условий реакторного культивирования лейкоцитов, индуцированных вирусом Сендай
Для получения ЧЛИ используют различные фракции донорской крови: лейкоэритромасса, лейкотромбоцитарная масса (лейкомасса), клеточные гранулоцитарные фракции после лейкофереза методом непрерывного центрифугирования. Наибольшее количество интактных лейкоцитов, а следовательно, и увеличение выхода ИФН с одного донора возможно в случае использования лейкоэритромассы [52]. В лейкотромбоцитарной массе коли- чество лейкоцитов, как правило, несколько снижено. Это характерно также и для лейкоцитарных фракций после непрерывного центрифугирования, что, в свою очередь, ведет к уменьшению количества синтезируемого ИФН.
В связи с этим следующей задачей нашего исследования являлось определение оптимальных условий синтеза интерферона лейкоцитами донорской крови, индуцированных концентрированным и очищенным вирусом Сендай.
Как известно, наибольшее количество ИФН синтезируется донорскими лейкоцитами в суспензионной системе с более интенсивным перемешиванием по сравнению с роллерным или стационарным культивированием [71]. Это связано с тем, что клеточные культуры, находясь во взвеси, приближены к их физиологическому состоянию (отсутствует прилипание к стенкам стекла), максимально соприкасаются как с вирусными частицами индуктора, так и с питательными компонентами среды [69; 91; 93].
Оптимальные параметры суспензионного культивирования освобожденной от эритроцитов лейкоцитарной фракции определяли как на стадии «прайминг», так и на стадии синтеза интерферона. На стадии «прайминг» для донорских лейкоцитов в концентрации 20 млн клеток на мл питатель-
44

ной среды создавали условия суспензионного культивирования. В состав питатальной среды, кроме антибиотиков, были введены регламентированные компоненты: гормон-инсулин 40 ЕД/мл, а также и нативный неинактивированный ЧЛИ в концентрации до 100 МЕ/мл. Весь процесс осуществляли при температуре 37,0–38,0 oС в течение 60–90 мин.
Введение двухстадийного биосинтеза ИФН позволяет в дальнейшем провести смену питательной среды и освободиться от ряда добавок без риска их проникновения в лекарственную форму. Двухстадийность технологической схемы позволяет менять и белковый состав компонентов среды. Известно, что для биосинтетических процессов лейкоцитам необходима лишь часть плазмы, в частности альбумин. Остальные компоненты не существенны для данного процесса [49].
Эксперименты проводили на промышленной модели биореакторов (производства МПП «ТЕМП-1», Пермь) вместимостью 10 литров на стадии «прайминг» и 100 литров на стадии «биосинтез» (рис. 5). В данных реакторах перемешивание суспензионной культуры лейкоцитов осуществляется без образования застойных зон, благодаря чему снижается степень травмируемости клеток, особо чувствительных к механическому воздействию. рН питательной среды автоматически поддерживается на определенном уровне с помощью подачи воздуха, обогащенного кислородом, в воздушное пространство реактора.
Рис. 5. Биореактор, используемый в технологии интерферона
Нами были проведены сравнительные исследования по определению различных параметров культивирования лейкоцитов крови доноров: объема, температуры, рН, скорости перемешивания, в реакторном
45
и роллерном вариантах. В контрольном опыте аналогичную лейкоцитарную взвесь в объеме 5,0 л культивировали в 10,0-литровых бутылях на роллерах по регламентируемой технологии. Результаты проведенных экспериментов представлены в табл. 7.
В результате проведенных исследований нами определены оптимальные условия реакторного культивирования донорских лейкоцитов на стадии «прайминг»: объем праймируемой среды 7,0 л, температурный режим 37,5 0С, скорость оборотов активатора 35 об/мин, рН культуральной среды 7,5. Этот метод является альтернативным по сравнению со всеми режимами роллерного способа культивирования.
Ò à á ë è ö à 7
Оценка различных условий культивирования |
||||||
лейкоцитарной массы на стадии «прайминг» |
||||||
|
|
|
|
|
|
|
Способ |
Условия культивирования лейкоцитарной массы |
|
||||
культивирования |
Îáú¸ì |
Температура, |
|
Скорость перемеши- |
Суммарный выход |
|
|
|
|
||||
донорских |
ðÍ |
вания культуры, |
ÈÔÍ çà öèêë, ÌÅ |
|||
серии, л |
oÑ |
|||||
|
|
|||||
лейкоцитов |
|
îá/ìèí |
|
|||
|
|
|
|
|||
|
|
|
|
|
||
Реакторный |
3,0 |
37,0 |
6,7 |
25 |
12000 |
|
|
5,0 |
37,3 |
7,3 |
30 |
40000 |
|
|
7,0 |
37,5 |
7,5 |
35 |
56000 |
|
|
9,0 |
38,0 |
5,9 |
40 |
36000 |
|
Роллерный |
5,0 |
37,0 |
7,3 |
20 |
20000 |
|
|
5,0 |
37,5 |
6,9 |
22 |
20000 |
|
Следующим этапом являлось определение оптимальных условий синтеза ИФН. Результаты оценки эффективности реакторного способа культивирования клеточных культур представлены в табл. 8.
Ò à á ë è ö à 8
Сравнительная оценка эффективности культивирования лейкоцитарной массы в реакторе и с использованием роллеров на стадии синтеза интерферона
Способ |
Объем выхода ИФН за |
Активность ИФН, |
Суммарная активность |
|
цикл в литрах с единицы |
ИФН с единицы оборудова- |
|||
культивирования |
ÌÅ/ìë |
|||
оборудования |
íèÿ, ÌÅ/ìë |
|||
|
|
|||
Реакторный |
25,0-64,0 |
6000,0 632,5 |
150 000 000-256 000 000 |
|
Роллерный |
5,0-7,0 |
4400,0 400,0 |
22 000 000-28 000 000 |
46
Использование реакторной технологии позволило не только стандартизировать процесс синтеза ИФН (заданная температура, достаточное перемешивание, постоянство рН среды, возможность регулирования скорости вращения) и упростить технологию (удобный подсчет необходимых компонентов), но и предложить автоматическую систему контроля на период всего технологического процесса.
Следующим этапом наших исследований явилось определение оптимальных условий синтеза интерферона в условиях реакторного культивирования донорскими лейкоцитами. Нами исследованы следующие параметры синтеза: объем питательной среды при одномоментном синтезе интерферона, скорость перемешивания, создающая суспензионные условия культивирования клеточной взвеси, температура и рН во время синтеза ИФН, оптимальное время продукции лейкоцитами ИФН, а также изменение температуры и рН культуральной среды при выгрузке после завершения биосинтеза ИФН. Результаты данных исследований представлены в табл. 9.
Ò à á ë è ö à 9
Оптимальные параметры синтеза интерферона донорскими лейкоцитами при реакторном способе проведения стадии синтеза
Основные параметры стадии синтеза ИНФ |
Оптимальные значения основных параметров |
|
стадии синтеза ИФН |
||
|
||
Максимальный объем синтеза, л |
60,7 2,94 |
|
Минимальный объем синтеза, л |
27,9 1,50 |
|
Скорость, об/мин |
36,4 4,32 |
|
Òî при загрузке |
37,14 0,09 |
|
рН при загрузке |
7,3 0,05 |
|
Время синтеза, ч |
18,6 0,27 |
|
Òî при выгрузке |
37,2 0,07 |
|
рН при выгрузке |
7,2 0,09 |
Сравнительный анализ качественных показателей полуфабриката ИФН, полученного в условиях реакторного культивирования лейкоцитов, индуцированных концентрированным и очищенным вирусом Сендай, показал, что данный метод позволяет получить полуфабрикат ИФН не только с достаточным уровнем (не менее 6000 МЕ/мл) противовирус-
47
ной активности, но и с достаточно низким (2,8 мг/мл) содержанием белка и овальбумина (на уровне контроля) (табл. 10).
Ò à á ë è ö à 1 0
Оценка влияния способа биосинтеза на качественные показатели синтезированного лейкоцитарного интерферона
|
Уровень проти- |
|
Удельная |
Количество |
Суммарная ак- |
|
Условия |
вовирусной ак- |
|
противовирус- |
овальбумина, |
||
Содержание |
тивность ИФН |
|||||
проведения |
тивности синте- |
ная активность |
предельно до- |
|||
белка, мг/мл |
с единицы обо- |
|||||
биосинтеза |
зированного |
|
ÈÔÍ, ÌÅ/ìã |
пустимое зна- |
рудования, МЕ |
|
|
ÈÔÍ, ÌÅ/ìë |
|
белка |
чение 0,03 |
|
|
Роллерное |
5428,6 571,43 |
3,5 0,08 |
1564,43 |
0,038 0,004 |
27 142 850 |
|
(контроль) |
|
|
|
|
|
|
Реакторное |
6000,0 755,90 |
2,8 0,10* |
2142,86 |
0,013 0,003* |
216 000 000 |
*р < 0,05 по отношении к контролю. |
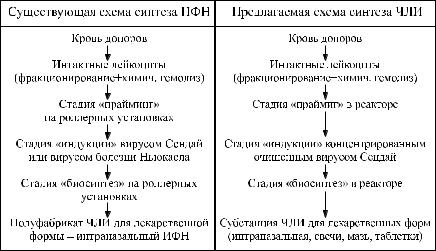
Таким образом, представленные результаты проведенных исследова- |
ний позволяют предложить технологическую схему получения препарата |
ИФН для изготовления лекарственных форм, при которой в качестве ин- |
Ðèñ. 6. Технологическая схема получения человеческого лейкоцитарного интерферона |
для лекарственных форм (существующая и предлагаемая) |
48
дуктора используют концентрированный очищенный вирус Сендай, обеспечивающий синтез ЧЛИ с удельной противовирусной активностью в 1,37 раза выше, и которая позволяет получать одномоментно в суммарном отношении в 7,96 раз больше ИФН, чем при существующей регламентированной технологии (рис. 6)
2.4. Оценка спектра цитокинов, продуцируемых лейкоцитами человека под действием вируса Сендай
Для более полной оценки иммунобиологических свойств препаратов лейкоцитарного ИФН нами проведены исследования по изучению цитокиновой активности препаратов ЧЛИ, синтезированных предложенным способом с использованием в качестве интерфероногена очищенного и концентрированного вируса Сендай. Известно, что моноциты периферической крови под действием вируса Сендай продуцируют ряда цитокинов, таких как ИЛ-6, ИЛ-8 и ФНО. Кроме того, донорские лейкоциты, индуцированные вирусами, синтезируют не только лимфокин ИФН-, обладающий выраженной противовирусной активностью, но и способны продуцировать широкий спектр цитокинов. Так, препарат «Лейкинферон» является на сегодня единственной лекарственной формой, которая содержит комплекс цитокинов первой фазы иммунного ответа, продуцируемых лейкоцитами здоровых доноров под воздействием вируса болезни Ньюкасла. В его состав входят ИЛ-1, ИЛ-6, ИЛ-8, ФНО-, ИФН-, ИЛ -10, ИЛ-4, МИФ .
Проводя аналогию с вышеизложенными данными, мы изучили цитокины следующего спектра: ИФН-, ИЛ-1, ИЛ-4, ИЛ-8, ИЛ-10, ФНО-, ИФН-. В табл. 11 представлены данные по изучению содержания цитокинов в препаратах ИФН, полученного реакторным способом культивирования лейкоцитов при индукции интерфероногенеза вирусом Сендай.
Нами установлено, что препараты ИФН, полученные при реакторном культивировании лейкоцитов, содержат в своем составе не только ИФН-, но и ряд вышеуказанных цитокинов.
Следующим этапом наших исследований явилось сравнительное изу- чение цитокинового профиля полуфабрикатов ИФН, полученных на разных этапах одного технологического процесса. Так, были исследованы полуфабрикаты ИФН, синтезированные лейкоцитами в ответ на воздействие вируса Сендай: жидкие образцы – первый вариант, второй – очищенные с помощью сефадекса G-25 (грубый) и лиофилизированные (табл. 12).
49
Таблица 11
Анализ цитокинового профиля препаратов ИФН, индуцированных вирусом Сендай
Цитокины |
Содержание цитокинов в препаратах ИФН, полученного реакторным |
||
способом и индукцией вирусом Сендай |
|||
|
|||
ÈÔÍ- |
6000,0 755,9 |
ÌÅ/ìë |
|
ÈË-1 |
258,9 25,95 |
ïã/ìë |
|
ÈË-4 |
54,94 5,27 ïã/ìë |
||
ÈË-8 |
176,9 61,48 |
ïã/ìë |
|
ÈË-10 |
Менее 5 пг/мл |
||
ÔÍÎ- |
19,6 2,22 ïã/ìë |
||
ÈÔÍ- , |
45,8 3,04 ïã/ìë |
||
Установлено, что в процессе очистки ЧЛИ методом гельфильтрации с последующим лиофильным высушиванием наблюдается снижение содержания таких цитокинов, как ИФН- и ИЛ-1. При этом цитокины ИЛ-4, ИЛ-8 и ФНОкак бы «проявляются». Это согласуется с данными А.И. Демьянова с соавторами [24] о том, что в жидких препаратах ИФН, как и в плазме крови, присутствуют растворимые рецепторы для цитокинов, в результате чего специфическое взаимодействие цитокина с рецептором ведет к кажущемуся исчезновению его в препаратах (см. табл. 12).
Ò à á ë è ö à 1 2
Сравнительный анализ цитокинового профиля препаратов ИФН, полученных различными методами
Цитокины |
Препараты ИФН, полученные с использованием различных технологий |
|||
нативный ИФН (жидкий) |
очищенный ИФН (сухой) |
|||
|
||||
ÈÔÍ- |
6000,0 894,43 ÌÅ/ìë |
6000 755,90 ÌÅ/ìë |
|
|
ÈË-1 |
520,8 100,50 ïã/ìë |
258,9 25,95* ïã/ìë |
|
|
ÈË-8 |
менее 20 пг/мл |
176,9 137,50 ïã/ìë |
|
|
ÈÔÍ- , |
105,8 9,56 ïã/ìë |
45,8 3,04 ** ïã/ìë |
|
|
ÈË-4 |
25,9 3,95 ïã/ìë |
54,9 5,27** ïã/ìë |
|
|
ÈË-10 |
менее 5 пг/мл |
менее 5 пг/мл |
|
|
ÔÍÎ- |
19,6 2,22 ïã/ìë |
28,8 14,11 ïã/ìë |
|
|
*р <0,05;** р <0,005 по отношению к жидким препаратам ИФН.
50
