
Лебедев-Степанов ВВедение в самосборку ансамблей наночастиц 2012
.pdf
Рис. 5.2 Тройная точка и кривые равновесия фаз [26]
Проблема фазовых переходов состоит в поиске объяснения их природы методами статфизики, опираясь на общие свойства межмолекулярных сил, присущие всем веществам. Данная задача до сих пор не вполне решена в отношении перехода вещества в кристаллическое состояние. Например, дискуссионным остается вопрос о наличии критической точки для перехода «жидкость – твердое тело». Известный советский физик Я.И. Френкель придерживался мнения, что такая точка должна существовать и качественных отличий жидкости и газа нет, только количественные. Однако Л.Д. Ландау и большинство других ученых это отвергали. В курсе Ландау и Лифшица (Статистическая физика. Ч. I. М.:2002, с. 299) указывается: «критическая точка может существовать лишь для таких фаз, различие между которыми имеет лишь чисто количественный характер. Таковы жидкость и газ, отличающиеся друг от друга лишь большей или меньшей ролью взаимодействия между молекулами». Эксперименты при высоких давлениях (Бриджмен) по всей видимости, подтверждают именно вторую точку зрения: если приложить достаточное давление, вещество можно кристаллизовать при любой температуре, так что критическая точка между жидкостью и кристаллической фазой отсутствует.
81

Фазовый переход «жидкость – газ» понятен гораздо лучше, хотя ряд особенностей, не говоря уже о детальном описании свойств индивидуальных веществ, и в этом случае нуждается в фундаментальных исследованиях и дальнейшем углублении представлений о природе статистических процессов в веществе.
Рис. 5.3. Критическая точка между жидкостью и газом.
Уравнения состояния, получаемые методами статистической физики, представляют собой хороший пример успешного описания жидкого и газообразного состояний и их взаимных переходов. Эти уравнения позволяют объяснить фазовый переход жидкость-газ, исследовать свойства вещества вблизи критической точки (см. рис. 5.1 и 5.3). Уравнение Ван-дер-Ваальса исторически является одной из первых успешных попыток в этом роде.
Рассмотрение критической точки удобнее проводить в плоскости pV, на которую в соответствии с уравнением состояния
p = p(V ,T ) |
(5.1) |
наносятся изотермы (рис. 5.4), анализируя которые можно выделить области фазового перехода (рис. 5.5).
82

Рис. 5.4. Изотермы реального газа
|
Рис. 5.5. Критическая точка «жидкость– газ». В устойчивых областях |
||
|
∂p |
< 0 ; в противоположном случае вещество находится в метастабильном |
|
|
|
|
|
|
∂V T |
|
|
состоянии
83
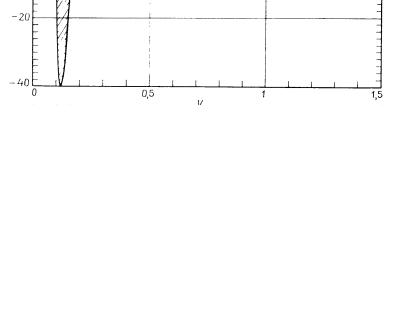
Рис. 5.6. Правило Максвелла: выбор расположения метастабильной области определяется равенством заштрихованных площадей [28]
Критическая точка характеризуется следующими условиями:
pc = pc (Vc ,Tc ) , |
(5.2) |
||||||
|
|
∂p |
= 0 , |
(5.3) |
|||
|
|
|
|
|
|||
|
|
|
|||||
|
|
∂V T |
|
|
|||
|
|
|
|
|
C |
|
|
|
|
∂ 2 p |
= 0 . |
(5.4) |
|||
|
|
|
|
|
|
||
|
|
2 |
|||||
|
∂V |
|
|
|
|||
|
|
|
T |
|
|
||
|
|
|
|
|
C |
|
|
Применение условий (5.2) – (5.4) к уравнению Ван-дер-Ваальса
(4.61)
|
a |
|
|
|
|
p + |
|
|
(Vm |
− b) = RT , |
(5.5) |
|
|
||||
|
Vm |
2 |
|
|
|
|
|
|
|
|
|
|
|
84 |
|
|
|

для критической точки приводит к следующему соотношению критических параметров:
T |
= |
|
8a |
|
, |
(5.6) |
|||
|
|
|
|
||||||
|
c |
|
|
27Rb |
|
||||
|
|
|
|
|
|||||
p |
|
= |
|
a |
|
, |
(5.7) |
||
c |
27b2 |
||||||||
|
|
|
|
|
|||||
|
|
|
|
|
|
||||
|
Vc |
= 3b . |
|
|
(5.8) |
||||
Заметим, что безразмерная комбинация критических параметров согласно уравнению Ван-дер-Ваальса имеет строго определенную величину:
RTc |
= |
8 |
≈ 2,67 . |
(5.9) |
|
|
|||
pcVc |
3 |
|
|
|
Опыт показывает, что хотя отношение RTc приблизительно по- pcVc
стоянно для многих веществ, но равно примерно 3,7 (см. табл. 5.1). Кроме того, лучше выполняется соотношение Vc ≈ 2b . Имеются и
другие отличия – необходимость предположить зависимость коэффициентов от температуры, поведение теплоемкости вблизи критической точки и т.д.
Таблица 5.1 Соотношение критических параметров некоторых веществ
85

Эти и другие недостатки уравнения Ван-дер-Ваальса стимулировали поиски других полуфеноменологических уравнений состояния, которые, как правило, носят гораздо более сложный характер.
Среди сравнительно простых уравнений состояния можно также отметить уравнение Дитеричи:
p = |
RT |
|
− |
a |
|
|
|
exp |
|
. |
(5.10) |
||
V − b |
|
|||||
|
|
|
RTV |
|
||
Обоснование формы этого уравнения можно провести следующим образом. Пусть в одной из областей газ разрежен и обладает плотностью n0, а в другой он плотен (с концентрацией n), так что существенна потенциальная энергия взаимодействия молекул, равная U на моль молекул. При этом в случае равновесия должно быть
n = n0 |
|
− |
U |
|
|
exp |
|
, |
(5.11) |
||
|
|||||
|
|
|
RT |
|
|
В равновесии давления равны. Давление идеального газа определяется формулой p = nkT. Поэтому
n = |
|
p |
|
− |
|
U |
|
||||
|
|
exp |
|
|
|
|
(5.12) |
||||
|
|
|
|
||||||||
|
kT |
|
|
|
|
RT |
|
||||
или |
|
|
|
|
|
|
|
|
|
|
|
p = |
|
RT |
|
|
|
U |
|
||||
|
|
|
exp |
|
|
|
. |
(5.13) |
|||
|
|
|
|
|
|
||||||
|
|
V |
|
|
RT |
|
|||||
Вводя энергию ван-дер-ваальсового притяжения на моль молекул
U = − a , а также поправку на занятый объем b, получаем (5.10).
V
Очевидно, что если в разложении экспоненты в ряд можно ограничиться линейным по энергии членом, то приходим в данном приближении (газов средней плотности) к тому же выражению, что и уравнение Ван-дер-Ваальса.
Для газа Дитеричи можно получить
T = a , (5.14)
c |
4Rb |
|
|
|
86 |
|
pc |
= |
|
a |
, |
(5.15) |
|
|
4e 2b2 |
||||||
|
|
|
|
|
|||
|
Vc = 2b . |
|
(5.16) |
||||
При этом |
|
|
|
|
|
|
|
|
RT |
|
|
e2 |
|
|
|
|
c |
= |
|
|
≈ 3,69 |
(5.17) |
|
|
pcVc |
2 |
|||||
|
|
|
|
|
|||
Уравнение Дитеричи для умеренных давлений значительно лучше уравнения Ван-дер-Ваальса, но совершенно непригодно для больших давлений, как и уравнение Ван-дер-Ваальса.
Существует множество других эмпирических и полуэмпирических соотношений: уравнения Редлиха–Квонга , Бертело, Барнера– Адлера и др. [28], см. табл. 5.2.
Точность аппроксимации различными уравнениями состояния индивидуальна по отношении к исследуемому газу и зависит от размера области изменения переменных, достигая в некоторых случаях долей процента. Привлечение большего количества подгоночных коэффициентов и членов в разложении улучшает аппроксимацию, но не всегда способствует раскрытию истинно физических закономерностей.
Хотя для чисто практических приложений поиск эмпирических зависимостей представляет большой интерес, но для теории важно получение того или иного вида зависимости из первых принципов.
87

Таблица 5.2 Некоторые уравнения состояния и их параметры [28]
88
Глава 6. Потенциальная энергия реального газа
6.1. Постановка задачи
Переход от потенциалов взаимодействия на атомном уровне к макроскопическим функциям, характеризующим термодинамическое состояние вещества, является одной из центральных проблем статистической физики. Физика атомов и молекул и методы квантовой химии дают возможность записать приближенные формулы, описывающие межатомные или межмолекулярные потенциалы. С другой стороны, имеются экспериментальные данные по термодинамическим свойствам индивидуальных веществ и их смесей, обобщенные в виде эмпирических и полуфеноменологических уравнений состояния или табличных зависимостей плотности и давления от температуры, экспериментальные данные по критическим параметрам веществ.
Методы статистической физики теоретически позволяют связать два этих ряда данных, микро- и макромир, хотя решить данную задачу в каждом конкретном случае весьма непросто, что связано со сложностью потенциальной функции многоатомных молекул (не говоря уже о точном ее расчете методами квантовой химии), а также наличием таких осложнений, как неаддитивность парных потенциалов (которая проявляется для достаточно плотных сред), сложность учета конфигураций и взаимных ориентаций молекул в статистических интегралах, сложно формализуемых флуктуаций.
Даже для простых атомов потенциальная функция в широком диапазоне расстояний вычисляется очень приближенно, что связано c приближенностью самих методов квантовой химии и наличием трудно поддающихся учету особенностей реальных систем, сложных поляризаций атомных оболочек и т.п. Поэтому решение задачи о соединении микро- и макромира может быть проведено, даже в простейших случаях, лишь приближенно. Общего решения до сих пор не существует. Особенно это касается описания процессов кристаллизации и полиморфизма.
89
Вместе с тем создание теорий, хотя бы частично и в некоторых интервалах температур воспроизводящих свойства веществ на основе информации о межатомных силах, вполне возможно. Речь может идти о правилах установления соответствия между материей на микро- и на макроуровнях.
Наша задача – рассмотрение общих принципов перехода от представлений о потенциальной энергии на микроуровне к уравнению состояния. В этом смысле ключевым является понятие потенциальной энергии макроскопического объема вещества – как оно получается из микроскопических представлений.
Основная трудность последовательного теоретического расчета уравнения состояния вещества методами статистической физики заключается в необходимости корректного учета сложного по структуре межчастичного взаимодействия в квантовомеханической задаче многих тел при любых межчастичных потенциалах. В приложениях часто рассматривают упрощенные модели, область применимости которых ограничена и устанавливается в каждом конкретном случае путем сравнения с более точными решениями или результатами эксперимента. Последний путь является, очевидно, более конструктивным, так как известны примеры (теория Ван-дер- Ваальса и т. п.), когда фактическая область применимости моделей значительно превосходит границы, которые определяются исходными предположениями. Феноменологическая успешность модели заставляет предположить, что возможно такое усовершенствование теории, при котором это найдет естественное объяснение с фундаментальных позиций.
Эксперимент говорит о том, что поведение вещества в критической области – там, где возражения против теории среднего поля в ее классическом виде (когда флуктуации рассматриваются как малые поправки) наиболее сильны, состояние макроскопических объемов вещества описывается гладкой кривой, хотя это и является результатом усреднения (рис. 6.1). Гладкими кривыми описываются и результаты измерения скорости звука, теплоемкости и других свойств. Это означает, что большие флуктуации параметра порядка должны быть надлежащим образом учтены и усреднены для макро-
90
