
- •1. Стабильность Si-C-связей, влияние заместителей в связанном с атомом кремния остатке.
- •2. Реакция Пудовика. Исходные соединения, связь с реакцией Кабачника—Филдса в варианте с основаниями Шиффа.
- •3. Реакционная способность и стабильность металлорганических соединений. Основные способы получения металлорганических соединений.
- •4. Способы получения и химические свойства литийорганических соединений.
- •5. Получение алкиларсиновых кислот по реакции Мейера, получение ариларсиновых кислот по реакции Барта.
- •6. Реакции литий- и магнийорганических соединений с альдегидами, кетонами, сложными эфирами, ортоэфирами и нитрилами.
- •7. Номенклатура фосфорорганических соединений и органических производных серы.
- •8. Роль растворителей при получении литий- и магнийорганических соединений.
- •9. Исходные продукты для получения тиофосфатов с инсектицидной активностью (хлортиофосфаты и дитиофосфаты), получение фоксима и карбофоса.
- •10. Способы получения, токсические характеристики и практическое использование органических производных свинца
- •11. Гидролиз и ацидолиз эфиров кислот фосфора. Получение триметилсилильных эфиров кислот фосфора, реакция МакКенны.
- •12. Реакции ацидолиза эфиров кислот фосфора, ацидолиз при получении диалкилфосфитов, условия перегонки реакционных масс. Окисление и галогенирование диалкилфосфитов.
- •13. Получение кремнийорганических аналогов биологически активных веществ, получение силамепробамата. Эффект замены атома углерода на атом кремния в биоактивных соединениях.
- •14. Метаболизм кремнийорганических соединений.
- •15. Способы получении и свойства алюминийорганических соединений. Применение в производстве полимеров
- •16. Жидкость Кадэ. Хлорвинилхлорарсины, получение, токсические характеристики, механизм действия, антидоты.
- •17. Получение эфиров арилбороновых кислот и использование их в реакции Сузуки.
- •18. Взаимодействие α-галогензамещеных кетонов с триалкилфосфитами (реакция Перкова и Михаэлиса-Арбузова). Винилфосфаты в качестве ингибиторов холинэстеразы.
- •19. Механизм гербицидной активности глюфосината (фосфинотрицина), способы его получения. Токсичность и побочные эффекты для теплокровных.
- •20. Получение кремнийорганических соединений
- •21. Получение силиконовых полимеров, регуляция молекулярной массы, вулканизация. Их практическое использование.
- •22. Реакции Барта и Несмеянова.
- •23. Способы получения диэфиров фосфористой кислоты.
- •24. Примеры фосфорорганических соединений с инсектицидной активностью, получение диалкилхлортиофосфатов. механизм выработки резистентности на примере карбофоса.
- •25.Реакция Вюрца-Фиттига, механизм избирательности в варианте Фиттига. Промежуточные продукты в реакциях арилхлоридов с хлоридами элементов и металлическим натрием.
- •26. Присоединение диалкилфосфитов к кратным связям (С=С, С=О, С=N), реакция Абрамова и Пудовика.
- •27. Способы получения и свойства цинкорганических соединений, использование их в реакции Реформатского и для получения карбонильных соединений.
- •28. Ртутьорганические соединения. Способы получения и химические свойства. Гранозан (этилмеркурхлорид), токсичность органических производных ртути.
- •29. Превращения функционализированных по β-положению кремнийорганических соединений.
- •30. Ингибирование холинэстеразы соединениями с ацилирующей способностью, особенности ингибирования производными кислот фосфора, формула Шрадера.
- •31. Способ получения и биологическая активность силатранов
- •32. Способы получения и биологическая активность органических производных германия, герматраны.
- •33. Получение триариловых и триалкиловых эфиров фосфористой кислоты.
- •34. Способы получения и практическое использование оловоорганических соединений.
- •35. Механизм реакции Михаэлиса-Арбузова, реакционная способность исходных соединений, побочная реакция.
- •36. Способы получения мышьякорганических соединений, Реакция Бешама. Сальварсан
- •38. Биологическая активность бисфосфонатов. Примеры и способы получения бисфосфонатных средств для лечения остеопороза
- •40. Реакция диалкилфосфитов с изоцианатами, побочная реакция. Получение кренайта, механизм биологической активности.
- •41. Получение илидных соединений из диалкилсульфидов и диметилсульфоксида, синтез на их основе оксиранов и циклопропанов.
- •42. Антихолинэстеразная активность фосфорорганических соединений. Обратимое и необратимое ингибирование холинэстеразы. Примеры обратимого и необратимого ингибирования в ряду фосфорорганических инсектицидов.
- •43. Реактивация ацилированной фосфорорганическими соединениями холинэстеразы производными гидроксиламина, оксимы в качестве антидотов и фоксим.
- •44.Синтез и свойства тиольных соединений алифатического ряда
- •45. 2-Хлорэтильные производные в ряду кремний- и фосфорорганических соединений. Синтез хлорэтилфосфоновой кислоты, механизм дефолиантного действия.
- •46. Гербицидная активность фосфонометилглицина (глифосата). Способы его получения. Экологические последствия использования глифосата.
- •47. Синтез и свойства тиольных соединений ароматического ряда.
- •48. Три возможных направления использования кремнийорганических соединений в химии биологически активных соединений, привести примеры.
- •49. Получение арсоновых и арсиновых кислот по реакциям Барта и Мейера.
- •50. Зависимость токсичности от строения для фосфорорганических соединений, эмпирическая формула Шрадера.
- •51. Фосфорорганические соединения с противовирусной активностью. Получение фосфонуксусной кислоты и тринатриевой соли фосфонкарбоновой кислоты. Механизм противовирусной активности.
- •52.Взаимодействие трихлорида мышьяка с ароматическими соединениями и с ацетиленом, токсичность α-, β- и γ-льюизита, дифенилхлорарсин и фенарсазинхлорид.
- •53. Зависимость токсичности от строения в ряду нитрофениловых эфиров фосфорной и тиофосфорной кислоты. Получение О-метил-О-этилового эфира хлорангидрида тиофосфорной кислоты.
- •54. Способы получения и свойства тиофосфорных и тиофосфористых кислот. Правило ЖМКО в реакции их солей с органическими галогенидами
- •58.Биологическая активность синтетических селенорганических соединений. Получение и антиоксидантная активность эбселена.
- •59.Получение и химические свойства диметилсульфоксида в качестве растворителя и реагента
- •60.Роль серосодержащих аминокислот в составе белков и в метаболизме. Биосинтез цистеина.
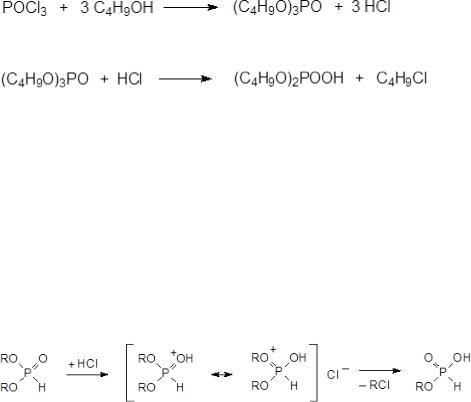
12. Реакции ацидолиза эфиров кислот фосфора, ацидолиз при получении диалкилфосфитов, условия перегонки реакционных масс. Окисление и галогенирование диалкилфосфитов.
трибутиловый эфир фосфорной кислоты, используемый в качестве экстрагента для выделения и очистки солей тяжёлых металлов, в частности, урана, получают только из бутанола и фосфорилхлорида. Эта реакция не требует присутствия акцепторов хлористого водорода, хотя она может сопровождаться образованием бутилхлорида и дибутилфосфата в результате ацидолиза эфирных связей хлористым водородом
Для повышения выхода диалкилфосфитов в реакции трихлорида фосфора с низшими спиртами взаимодействие проводят при интенсивном охлаждении, так как хлористый водород может реагировать с эфирами кислот фосфора в электронном состоянии σ4λ5 по схеме ацидолиза. Для диалкилфосфитов этому превращению соответствует механизм, основанный на протонировании атома кислорода в фосфорильной группе:
Если реакцию трихлорида фосфора со спиртом проводят при повышенной температуре, например, при добавлении трихлорида фосфора к кипящему спирту, то основным продуктом реакции становится соответствующий алкилхлорид и фосфористая кислота.
По схеме ацидолиза идет и реакция диалкилфосфитов с карбоновыми кислотами.
Так, например, при взаимодействии диметилфосфита с уксусной кислотой образуется фосфористая кислота и метилацетат:
49

При нагревании кислые эфиры фосфористой кислоты диспропорционируют с образованием фосфатов, фосфина и аморфного фосфора оранжевого цвета. В соответствии с этим перегонку таких реакционных масс следует проводить в вакууме при температурах в кубовой жидкости не выше 100-130°С. При появлении оранжевого осадка перегонку следует прекратить, а воздух в прибор для перегонки можно впускать только после полного его охлаждения.
Однако в общем случае диэфиры с алкильными остатками нормального строения в чистом виде устойчивы до температуры около 160°С. Эфиры с вторичными и тем более с третичными спиртами более чувствительны к термическому воздействию.
Окисление и галогенирование диалкилфосфитов В ряду превращений гидроксизамещенных фосфонатов можно отметить их
окисление с образованием ацилфосфонатов. В качестве окислителей может быть использован перманганат калия. При этом надо принимать во внимание, что ацилфосфонаты разлагаются на соответствующие фосфиты и кислоты даже влагой воздуха. В соответствии с этим для окисления гидроксизамещенных фосфонатов можно использовать, например, перманганат с катализатором межфазного переноса.
Интересно, что скорость реакции диэтилфосфита с галогенами (Сl2, Br2, I2) не зависит
ни от концентрации галогена, ни от его природы. Это можно объяснить только тем, что лимитирующей скорость реакции стадией является изомеризация Н-фосфоната в таутомерную форму с трикоординированным атомом фосфора, которая с высокой скоростью реагирует с соответствующим галогеном:
50
C H O |
O |
C H O |
|
|
|
|
||
2 |
5 |
|
C H O |
|
||||
|
|
2 |
5 |
Cl |
O |
|||
|
|
|
|
|
2 |
5 |
||
|
|
P |
|
|
2 |
|
|
|
|
|
|
P |
OH |
|
|
P |
|
C H O |
H |
C H O |
|
|
|
Cl |
||
2 |
5 |
|
|
C H O |
||||
|
|
|
2 |
5 |
|
|
||
|
|
|
|
|
|
2 |
5 |
|
|
|
|
|
|
||||
Окислительные |
превращения |
гидрофосфорильной |
группы |
в диалкилфосфитах |
||||
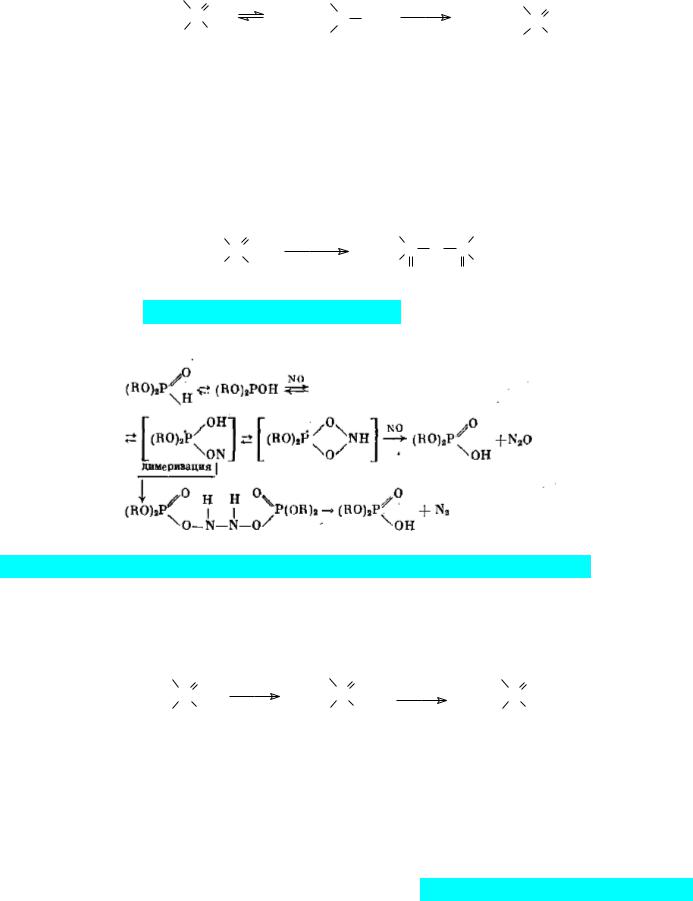
протекают при действии многих реагентов. Интересно, что первичным продуктом
окисления диалкилфосфитов диоксидом азота являются тетраалкилпирофосфаты:
RO |
O |
NO |
RO |
|
|
|
OR |
|
|
|
|
|
|
|
|
|
P |
2 |
|
P |
O |
P |
|
|
|
|
|
||||
RO |
H |
|
RO |
O |
|
O |
OR |
|
|
|
|
|
|
Диалкилфосфиты окисляются монооксидом азота до диалкилфосфатов с образование закиси азота и азота:
Галогены переводят диалкилфосфиты в соответствующие моногалогениды диалкиловых эфиров фосфорной кислоты в результате замещения атома водорода галогеном. Если эта реакция протекает в присутствии воды, то продуктами реакции становятся соответствующие диалкилфосфаты:
RO |
O |
Cl |
RO |
O |
RO |
O |
|
|
H O |
||||
|
|
2 |
|
|
|
|
|
P |
|
|
P |
2 |
P |
|
|
|
|
|||
RO |
H |
|
RO |
Cl |
RO |
OH |
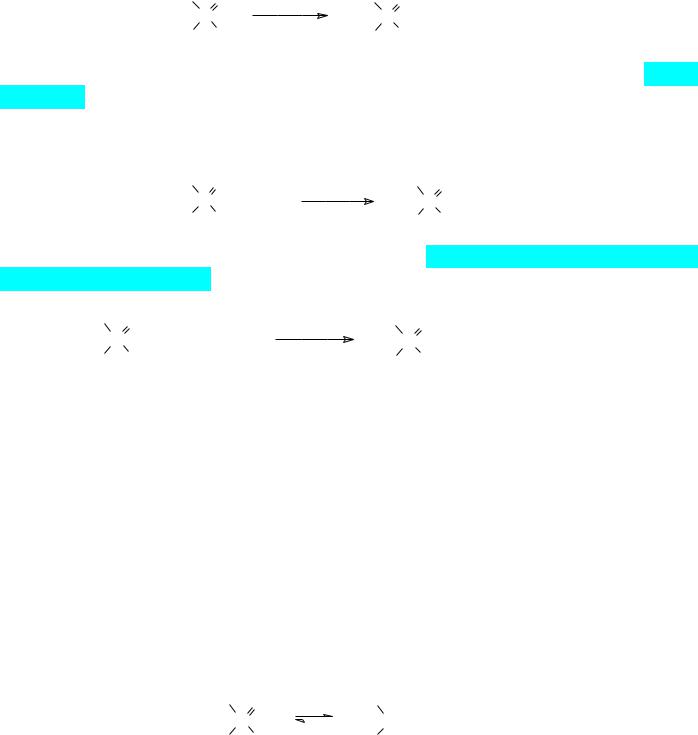
Однако для получения диалкилхлорфосфатов в чистом виде нежелательно использовать взаимодействие диалкилфосфитов с хлором. Дело в том, что эта реакции протекает с выделением большого количества тепла и несмотря на интенсивное перемешивание и охлаждение следствием этого становятся местные перегревы. В соответствии с этим хлорирование диалкилфосфитов сопровождается ацидолизом эфирных связей образующимся в реакции хлористым водородом. Более чистые диалкилхлорфосфаты образуются из далкилфосфитов при хлорировании их сульфурилхлоридом или фосгеном:
51
RO |
O |
SO Cl |
RO |
O |
|
|
|
|
|
|
|
||||
|
P |
2 |
2 |
|
|
|
|
|
|
|
P |
+ SO |
+ |
HCl |
|
|
|
|
|
|
2 |
|
|
RO |
H |
|
|
RO |
Cl |
|
|
Неожиданный способ получения диалкилхлорфосфатов представлен реакцией ТоддаАттертона. При добавлении третичного амина к раствору диалкилфосфита в некоторых галогенированных углеводородах (чаще всего для этого используют четырёххлористый углерод) протекает реакция по схеме:
RO |
O |
|
R N |
RO |
O |
P |
+ |
CCl |
3 |
|
|
|
P |
+ CHCl |
|||
|
H |
4 |
|
|
3 |
RO |
|
|
RO |
Cl |
В качестве другого примера можно представить хлорирование диалкил-фосфитов трихлоруксусной кислотой:
RO |
O |
|
R N |
RO |
|
O |
|
_ |
|
|
|
|
|
|
|||||
P |
+ |
CCl COOH |
3 |
|
P |
+ |
CHCl COO |
|
+ |
|
|
|
|||||||
|
|
3 |
|
|
|
2 |
R NH |
||
|
H |
|
|
|
|
|
3 |
|
|
RO |
|
|
RO |
|
Cl |
|
|
|
|
Присутствие в реакционной массе третичного амина значительно осложняет выделение образующегося хлорангидрида. В соответствии с этим реакцию Тодда-Аттертона используют преимущественно для получения в одну операцию продуктов фосфорилирования, проводя её со стехиометрическим количеством третичного амина в присутствии соответствующего нуклеофильного реагента. Так, например, добавляя к полученной из диалкилфосфита, триэтиламина и четырёххлористого углерода реакционной массе какое-либо соединение с гидроксильной группой можно получить несимметричный триэфир фосфорной кислоты, а замена третичного амина первичным или вторичным амином приводит к получению соответствующего амида.
Механизм реакции Тодда-Аттертона представляется обычно как цепной процесс, в соответствии с которым на первой стадии основание обратимо реагирует с диалкилфосфитом с образованием аниона диалкилфосфористой кислоты:
RO |
O |
B: |
RO |
_ |
||
|
|
|||||
|
P |
|
|
P |
|
O + BH+ |
|
|
|
|
|||
RO |
H |
|
RO |
|
|
|
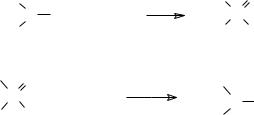
Образовавшийся анион диалкилфосфористой кислоты реагирует с четырёххлористым углеродом, превращаясь в диалкилхлорфосфат и генерируя трихлорметильный карбанион, который выступает в роли основания, отрывая протон от соли ВН+ и регенерируя основание В или отрывая протон от молекулы диалкилфосфита и превращая её в реагирующий с четырёххлористым углеродом анион диалкилфосфористой кислоты:
52
RO |
|
|
- |
|
RO |
O |
|
|
- |
|
P |
O |
+ CCl |
P |
+ |
|
CCl |
||
|
|
|
|
||||||
|
|
|
|
4 |
RO |
Cl |
|
3 |
|
RO |
|
|
|
|
|
|
|
||
RO |
O |
|
|
_ |
RO |
_ |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||
P |
|
+ |
|
CCl |
|
|
|
|
|
|
|
P |
O |
+ |
CHCl |
||||
|
|
|
|
3 |
|||||
RO |
H |
|
|
|
|
|
|
|
3 |
|
|
|
RO |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Представленный механизм реакции Тодда-Аттертона кажется достаточно обоснованным, тем более, что скорость реакции растёт с увеличением основности амина, однако известно, что амины не протонируются, а алкилируются диалкилфосфитами. В соответствии с этим были предложены и другие механизмы этой реакции, включающие, например, образование четвертичных аммонийных соединений.
Превращения по реакции Тодда-Аттертона можно также проводить в присутствии катализаторов межфазного переноса с концентрированным водным раствором щелочи в качестве основания. По этой схеме в четырёххлористом углероде можно из диалкилфосфитов и фенолов получать ариловые эфиры диалкилфосфорных кислот, используя в качестве катализатора межфазного переноса бромид тетрабутиламмония.
53
