
- •1. Стабильность Si-C-связей, влияние заместителей в связанном с атомом кремния остатке.
- •2. Реакция Пудовика. Исходные соединения, связь с реакцией Кабачника—Филдса в варианте с основаниями Шиффа.
- •3. Реакционная способность и стабильность металлорганических соединений. Основные способы получения металлорганических соединений.
- •4. Способы получения и химические свойства литийорганических соединений.
- •5. Получение алкиларсиновых кислот по реакции Мейера, получение ариларсиновых кислот по реакции Барта.
- •6. Реакции литий- и магнийорганических соединений с альдегидами, кетонами, сложными эфирами, ортоэфирами и нитрилами.
- •7. Номенклатура фосфорорганических соединений и органических производных серы.
- •8. Роль растворителей при получении литий- и магнийорганических соединений.
- •9. Исходные продукты для получения тиофосфатов с инсектицидной активностью (хлортиофосфаты и дитиофосфаты), получение фоксима и карбофоса.
- •10. Способы получения, токсические характеристики и практическое использование органических производных свинца
- •11. Гидролиз и ацидолиз эфиров кислот фосфора. Получение триметилсилильных эфиров кислот фосфора, реакция МакКенны.
- •12. Реакции ацидолиза эфиров кислот фосфора, ацидолиз при получении диалкилфосфитов, условия перегонки реакционных масс. Окисление и галогенирование диалкилфосфитов.
- •13. Получение кремнийорганических аналогов биологически активных веществ, получение силамепробамата. Эффект замены атома углерода на атом кремния в биоактивных соединениях.
- •14. Метаболизм кремнийорганических соединений.
- •15. Способы получении и свойства алюминийорганических соединений. Применение в производстве полимеров
- •16. Жидкость Кадэ. Хлорвинилхлорарсины, получение, токсические характеристики, механизм действия, антидоты.
- •17. Получение эфиров арилбороновых кислот и использование их в реакции Сузуки.
- •18. Взаимодействие α-галогензамещеных кетонов с триалкилфосфитами (реакция Перкова и Михаэлиса-Арбузова). Винилфосфаты в качестве ингибиторов холинэстеразы.
- •19. Механизм гербицидной активности глюфосината (фосфинотрицина), способы его получения. Токсичность и побочные эффекты для теплокровных.
- •20. Получение кремнийорганических соединений
- •21. Получение силиконовых полимеров, регуляция молекулярной массы, вулканизация. Их практическое использование.
- •22. Реакции Барта и Несмеянова.
- •23. Способы получения диэфиров фосфористой кислоты.
- •24. Примеры фосфорорганических соединений с инсектицидной активностью, получение диалкилхлортиофосфатов. механизм выработки резистентности на примере карбофоса.
- •25.Реакция Вюрца-Фиттига, механизм избирательности в варианте Фиттига. Промежуточные продукты в реакциях арилхлоридов с хлоридами элементов и металлическим натрием.
- •26. Присоединение диалкилфосфитов к кратным связям (С=С, С=О, С=N), реакция Абрамова и Пудовика.
- •27. Способы получения и свойства цинкорганических соединений, использование их в реакции Реформатского и для получения карбонильных соединений.
- •28. Ртутьорганические соединения. Способы получения и химические свойства. Гранозан (этилмеркурхлорид), токсичность органических производных ртути.
- •29. Превращения функционализированных по β-положению кремнийорганических соединений.
- •30. Ингибирование холинэстеразы соединениями с ацилирующей способностью, особенности ингибирования производными кислот фосфора, формула Шрадера.
- •31. Способ получения и биологическая активность силатранов
- •32. Способы получения и биологическая активность органических производных германия, герматраны.
- •33. Получение триариловых и триалкиловых эфиров фосфористой кислоты.
- •34. Способы получения и практическое использование оловоорганических соединений.
- •35. Механизм реакции Михаэлиса-Арбузова, реакционная способность исходных соединений, побочная реакция.
- •36. Способы получения мышьякорганических соединений, Реакция Бешама. Сальварсан
- •38. Биологическая активность бисфосфонатов. Примеры и способы получения бисфосфонатных средств для лечения остеопороза
- •40. Реакция диалкилфосфитов с изоцианатами, побочная реакция. Получение кренайта, механизм биологической активности.
- •41. Получение илидных соединений из диалкилсульфидов и диметилсульфоксида, синтез на их основе оксиранов и циклопропанов.
- •42. Антихолинэстеразная активность фосфорорганических соединений. Обратимое и необратимое ингибирование холинэстеразы. Примеры обратимого и необратимого ингибирования в ряду фосфорорганических инсектицидов.
- •43. Реактивация ацилированной фосфорорганическими соединениями холинэстеразы производными гидроксиламина, оксимы в качестве антидотов и фоксим.
- •44.Синтез и свойства тиольных соединений алифатического ряда
- •45. 2-Хлорэтильные производные в ряду кремний- и фосфорорганических соединений. Синтез хлорэтилфосфоновой кислоты, механизм дефолиантного действия.
- •46. Гербицидная активность фосфонометилглицина (глифосата). Способы его получения. Экологические последствия использования глифосата.
- •47. Синтез и свойства тиольных соединений ароматического ряда.
- •48. Три возможных направления использования кремнийорганических соединений в химии биологически активных соединений, привести примеры.
- •49. Получение арсоновых и арсиновых кислот по реакциям Барта и Мейера.
- •50. Зависимость токсичности от строения для фосфорорганических соединений, эмпирическая формула Шрадера.
- •51. Фосфорорганические соединения с противовирусной активностью. Получение фосфонуксусной кислоты и тринатриевой соли фосфонкарбоновой кислоты. Механизм противовирусной активности.
- •52.Взаимодействие трихлорида мышьяка с ароматическими соединениями и с ацетиленом, токсичность α-, β- и γ-льюизита, дифенилхлорарсин и фенарсазинхлорид.
- •53. Зависимость токсичности от строения в ряду нитрофениловых эфиров фосфорной и тиофосфорной кислоты. Получение О-метил-О-этилового эфира хлорангидрида тиофосфорной кислоты.
- •54. Способы получения и свойства тиофосфорных и тиофосфористых кислот. Правило ЖМКО в реакции их солей с органическими галогенидами
- •58.Биологическая активность синтетических селенорганических соединений. Получение и антиоксидантная активность эбселена.
- •59.Получение и химические свойства диметилсульфоксида в качестве растворителя и реагента
- •60.Роль серосодержащих аминокислот в составе белков и в метаболизме. Биосинтез цистеина.

53. Зависимость токсичности от строения в ряду нитрофениловых эфиров фосфорной и тиофосфорной кислоты. Получение О-метил-О-этилового эфира хлорангидрида тиофосфорной кислоты.
В рамках работ по синтезу и изучению биологической активности производных кислот фосфора, проводившихся под руководством Г.Шрадера в предвоенные и военные годы, было показано, что многие из них оказываются токсичными для насекомых. Так,
например, высокую инсектицидную активность показывал диэтил-4-нитрофенилфосфат
(соединение Е-600, параоксон), токсичность которого даже превосходила токсичность табуна, производившегося как отравляющее вещество. Переход от фосфата к тионфосфату (препарат Е-605, тиофос, паратион)
C H O |
O |
|
|
2 |
5 |
|
|
|
|
P |
|
C H O |
O |
NO |
|
2 |
5 |
|
2 |
C H O |
S |
|
||
2 |
5 |
|
|
|
|
|
|
P |
|
C H |
O |
O |
NO |
|
2 |
5 |
|
|
2 |
 и
и  и замена этильных групп на метильные позволила при сохранении высокой
и замена этильных групп на метильные позволила при сохранении высокой
инсектицидной активности значительно понизить токсичность соответствующего нитрофенилового эфира тиофосфорной кислоты для теплокровных. Полученный в результате такой модификации структуры параоксона О,О-диметил-О-4-
нитрофенилтиофосфат (ЛД50 25-50 мг/кг) под названием метафос некоторое время использовался в качестве средства для борьбы с насекомыми вредителями, однако достаточно скоро от него пришлось отказаться из-за большого числа тяжелых поражений, вызванных неосторожным обращением с инсектицидными составами на его основе, тем более, что вскоре после его внедрения в практику появились новые более безопасные инсектициды на основе кислот фосфора.
Тем не менее, основное направление при разработке новых инсектицидов на основе кислот фосфора было представлено прежде всего поиском соединений с низкой общей токсичностью для теплокровных. Так, например, в ряду ариловых эфиров тиофосфорных кислот серьёзное снижение токсичности при практически полном сохранении инсектицидной активности достигается введением заместителей (атома
182
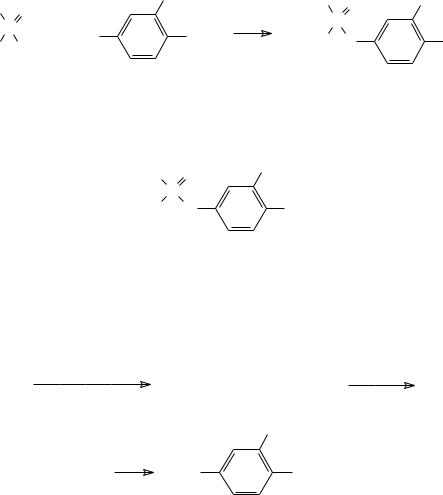
хлора или метильного остатка) в мета-положение нитрофенильной группы тионфосфатов. Способ получения этих соединений основан на взаимодействии диметилхлортиофосфата с соответствующими фенолятами:
|
|
|
|
|
CH |
CH O |
|
CH |
CH |
O |
|
|
|
3 |
S |
||
|
S |
|
|
3 |
3 |
|||
3 |
|
|
|
|
|
P |
|
|
|
|
P |
|
|
|
|
|
|
|
|
+ |
NaO |
NO |
|
|
|
|
|
|
|
CH O |
O |
NO |
|||
CH O |
|
Cl |
|
2 |
||||
|
|
|
3 |
|
2 |
|||
3 |
|
|
|
|
|
|
|
|
Токсичность получаемого по этой схеме фенитротиона составляет от 250 до 430
мг/кг. Ещё одним препаратом из этой группы является хлортион (ЛД50 около 900 мг/кг):
CH O |
S |
Cl |
|
||
3 |
|
|
|
P |
|
CH O |
O |
NO |
3 |
|
2 |
Интересно, что для получения 4-нитро-3-хлорфенола и 3-метил-4-нитрофенола можно использовать нитрование трис(3-хлорфенил)фосфата или трис(м-крезил)фосфата с последующим гидролизом образовавшегося продукта нитрования:
|
|
|
HNO |
, H SO |
|
|
|
|
NaOH |
|
|
|
|
3 |
2 |
4 |
-4-O NC H O) PO |
||||
(3-CH C H O) PO |
|
(3-CH |
|
|||||||
3 |
6 |
4 |
3 |
|
3 |
2 |
6 |
3 |
3 |
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
NaO |
|
|
|
NO |
|
|
|
|
|
|
|
|
|
|
2 |
|
В этом случае стерический фактор в триарилфосфате значительно снижает содержание продуктов орто-замещения в образующехся при нитровании реакционных массах. Тиофосфаты на основе 2- и 3-замещенных 4-нитрофенолов малоактивны.
Синтез о-метил-о-этилового хлорангидрида тиофосфорной кислоты При получении производных тиофосфорных кислот, представляющих собой
тиоаналоги производных фосфорной кислоты, в качестве исходных соединений используют прежде всего декасульфид фосфора и тиофосфорилхлорид. По реакционной способности тиофосфорилхлорид значительно уступает фосфорилхлориду из-за того, что электроотрицательность атома серы в Р=S-группе ниже, чем у атома кислорода в Р=О-
группе. В соответствии с этим реакции тиофосфорилхлорида со спиртами проводят при
183

охлаждении при соотношении реагентов от 1:3 до 1:4. При этом получают моноалкиловый эфир дихлортиофосфорной кислоты. Избыток спирта нужен прежде всего для того, чтобы компенсировать пассивирующий эффект хлористого водорода на спирте. Для получения диэфиров хлортиофосфорной кислоты реакцию проводят при интенсивном охлаждении с растворами гидроксидов щелочных металлов в спирте. Так,
например, для синтеза О-метил-О-этилхлортиофосфата, который получали в промышленном масштабе в качестве исходного продукта в производстве инсектицидов,
на первой стадии проводят взаимодействие тиофосфорилхлорида с избытком этилового спирта:
PSCl |
+ |
C H OH |
C H OPSCl |
+ |
HCl |
|||
3 |
|
2 |
5 |
2 |
5 |
2 |
|
|
Реакционную массу выливают в воду со льдом и отделяют нижний органический слой. Гидролиз моноэфира дихлортиофосфорной кислоты на холоду идёт очень медленно и, благодаря этому, таким простым способом удается легко отделить его от спирта, хлористого водорода и кислых примесей. После этого к содержащей в основном алкилдихлортиофосфат органической фазе при интенсивном перемешивании и охлаждении прибавляют раствор стехиометрического количества гидроксида натрия в метаноле:
|
|
|
C H O |
|
S |
|
|
|
|
|
2 |
5 |
|
|
|
C H OPSCl |
+ CH OH + NaOH |
|
P |
+ NaCl |
+ H O |
||
2 |
5 |
2 |
3 |
|
|
Cl |
2 |
|
|
|
CH O |
|
|
||
|
|
|
|
3 |
|
|
|
184
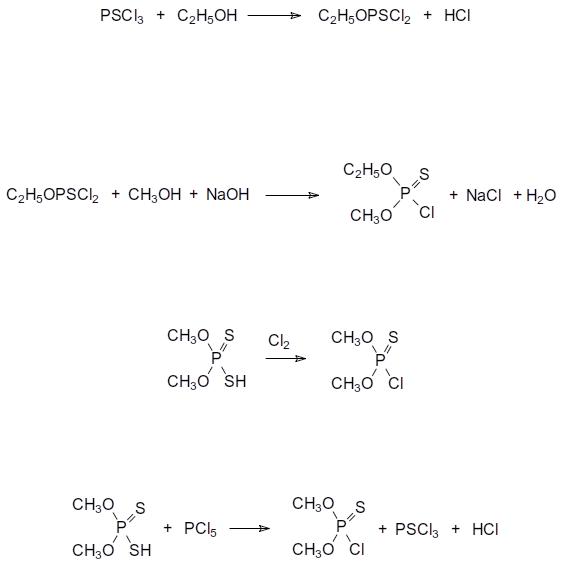
54. Способы получения и свойства тиофосфорных и тиофосфористых кислот. Правило ЖМКО в реакции их солей с органическими галогенидами
При получении производных тиофосфорных кислот в качестве исходных соединений используют прежде всего декасульфид фосфора и тиофосфорилхлорид. Для получения диэфиров хлортиофосфорной кислоты реакцию проводят при интенсивном охлаждении с растворами гидроксидов щелочных металлов в спирте. При получении О-
метил-О-этилхлортиофосфата на первой стадии проводят взаимодействие тиофосфорилхлорида с избытком этилового спирта:
1)После этого к содержащей в основном алкилдихлортиофосфат органической фазе при интенсивном перемешивании и охлаждении прибавляют раствор стехиометрического количества гидроксида натрия в метаноле:
2)Также они могут быть получены контролируемым хлорированием О,О-
диалкилдитиофосфатов:
3) Еще один способ получения диалкилхлортиофосфатов представлен хлорированием диалкилдитиофосфатов пентахлоридом фосфора:
При гидролитическом разложении О,О-диалкилхлортиофосфатов образуются соответствующие кислоты, которые могут существовать в двух таутомерных формах:
185
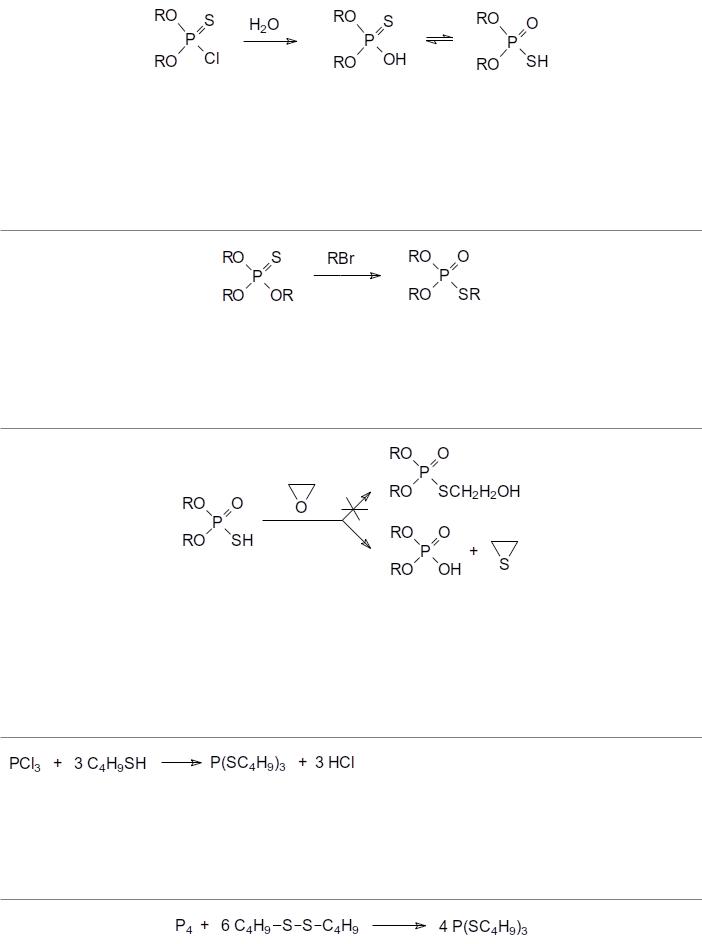
Свойства производных тиофосфорных кислот:
При нагревании в присутствии соединений с алкилирующей способностью эфиры тиокислот фосфора тионной формы перегруппировываются в эфиры тиольной формы,
например:
Высокая экзотермичность образования РО-связи исключает возможность получения продуктов присоединения алкиленоксидов к SH-связям в тиокислотах фосфора:
Получение эфиров тиофосфористой кислоты Из трихлорида фосфора и бутилмеркаптана без использования акцепторов
хлористого водорода получали трибутиловый эфир тритиофосфористой кислоты,
использовавшийся в качестве дефолианта:
Для синтеза трибутилового эфира тритиофосфористой кислоты может быть также использовано взаимодействие диспергированного белого фосфора с дибутилдисульфидом:
186
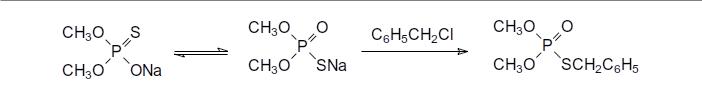
Правило ЖМКО При переводе тиокислот в соли образуются амбидентные анионы, алкилирование
которых алкилгалогенидами подчиняется правилу Пирсона (правило ЖМКО,
орбитального и зарядового контроля – мягкие кислоты и основания реагируют с мягкиими основаниями и кислотами соотв., жёсткие с жёсткими) и продуктами реакции становятся соответствующие S-алкиловые эфиры:
187
55. Получение |
трифенилфосфина, образование илидов трифенилфосфония, |
|
механизм реакции |
Виттига. Синтез сквалена по реакции Виттига. |
|
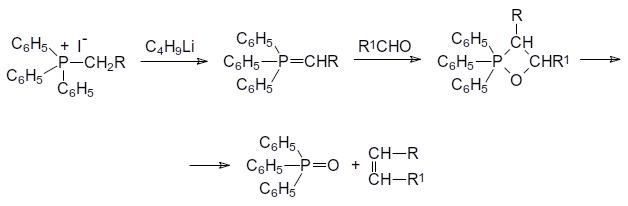
Реакция Виттига представляет собой взаимодействие алкилидентрифенилфосфоранов, образующихся при действии сильных оснований на соответствующие соли алкилтрифенилфосфония, с карбонильными соединениями
(альдегидами и кетонами). Реакция Виттига протекает с образованием нестабильного оксафосфетана, разлагающегося на трифенилфосфиноксид и непредельное соединение в виде Z-изомера по схеме:
Алкилиденфосфораны получают действием сильных оснований на соли фосфония.
Если при этом образуется фосфорановое соединение, стабилизированное электроноакцепторным заместителем в остатке R, то скорость реакции Виттига снижается и возрастает содержание Е-изомера в образующемся непредельном продукте реакции.
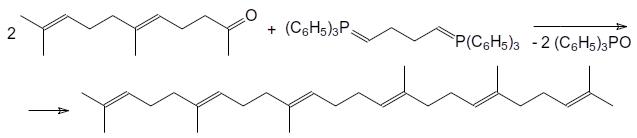
Реакция Виттига широко используется для получения полиненасыщенных природных соединений. В качестве примера можно привести синтез сквалена из геранилацетона и дифосфоранового соединения, образующегося из бисфосфониевой соли на основе 1,4-
дибромэтана и трифенилфосфина:
188
Электроноакцепторные свойства фосфорильной группы позволяют проводить депротонирование соответствующих соединений с отщеплением протона в α-
положении к фосфорильной группе при действии сильных оснований. Образующиеся при этом анионы могут быть использованы в самых разных превращениях.
189
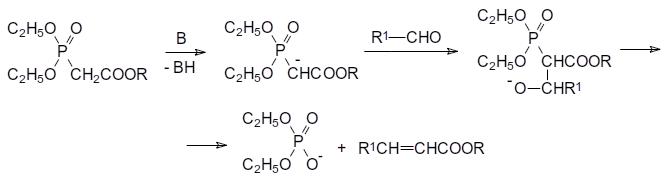
56. Реакция Хорнера-Вадсворта-Эммонса, синтез фосфонацетатов по реакции Михаэлиса-Арбузова и по реакции Михаэлиса-Беккера.
В частности, исходными продуктами в реакции Хорнера– Вадсворта–Эммонса являются триэфиры фосфонуксусной кислоты, у которых электроноакцепторный эффект карбоксилатной группы дополняется электроноакцепторным эффектом фосфорильной группы. При действии таких сильных оснований, как трет-бутилат калия, гидрид натрия,
амид натрия или DBU (1,8- диазабицикло[5.4.0]ундец-7-ен) с хлоридом лития в тетрагидрофуране, 1,2-диметоксиэтане, бензоле или ацетонитриле, полные эфиры фосфонуксусной кислоты депротонируются с образованием аниона, который реагирует с карбонильными соединениями по аналогии с реакцией Виттига. Конечными продуктами при этом становятся эфиры замещённых акриловых кислот:
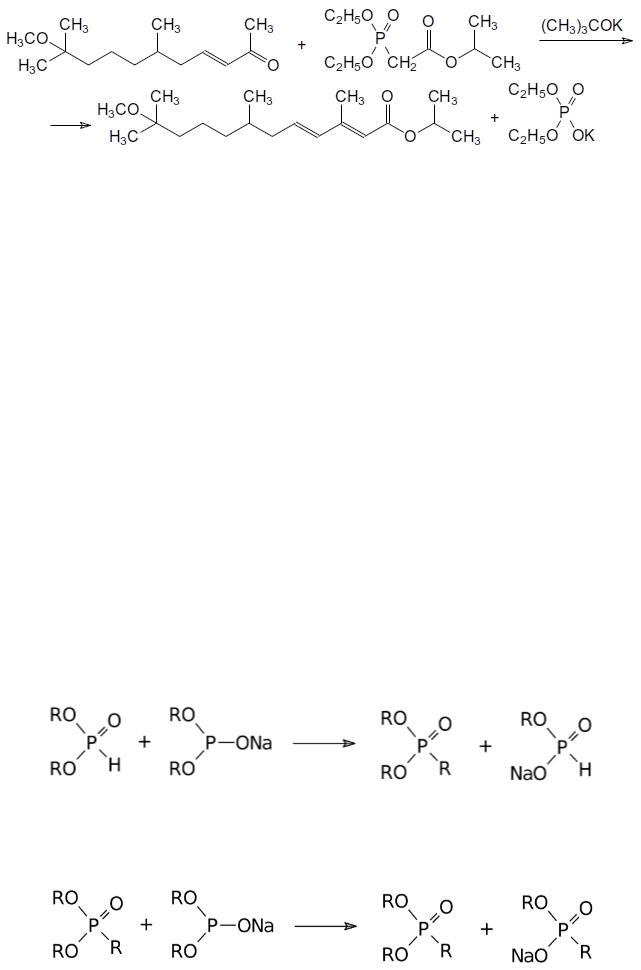
Представленный реакцией Хорнера–Вадсворта–Эммонса способ получения производных акриловых кислот был впервые реализован группой немецких исследователей под руководством Л. Хорнера (L. Horner, 1958). В качестве примера использования этой реакции на практике можно привести синтез инсектицидного регулятора роста насекомых метопрена:
190
Реакция Хорнера–Вадсворта–Эммонса приводит к получению соответствующих непредельных соединений в виде термодинамически более выгодных Е-изомеров.
Замена этильных остатков в эфирных группах у атома фосфора на 2,2,2-трифторэтильные остатки позволяет получать преимущественно Z-изомеры. Это связано с тем, что фосфонат с трифторэтильными группами реагирует с карбонильными соединениями с более высокой скоростью. В соответствии с этим реакция с участием трифторэтиловых эфиров фосфонуксусной кислоты (W. C. Still, C. Gennari, 1983 г.) протекает при меньшей температуре по пути с более низким значением энергии активации (кинетический контроль течения реакции).
Реакция Михаэлиса-Беккера
В начальном варианте реализации этого способа получения фосфонатов натриевые соли диалкилфосфористых кислот получали длительным нагреванием раствора диалкилфосфита в бензоле с металлическим натрием. При этом параллельно образованию натриевой соли идет её алкилирование диалкилфосфитом:
Образовавшийся в этой реакции диалкилфосфонат также может алкилировать соль диалкилфосфористой кислоты:
191
Следствием этого становится присутствие в реакционной массе по крайней мере трёх побочных продуктов – диалкилалкилфосфоната, натриевой соли моноалкилфосфита и натриевой соли моноалкилалкилфосфоната.
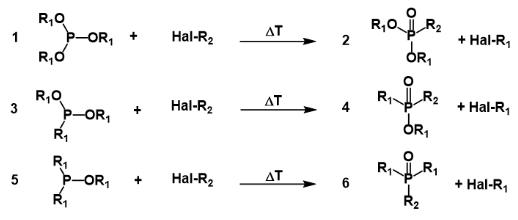
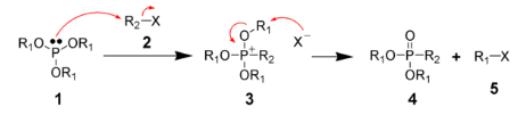
Реакция Михаэлиса-Арбузова
Реакция Михаэлиса–Арбузова (также называемая реакцией Арбузова) представляет собой химическую реакцию трехвалентного эфира фосфора с алкилгалогенидом с образованием пятивалентного вида фосфора и другого алкилгалогенида. На рисунке ниже показаны наиболее распространенные типы субстратов, подвергающихся реакции Арбузова; сложные эфиры фосфитов (1) реагируют с образованием фосфонатов (2),
фосфониты (3) реагируют с образованием фосфинатов (4) и фосфиниты (5) реагируют с образованием фосфиноксидов (6).
Реакция Михаэлиса–Арбузова инициируется атакой SN2 атака нуклеофильных видов фосфора (1 -фосфит) электрофильным алкилгалогенидом (2) с получением соли фосфония в качестве промежуточного продукта (3). Эти промежуточные продукты иногда достаточно стабильны, чтобы их можно было выделить, например, для триарилфосфитов, которые не реагируют с образованием фосфоната без термического расщепления промежуточного продукта (200 ° C) или расщепления спиртами или основаниями. Вытесненный анион галогенида затем обычно реагирует через другую реакцию SN2 на одном из атомов углерода R1, вытесняя атом кислорода, чтобы дать желаемый фосфонат (4) и другой алкилгалогенид (5).
192
193
57. Способы получения и свойства сульфокислот алифатического и ароматического ряда.
Представляют собой гигроскопичные кристаллические вещества с нечёткой
температурой плавления.
Получение
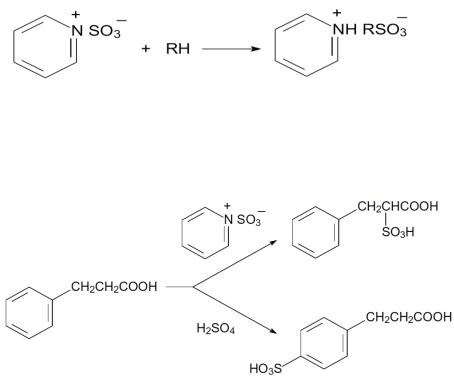
1. Сульфоновые кислоты можно получать исчерпывающим окислением любых сероорганических соединений - тиолов, дисульфидов, сульфидов или даже роданидов
RSCN.
Однако чаще всего для их получения используют реакцию сульфирования исходных продуктов концентрированной серной кислотой или олеумом. В эту реакцию вступают соединения как алифатического, так и ароматического ряда. Сульфирование алифатических углеводородов идёт в жёстких условиях неизбирательно, но алканкарбоновые кислоты достаточно легко сульфируются в α-положение к
карбоксильной группе.
В более мягких условиях идёт сульфирование алифатических соединений хлорсульфоновой кислотой или аддуктами триоксида серы с диоксаном или пиридином,
например:
Интересно, что с помощью таких реагентов можно даже избирательно сульфировать алифатические структурные элементы в составе ароматических соединений:
194

Ароматические соединения сульфируются значительно легче алифатических. В
качестве сульфирующего реагента используются концентрированная серная кислота или олеумы с содержанием триоксида серы от 5 до 70 %. В реакции сульфирования серной кислотой выделяется вода, замедляющая или даже блокирующая замещение. Поэтому для получения сульфокислот из ароматических соединений берут большой избыток концентрированной серной кислоты или добавляют триоксид серы (олеум),
реагирующий с водой с образованием серной кислоты. Можно также удалять образующуюся в реакции сульфирования воду в вакууме или азеотропной отгонкой с растворителем, который не реагирует с серной кислотой.
Скорость сульфирования и направление реакции зависят от строения реагирующего ароматического соединения.
электронодонорные заместители значительно ускоряют реакцию сульфирования,
тогда как даже такой слабый ориентант второго рода, как карбоксильная группа,
значительно замедляет реакцию сульфирования.
Ориентация замещения соответствует известным правилам нуклеофильного замещения ароматических соединений, но соотношение доли замещения в орто-
или параположения в значительной мере определяется природой
сульфирующего реагента, его концентрацией, температурой |
реакции |
и |
средой, в которой протекает реакция.
для сульфирования чувствительных к действию серной кислоты соединений можно использовать в качестве растворителей ацетонитрил, ледяную уксусную кислоту и уксусный ангидрид, жидкий диоксид серы, петролейный эфир и четырёххлористый углерод.
2.Алифатические сульфокислоты можно также получать алкилированием солей сернистой кислоты. Так, например, в реакции бисульфита калия с этиленоксидом образуется соль 2-гидроксиэтансульфокислоты:
195
Свойства
1. Ароматические сульфокислоты гидролизуются по СS-связи при нагревании с разбавленной серной или соляной кислотой при температуре до 200 °С под давлением.
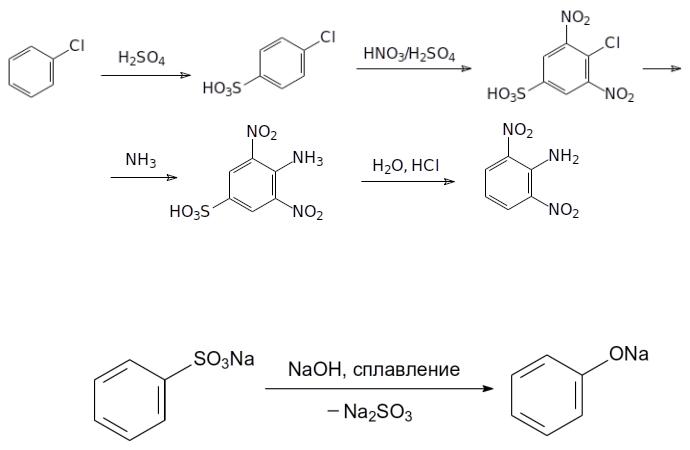
Скорость гидролитического отщепления сульфонатных групп зависит от заместителей в ароматическом кольце. В общем случае действует правило — чем легче идёт сульфирование — тем легче гидролизуется образовавшая сульфокислота. В качестве примера можно привести получение 2,6-динитроанилина. Синтез этого вещества начинают с сульфирования хлорбензола. Полученную 4-хлорбензолсульфокислоту нитруют, замещают атом хлора на аминогруппу и отщепляют сульфогруппу нагреванием с разбавленной соляной кислотой:
2. С разрывом CS-связи соли ароматических сульфокислот реагируют при сплавлении с гидроксидами щелочных металлов. Эта реакция представляет собой один из способов получения фенолов:
3. При сплавлении с цианидами щелочных металлов сульфонатная группа замещается на цианогруппу. Так, например, из образующейся при сульфировании пиридина пиридин-3- сульфокислоты получают нитрил никотиновой кислоты:
196
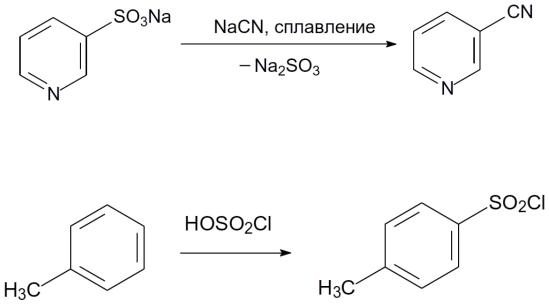
4. Получение хлорангидридов: Сульфохлориды образуются также при взаимодействии ароматических соединений с избытком хлорсульфоновой кислоты:
По свободнорадикальному механизму с образованием хлорангидридов сульфокислот протекает сульфохлорирование алифатических соединений диоксидом серы и хлором.
Сульфохлорирование высших углеводородов по этой реакции протекает неизбирательно, но с некоторыми углеводородами выходы одного из возможных продуктов взаимодействия оказываются достаточно высокими, поскольку атомы водорода у вторичного атома углерода замещаются легче, чем у первичного, а
третичные СН-связи в реакцию сульфохлорирования не вступают из-за стерических затруднений.
По свободнорадикальному механизму с образованием хлорангидридов сульфокислот протекает сульфохлорирование алифатических соединений диоксидом серы и хлором.
Сульфохлорирование высших углеводородов по этой реакции протекает неизбирательно, но с некоторыми углеводородами выходы одного из возможных продуктов взаимодействия оказываются достаточно высокими, поскольку атомы водорода у вторичного атома углерода замещаются легче, чем у первичного, а
третичные СН-связи в реакцию сульфохлорирования не вступают из-за стерических затруднений.
197
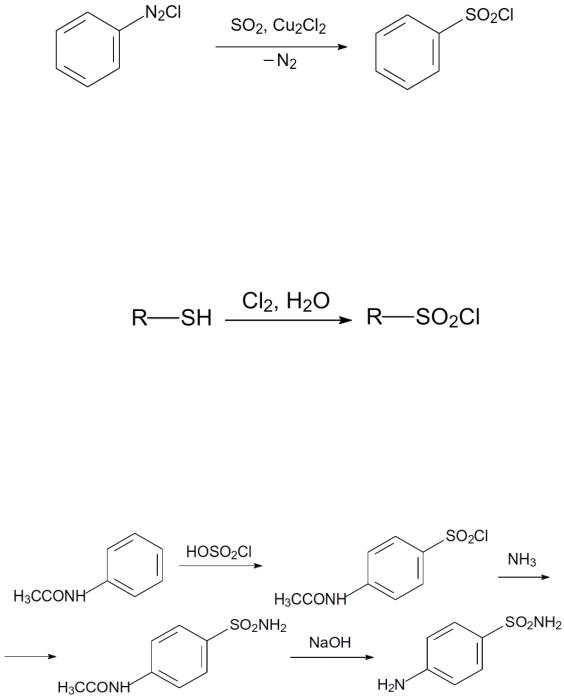
Обычно эту реакцию используют для получения амидов сульфокислот. Для этого, не выделяя из реакционной массы достаточно устойчивый к действию воды в кислой среде сульфохлорид, к реакционной массе добавляют соответствующий амин и извлекают из неё образовавшийся амид. Сульфохлориды образуются также при хлорировании тиольных соединений в воде:
5. Синтез сульфанамидных бактерицидных препаратов:
Механизм их действия основан на ингибировании биосинтеза дигидрофолиевой и тетрагидрофолиевой кислот вследствие блокировки фермента дигидроптероатсинтазы.
Сульфаниламид, известный под названием стрептоцид, синтезируют из ацетанилида по схеме:
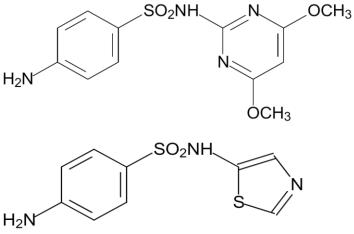
В качестве примера других соединений этого ряда с более широким спектром антибактериальной активности можно привести структуры сульфодиметоксина и норсульфазола:
198
199
