
- •1. Стабильность Si-C-связей, влияние заместителей в связанном с атомом кремния остатке.
- •2. Реакция Пудовика. Исходные соединения, связь с реакцией Кабачника—Филдса в варианте с основаниями Шиффа.
- •3. Реакционная способность и стабильность металлорганических соединений. Основные способы получения металлорганических соединений.
- •4. Способы получения и химические свойства литийорганических соединений.
- •5. Получение алкиларсиновых кислот по реакции Мейера, получение ариларсиновых кислот по реакции Барта.
- •6. Реакции литий- и магнийорганических соединений с альдегидами, кетонами, сложными эфирами, ортоэфирами и нитрилами.
- •7. Номенклатура фосфорорганических соединений и органических производных серы.
- •8. Роль растворителей при получении литий- и магнийорганических соединений.
- •9. Исходные продукты для получения тиофосфатов с инсектицидной активностью (хлортиофосфаты и дитиофосфаты), получение фоксима и карбофоса.
- •10. Способы получения, токсические характеристики и практическое использование органических производных свинца
- •11. Гидролиз и ацидолиз эфиров кислот фосфора. Получение триметилсилильных эфиров кислот фосфора, реакция МакКенны.
- •12. Реакции ацидолиза эфиров кислот фосфора, ацидолиз при получении диалкилфосфитов, условия перегонки реакционных масс. Окисление и галогенирование диалкилфосфитов.
- •13. Получение кремнийорганических аналогов биологически активных веществ, получение силамепробамата. Эффект замены атома углерода на атом кремния в биоактивных соединениях.
- •14. Метаболизм кремнийорганических соединений.
- •15. Способы получении и свойства алюминийорганических соединений. Применение в производстве полимеров
- •16. Жидкость Кадэ. Хлорвинилхлорарсины, получение, токсические характеристики, механизм действия, антидоты.
- •17. Получение эфиров арилбороновых кислот и использование их в реакции Сузуки.
- •18. Взаимодействие α-галогензамещеных кетонов с триалкилфосфитами (реакция Перкова и Михаэлиса-Арбузова). Винилфосфаты в качестве ингибиторов холинэстеразы.
- •19. Механизм гербицидной активности глюфосината (фосфинотрицина), способы его получения. Токсичность и побочные эффекты для теплокровных.
- •20. Получение кремнийорганических соединений
- •21. Получение силиконовых полимеров, регуляция молекулярной массы, вулканизация. Их практическое использование.
- •22. Реакции Барта и Несмеянова.
- •23. Способы получения диэфиров фосфористой кислоты.
- •24. Примеры фосфорорганических соединений с инсектицидной активностью, получение диалкилхлортиофосфатов. механизм выработки резистентности на примере карбофоса.
- •25.Реакция Вюрца-Фиттига, механизм избирательности в варианте Фиттига. Промежуточные продукты в реакциях арилхлоридов с хлоридами элементов и металлическим натрием.
- •26. Присоединение диалкилфосфитов к кратным связям (С=С, С=О, С=N), реакция Абрамова и Пудовика.
- •27. Способы получения и свойства цинкорганических соединений, использование их в реакции Реформатского и для получения карбонильных соединений.
- •28. Ртутьорганические соединения. Способы получения и химические свойства. Гранозан (этилмеркурхлорид), токсичность органических производных ртути.
- •29. Превращения функционализированных по β-положению кремнийорганических соединений.
- •30. Ингибирование холинэстеразы соединениями с ацилирующей способностью, особенности ингибирования производными кислот фосфора, формула Шрадера.
- •31. Способ получения и биологическая активность силатранов
- •32. Способы получения и биологическая активность органических производных германия, герматраны.
- •33. Получение триариловых и триалкиловых эфиров фосфористой кислоты.
- •34. Способы получения и практическое использование оловоорганических соединений.
- •35. Механизм реакции Михаэлиса-Арбузова, реакционная способность исходных соединений, побочная реакция.
- •36. Способы получения мышьякорганических соединений, Реакция Бешама. Сальварсан
- •38. Биологическая активность бисфосфонатов. Примеры и способы получения бисфосфонатных средств для лечения остеопороза
- •40. Реакция диалкилфосфитов с изоцианатами, побочная реакция. Получение кренайта, механизм биологической активности.
- •41. Получение илидных соединений из диалкилсульфидов и диметилсульфоксида, синтез на их основе оксиранов и циклопропанов.
- •42. Антихолинэстеразная активность фосфорорганических соединений. Обратимое и необратимое ингибирование холинэстеразы. Примеры обратимого и необратимого ингибирования в ряду фосфорорганических инсектицидов.
- •43. Реактивация ацилированной фосфорорганическими соединениями холинэстеразы производными гидроксиламина, оксимы в качестве антидотов и фоксим.
- •44.Синтез и свойства тиольных соединений алифатического ряда
- •45. 2-Хлорэтильные производные в ряду кремний- и фосфорорганических соединений. Синтез хлорэтилфосфоновой кислоты, механизм дефолиантного действия.
- •46. Гербицидная активность фосфонометилглицина (глифосата). Способы его получения. Экологические последствия использования глифосата.
- •47. Синтез и свойства тиольных соединений ароматического ряда.
- •48. Три возможных направления использования кремнийорганических соединений в химии биологически активных соединений, привести примеры.
- •49. Получение арсоновых и арсиновых кислот по реакциям Барта и Мейера.
- •50. Зависимость токсичности от строения для фосфорорганических соединений, эмпирическая формула Шрадера.
- •51. Фосфорорганические соединения с противовирусной активностью. Получение фосфонуксусной кислоты и тринатриевой соли фосфонкарбоновой кислоты. Механизм противовирусной активности.
- •52.Взаимодействие трихлорида мышьяка с ароматическими соединениями и с ацетиленом, токсичность α-, β- и γ-льюизита, дифенилхлорарсин и фенарсазинхлорид.
- •53. Зависимость токсичности от строения в ряду нитрофениловых эфиров фосфорной и тиофосфорной кислоты. Получение О-метил-О-этилового эфира хлорангидрида тиофосфорной кислоты.
- •54. Способы получения и свойства тиофосфорных и тиофосфористых кислот. Правило ЖМКО в реакции их солей с органическими галогенидами
- •58.Биологическая активность синтетических селенорганических соединений. Получение и антиоксидантная активность эбселена.
- •59.Получение и химические свойства диметилсульфоксида в качестве растворителя и реагента
- •60.Роль серосодержащих аминокислот в составе белков и в метаболизме. Биосинтез цистеина.

43. Реактивация ацилированной фосфорорганическими соединениями холинэстеразы производными гидроксиламина, оксимы в качестве антидотов и фоксим.
Для лечения острых отравлений антихолинэстеразными токсикантами были разработаны антидотные композиции, в состав которых наряду с антагонистами ацетилхолина, обратимыми ингибиторами холинэстеразы и успокаивающими средствами входят различные производные гидроксиламина. При этом антидотный состав должен быть введён в виде инъекции в течение нескольких минут после появления первых признаков отравления для того, чтобы предотвратить необратимое ингибирование основного пула холинэстеразы. Переход фосфорилированной холинэстеразы в состояние, которое не поддается регенерации, часто называют
«старением» ингибированной холинэстеразы. Одним из соединений, нейтрализующих попавший в организм токсикант, может быть, например, гидроксамовая кислота на основе никотиновой кислоты. Она взаимодействует с поступающим в организм антихолинэстеразным ядом, разлагая его до того, как он прореагирует с холинэстеразой:
|
|
O |
|
|
|
|
|
|
C |
RO |
|
O |
NCO |
RO |
O |
|
|
|||
|
NHOH |
P |
+ HF |
+ |
||
P |
|
+ |
||||
|
RO |
|
OH |
|
||
RO |
F |
|
|
N |
||
N |
|
|
|
|||
|
|
|
|
|
|
Промежуточным продуктом в этой реакции является фосфорилированная по гидроксильной группе гидроксамовая кислота, которая разлагается на диалкилфосфат и соответствующий изоцианат, гидролизующийся водой с образованием нестойкой карбаминовой кислоты.
Еще одна группа средств для нейтрализации таких ядов представлена монооксимами α-дикарбонильных соединений. Так, например, монооксим диацетила,
образующийся при нитрозировании метилэтилкетона, реагирует с диалкилфторфосфатом по схеме:
RO |
O |
O |
|
C |
|
CH3 |
RO |
O |
|
P |
|
|
|
|
+ CH3CN + CH3COOH + HF |
||||
|
+ |
|
|
|
|
|
P |
||
RO |
F |
HON |
|
|
C |
|
CH3 |
RO |
OH |
|
|
|
|||||||
147
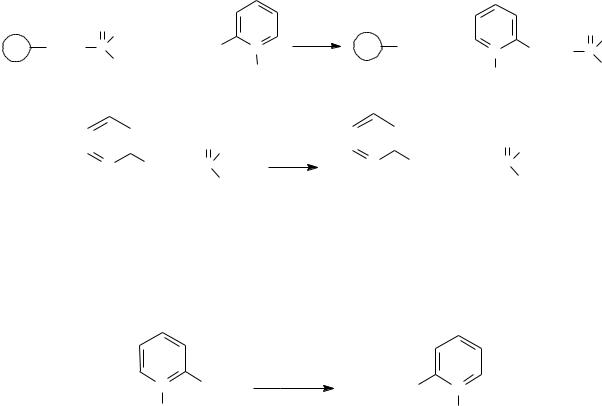
Промежуточным продуктом и в этом случае является фосфорилированный по гидроксильной группе оксим, разлагающийся водой с образованием диалкилфосфорной кислоты, уксусной кислоты и ацетонитрила.
Ещё одна группа соединений предназначена для реактивации фосфорили-
рованных молекул холинэстеразы, фосфорильная группа которых ещё не перешла в ионную форму. Этими антидотами являются оксимы альдегидов на основе пиридиниевых солей. Реакция такого оксима с фосфорилированной холинэстеразой протекает по схеме:
|
|
O |
OR |
|
|
|
+ |
|
|
|
|
|
|
|
O |
OR |
|
|
|
|
|
|
|
|
|
|
|
+ |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
ХЭ |
|
|
+ |
|
|
|
ХЭ |
CH2OH |
+ |
|
|
|
|
|||
CH O |
P |
HON=CH |
|
|
N |
|
|
|
|
|
||||||
|
|
|
|
N |
CHNO |
P |
|
|||||||||
|
2 |
|
OR |
|
I |
- |
|
|
|
|
I |
- |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
CH |
|
|
|
|
CH |
|
|
OR |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
+ |
|
|
|
|
O OR |
|
+ |
|
|
|
|
|
O OR |
|||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
N |
|
CHNO |
|
P |
N |
CN + HO |
|
P |
||||||||
|
|
|
|
||||||||||||||
|
|
|
|||||||||||||||
- |
|
|
I- |
|
|
|
|
|
|||||||||
I |
|
|
|
|
|
|
|
OR |
|
|
|
|
|
|
OR |
||
CH |
3 |
|
|
|
|
CH3 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
В соответствии с представленной схемой превращений соль оксиминометилзамещенного метилпиридиния (2-ПАМ), получаемая нитрозированием иодида N-метил-α-пиколиния
|
|
+ |
|
C H ONO |
|
|
+ |
|
|
|
|
N |
CH |
4 |
9 |
|
|
|
|
I |
- |
3 |
HON=CH |
I |
- |
N |
|
||
|
|
|
|||||||
|
|
|
|
|
|
|
|||
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
, |
|
|
|
|
|
|
|
|
|
|
реактивирует фосфорилированную холинэстеразу и превращается в соответствующий нитрил. При этом роль четвертичного атома азота в молекуле 2-ПАМ состоит в фиксации молекулы антидота в активном центре фермента в результате взаимодействия с анионным сайтом, предназначенным для связывания с триметиламмонийной группой в молекуле ацетилхолина.
Многие О-фосфорилированные производные гидроксиламина соответствуют формуле Шрадера и, согласуясь с этим, они должны быть антихолинэстеразными ядами.
148
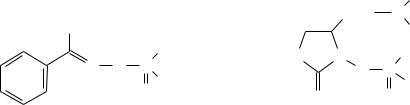
В качестве примера таких соединений можно назвать инсектицид фоксим и один из токсинов сине-зеленых водорослей:
CN |
|
|
|
|
|
|
|
OC H |
|
|
|
|
2 |
5 |
N |
O |
P |
|
|
|
|
S |
OC H |
|
|
|
2 |
5 |
|
|
|
|
CH |
|
|
|
3 |
|
CH |
N |
|
|
2 |
|
|
|
|
|
CH |
|
|
|
3 |
HN |
N |
|
OH |
|
|
||
|
O |
P |
OCH |
|
|
|
|
|
NH |
O |
3 |
|
|
||
Фоксим |
Анатоксин а(s) |
Из этого следует, что представленные выше гидроксамовые кислоты, оксимы
α-дикарбонильных соединений и оксимы альдегидов можно использовать в качестве антидотов только потому, что продукты их фосфорилирования разлагаются на малотоксичные соединения сразу после образования.
149
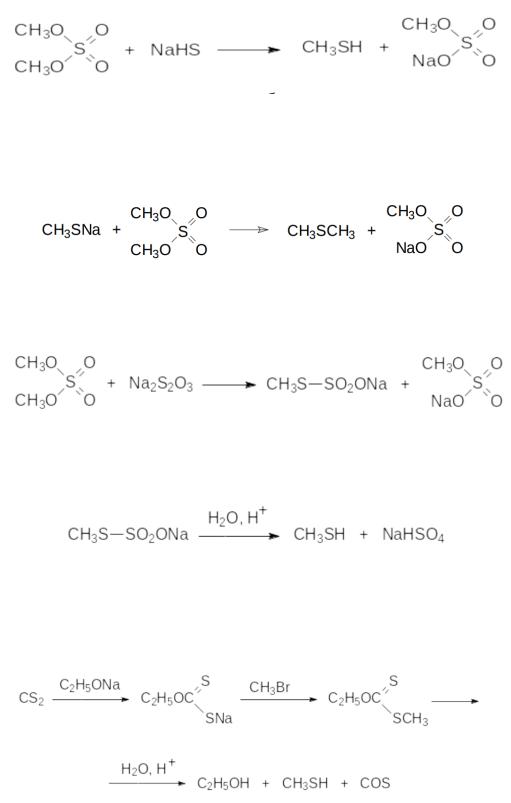
44.Синтез и свойства тиольных соединений алифатического ряда
Способы получения тиольных соединений включают прямое алкилирование гидросульфидов щелочных металлов алкилгалогенидами, диалкилсульфатами или алкилсульфонатами. Так, например, из диметилсульфата и гидросульфида натрия можно получать метантиол:
Эта реакция сопровождается образованием значительного количества диметилсульфида в результате алкилирования диметилсульфатом соли образовавшегося метилмеркаптана:
Более избирательно протекает образование меркаптанов в двухстадийном процессе, когда на первой стадии проводят алкилирование тиосульфата:
Полученные соли моноэфиров тиосерной кислоты (их иногда называют солями Бунте) гидролизуются в присутствии кислот с образованием алкантиолов:
Аналогичный способ получения тиолов представлен алкилированием и последующим гидролизом моноэфиров дитиоугольной кислоты (ксантогенатов), образующихся по реакции алкоголятов с сероуглеродом:
150
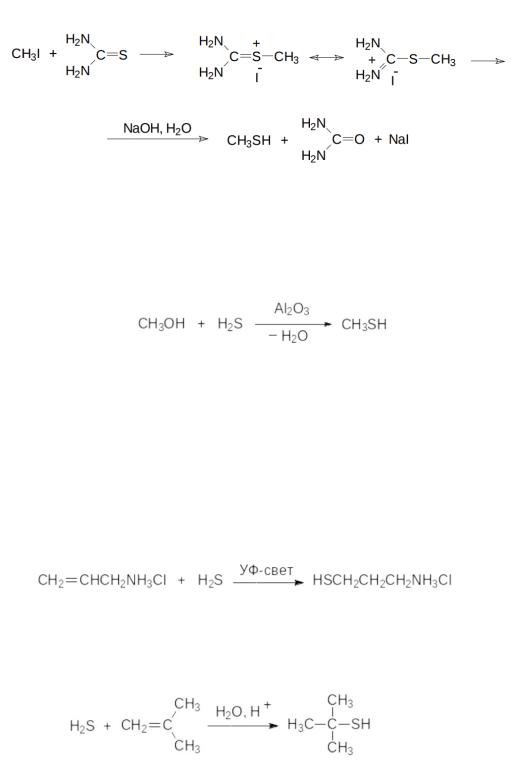
Побочным продуктом этой реакции становится серооксид углерода, представляющий собой очень токсичный и легко воспламеняющийся газ. Тиолы образуются также при щелочном гидролизе тиурониевых солей, которые получаются при алкилировании тиомочевины алкилгалогенидами:
Однако промышленное производство метантиола, используемого, в частности, в производстве аминокислоты метионина, основано на алкилировании сероводорода метанолом в газовой фазе при катализе оксидом алюминия при температуре 300-350 °С:
Тиольные соединения образуются также в результате присоединения сероводорода к двойным связям олефинов. В присутствии генераторов свободных радикалов или при облучении УФ светом присоединение протекает против правила Марковникова. Так, например, в кварцевом реакторе гидрохлорид аллиламина реагирует с избытком сероводорода в спиртовой среде в свете ртутной лампы с образованием гидрохлорида 3- меркаптопропиламина:
Олефины, легко образующие карбокатионы, присоединяют сероводород в присутствии кислот:
Побочными продуктами в реакциях присоединения сероводорода к олефиновым соединениям являются соответствующие тиоэфиры, а при недостатке сероводорода это направление реакции становится основным.
151
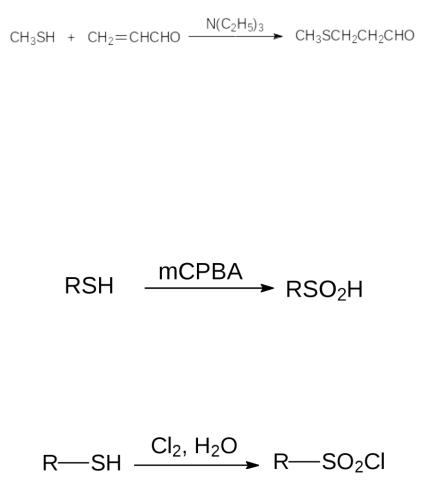
Свойства. Тиолы представляют собой более сильные кислоты, чем спирты, поскольку SH-связь слабее OH-связи, и в более объёмном атоме серы лучше распределяется образующийся в результате ухода протона отрицательный заряд. По этой же причине и селенолы являются более сильными кислотами, чем тиолы. Кроме того, гидроксильные группы образуют более прочные водородные связи, чем тиольные группы. Следствием этого становится более высокая температура кипения спиртов в сравнении с аналогичными тиолами (78,4 °С для этанола и, соответственно, 35 °С для этантиола). Против правила Марковникова в присутствии оснований сероводород и тиолы присоединяются к активированным электроноакцепторными группами двойным связям:
Интересно, что при катализе ацетатом меди выход целевого продукта в этой реакции может достигать 97 %. Получение сульфиновых кислот окислением тиолов проводят действием галогенов, пероксида водорода или надкислот. При этом важно подобрать условия проведения реакции так, чтобы исключить дальнейшее окисление образующихся сульфиновых кислот до сульфокислот. Избирательным окислителем тиолов до сульфиновых кислот является м- хлорнадбензойная кислота (mCPBA):
Ароматические сульфиновые кислоты получают с высоким выходом окислением соответствующих тиолов 30 %-ным пероксидом водорода при комнатной температуре. Сульфохлориды образуются также при хлорировании тиольных соединений в воде:
152
