
- •Семинары по физической химии 1 часть
- •Физическая химия
- •Теория
- •Задачи
- •Второй закон термодинамики
- •Объединенное выражение I и II начал термодинамики. Зависимость энтропии от параметров состояния
- •Типы задач
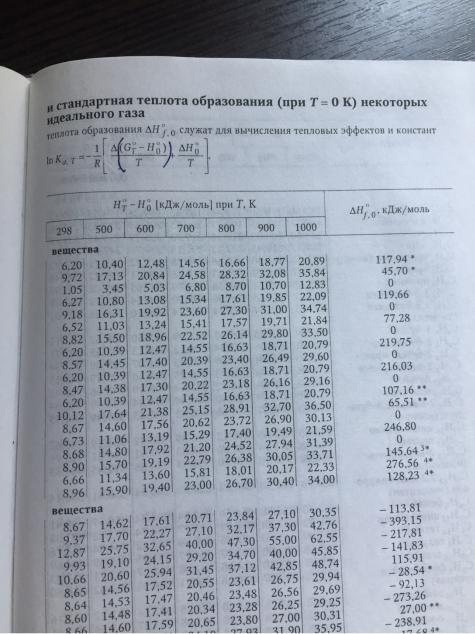
- •Рассчитайте изменение энтропии при изобарном нагревании 1 моль хлора от температуры 300 до 500 К. Воспользуйтесь справочными данными о зависимости теплоемкости хлора от температуры.
- •Рассчитайте изменение энтропии в реакции синтеза аммиака при температуре 598 К и давлении 1 атм.
- •Энергия Гиббса. Энергия Гельмгольца.
- •Типы задач
- •Рассчитайте изменение энергии Гиббса, если в результате расширения 20 кг гелия при 298 К объем газа увеличился в 1 000 раз. Газ считать идеальным.
- •Рассчитайте изменение энергии Гельмгольца, если в результате сжатия 500 моль кислорода при 400 К давление газа увеличилось в 100 раз. Газ считать идеальным.
- •Расчет изменения энергии Гиббса при смешении идеальных газов
- •54 г воды испаряются при 373 К и давлении 1 атм, а затем изотермически расширяются до давления 0,1 атм. Рассчитайте общее изменение энергии Гиббса и энергии Гельмгольца.
- •Рассчитайте изменение энергии Гиббса и энергии Гельмгольца при стандартных условиях и температуре 400 К для реакции H2 + 1/2O2 = H2O(ж), считая температурный коэффициент энергии Гиббса величиной постоянной. Воспользуйтесь справочными данными.
- •Рассчитайте изменение энергии Гиббса и энергии Гельмгольца при стандартных условиях и температуре 400 К для реакции H2 + 1/2O2 = H2O(ж), считая температурный коэффициент энергии Гиббса величиной постоянной. Воспользуйтесь справочными данными.
- •Уравнение Гиббса-Гельмгольца
- •Химическое равновесие
- •Влияние общего давления и добавления инертного газа на смещение равновесия
- •Уравнение изотермы Вант-Гоффа
- •Уравнение изотермы Вант-Гоффа
- •Уравнение изобары Вант-Гоффа
- •Методы расчета константы равновесия
- •Фазовое равновесие в однокомпонентных системах
- •Фазовое равновесие в однокомпонентных системах
- •Уравнение Клапейрона
- •Уравнение Клапейрона-Клаузиуса
- •Парциальные мольные величины
- •Методы определения парциальных молярных величин
- •Коллигативные свойства
- •Фазовая диаграмма для растворителя и раствора
- •Основные формулы
- •Основные формулы
- •В 1000 г воды растворили 0,0684 кг сахарозы (M = 342 г/моль). Удельная теплота испарения воды 2256,7 кДж/кг. Рассчитать давление пара над раствором при 500С и температуру кипения раствора. Воспользоваться справочными данными.
Методы расчета константы равновесия
1)поданным о равновесном составе реакционной смеси при
некоторойтемпературе =
2)потемпературнымзависимостямконстант равновесия, т. 41
3) поизвестным значениям rG° на основании уравнения изотермы Вант-Гоффа и пометодуТёмкина-Шварцмана, т. 45
4)поизобарно-изотермическимпотенциалам (по приведенной энергииГиббса), т.50
5)повеличинам логарифмовконстант равновесия реакций образованиясоединений из простыхвеществ, т. 49
6)метод комбинированияхимическихуравнений
Для реакции 2NO + O2 = 2NO2 |
зависимостьконстантыравновесияот |
||||||||||
= |
601 7,2 |
− 0,998 + 0,302 ∙ 10 |
−3 |
− |
0,2 37∙ 105 |
− 5,175 |
|||||
|
|
|
2 |
||||||||
температуры |
имеет вид(т. 41): |
|
|
|
|
|
|
|
|||
Рассчитатьконстантуравновесия притемпературе500К. |
2105 − 5,175 |
||||||||||
lgKa = 601 7,2 − 0,998 ∙ lg 500 + 0,302 ∙ 10−3 |
∙ 500 − 0,2 37∙ |
||||||||||
500 |
|
|
= 4,222 |
|
|
500 |
|
||||
|
|
|
= 104,22 2 |
= 1 6 674 |
|
|
|
||||
|
|
|
|
1= −4,222 |
|
−5 |
|
|
|
||
|
|
|
|
2NO2= 2NO + O2 |
|
|
|
|
|
||
|
|
|
|
= 1 6674 |
= 6∙ 10 |
|
|
|
|
||
Методприменимтолькодлягазофазныхреакций. |
|
||||||||||
Для реакции 2NO + O2 = 2NO2 рассчитатьконстантуравновесия при температуре500К.СтандартнуюэнергиюГиббсаопределить пометоду Тёмкина-Шварцмана(т. 45).
rG°Т = rH°298 – TΔrS°298 – T( raM0 + rbM1 + rcM2 + rc′M-2)
rH°298= -114,14 кДж/моль rS°298= -146,20 Дж/моль ∙K ra = -8,3
rb= 11,57 ∙ 0,001 rc′= -9,09 ∙100000
M0=0,1133 M1=0,0407∙1000 M-2=0,0916/100000 M2 – не учитывается
Для реакции 2NO + O2 = 2NO2 рассчитатьконстантуравновесия при температуре500К.СтандартнуюэнергиюГиббсаопределить пометоду Тёмкина-Шварцмана(т.45).
rG°Т= -114140 – 500*(-146,20) – 500*(-8,3*0,1133 +
11,57*0,0407 - 9,09*0,0916) = -40,39 кДж/моль
° = −
= − °
= −−40390 = 1 6579
8,31∙500
Методприменимдля любых реакций,вт.ч.гетерофазных.
Для реакции 2NO + O2 |
= 2NO2 |
рассчитатьконстантуравновесия при |
|||||||||
температуре500К по |
приведеннымизобарно-изотермическим |
||||||||||
потенциаламреагентов (т. 50). |
∆ ° − ° + ∆ ° |
||||||||||
|
|
|
|
|
= − |
||||||
− |
°− 0 |
° |
= Ф |
– приведенная |
энергия Гиббса |
|
|||||
∆r |
T |
|
|
= 2 ∙ |
−22 4,12 − 2 ∙ |
−195,63 |
+ 191,06 = 1 34,08 Дж/моль∙К |
||||
|
GT°−H0° |
|
|
|
|
|
|
|
кДж |
||
|
|
|
|
∆rH0° = 2 ∙36,5 − 2 ∙ 90,15 − 0 = −107,3моль |
|||||||
|
|
|
|
|
|
1 |
|
|
−1 07300 |
|
|
|
|
|
|
lnKa = −8,31 |
1 34,08 + |
|
500 |
= 9,68 |
|||
|
|
|
|
|
|
|
= 9,68 = 1 6 073 |
|
|||
Метод применим только для газофазных реакций.


Для реакции 2NO + O2 |
= 2NO2 |
рассчитатьконстантуравновесия при |
||
температуре500К по |
величинамлогарифмов константравновесия |
|||
реакцийобразованиясоединенийиз простыхвеществ(т. 49). |
||||
, |
|
|
|
|
= 0 |
– |
для простых веществ |
|
исх |
||
|
= |
прод − |
||||
|
|
= 2 ∙ 2 |
− 2 ∙ − |
2 |
||
|
|
= 2∙ −6,77 |
− 2 ∙ −8,88 |
− 0 = 4,22 |
||
= 104,22 = 1 6 596
Метод применимдлялюбых реакций,вт.ч.гетерофазных.

Для реакции (*) N2+ 3H2 = 2NH3 выразить константуравновесия Kp через |
|||||
константыравновесийследующихреакций: |
|
||||
(1) |
2H2 + O2= 2H2 O |
|
Kp1 |
|
|
(2) |
4NH3 + 3O2= 6H2 O + 2N2 |
3 |
Kp2 |
|
|
|
|
1 |
+ ½* 3O2+ 3/2*2H2 O |
||
½*6H2 O + ½*2N2+3/2*2H2+ 3/2O2 = ½* 4NH3 |
|||||
|
= |
2 ∙ |
1 − 2 |
∙ 2 |
|
|
3 |
|
1 |
∙ °2 |
|
|
° = 2 ∙ |
°1 − 2 |
) |
||
|
− = − 13/2 − (− 1/22 |
||||
|
= 13/2 − 1/22 |
|
|||
|
= |
13 |
|
|
|
|
2 |
|
|
||
Метод применим для любых реакций,вт.ч.гетерофазных. |
|
||||
Рассчитайте изменение энергии Гиббса и энергии Гельмгольца при
стандартных |
условиях |
и температуре 800 К для реакции |
||||
2NO + O2 = 2NO2 |
на основе данных о константе равновесия. |
|||||
1. |
∆ ° |
= ∆ °2 98 + |
2 98(−∆ °) |
|||
∆ ° |
= |
|
|
|
∫ |
|
∆ °2 98 −∆ °( −2 98) |
||||||
2. |
rGT = |
r HT – TΔr ST - уравнение Гиббса-Гельмгольца |
||||
r HT= |
r H298 |
+ |
r Cp(T-298) |
|||
r ST= |
r |
S298 + |
r Cp*ln(T/298) |
|||
3. |
° = − |
|
||||
= ( ) |
|
|
|
|||

Рассчитайте изменение энергии Гиббса и энергии Гельмгольца при
стандартных условиях |
и |
температуре |
800 К для реакции |
||||
2NO + O2 = 2NO2 на основе данных о константе равновесия. |
|
||||||
3. ° = − |
|
|
|
|
|
∙ 800 − 0,2 37∙2105 |
− 5,175 |
lgKa = 601 7,2 − 0,998 ∙ lg 800 + 0,302 ∙ 10−3 |
|||||||
800 |
|
= −0,346 |
800 |
|
|||
= 10−0,346 |
= 0,451 |
|
|||||
° = − = −8,r31 ∙ 800r |
∙ |
r 0,451 = 5,30 кДж/моль |
|||||
|
G = |
A + |
νRT |
|
|
||
∆ °800 = 5300 − |
rA = |
rG – |
rνRT |
|
|
||
−r 1 |
· 8,31 · 800 = 11,95 кДж/моль |
|
|||||
|
ν = 2 – 2 – 1 = -1 |
|
|
||||
