
Введение в теорию конденсированных сред. учебное пособие. Юрьев В.А., Ожерельев В.В
.pdf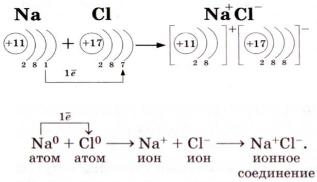
электростатического притяжения.
Для примера рассмотрим образование молекулы поваренной соли (рис. 2.2).
Рис. 2.2. Схема ионной связи [9]
Атом натрия (z =11) имеет один валентный электрон, расположенный вне устойчивой группы из восьми электронов, тогда как атом хлора (z = 17) имеет семь валентных электронов. Следовательно, для образования устойчивой группы из восьми электронов атом хлора нуждается еще в одном электроне. При химическом взаимодействии атом натрия отдает свой валентный электрон атому хлора. В результате молекула поваренной соли состоит из отрицательного иона хлора и положительного иона натрия. Между этими ионами устанавливается электростатическое притяжение: U = Ае2/r, приводящее к сближению их до расстояния, при котором сила притяжения
не сбалансируется силой отталкивания: W / rm , возникающей при перекрытии электронных внешних оболочек.
Таким образом, образование устойчивой молекулы при ионной связи в основном обеспечивается электростатическим взаимодействием противоположно заряженных ионов. Ионы при такой связи располагаются так, что кулоновские силы притяжения между ионами противоположного знака более
21
значительны, чем силы отталкивания между ионами одного знака. Вследствие этого степень ионизации атомов ионного кристалла, становится такой, что электронные оболочки всех ионов подобны внешним электронным оболочкам атомов инертных элементов.
Ионная связь характеризуется ненасыщенностью, т.е каждый атом (ион) стремится приблизить к себе как можно больше противоположно заряженных ионов, и ненаправленностью. Так, каждый из ионов натрия или хлора стремится окружить себя шестью ионами противоположного знака. У соединения СsС1, имеющего примерно те же размеры атомов, что и NаС1, решетка построена таким образом, что каждый ион хлора имеет восемь соседей ионов цезия, и наоборот.
Ионные кристаллы обладают высокими термическими и механическими характеристиками (прочностью, твердостью, высокими температурами плавления и малым коэффициентом термического расширения) благодаря большой энергии связи. Все ионные кристаллы являются изоляторами поскольку электроны сосредоточены на атомных орбиталях отдельных атомов и не могут принимать участия в проводимости.
2.3. Ковалентная связь
Качественной характеристикой ковалентной, или гомополярной, связи является обобществление внешних электронов двумя или большим числом атомов и образование устойчивых электронных групп (пs)2(пр)6. Основной особенность обобществленных электроны является то, что они имеют попарно противоположную ориентацию спинов. Это позволяет представить ковалентную связь как обменное взаимодействие электронов. При ковалентной связи электроны принадлежать частично обоим атомам и не связаны ни с одним из них. Следствием этого является перераспределение электронной плотности и изменение энергии системы атомов по сравнению с суммарной энергией изолированных атомов. Так, например,
22
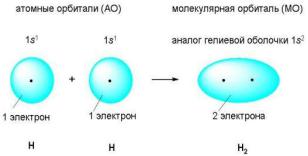
при образовании молекулы хлора H2 два атома водорода обобществляют два электрона (рис. 2.3).
Ковалентная связь проявляется не только тогда, когда для образования устойчивой оболочки требуется один электрон, но и в более сложных случаях.
Рис. 2.3. Схема ковалентной связи [10]
Например, в двухатомной молекуле кислорода (z = 8) каждый атом владеет двумя чужими коллективными электронами, а общими для молекулы являются четыре электрона. Каждый атом в ней удерживается двойными связями. В атоме азота (z = 7) на последней (п = 2) внешней оболочке имеется пять электронов, и, следовательно, при образовании молекулы для получения устойчивой оболочки из восьми электронов необходимы дополнительные три электрона. Поэтому каждый атом заимствует у соседнего три электрона, а коллективизируются шесть, которые образуют тройную связь [10].
Ковалентная связь характеризуется пространственной направленностью (рис. 2.4).
23
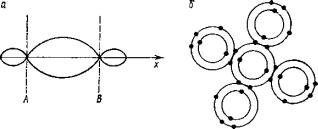
Рис. 2.4. Схема ковалентной связи [10]
Примером направленной связи может являться алмаз, построенный из атомов углерода. Атом углерода имеет четыре валентных электрона (два в 2s- и два в 2р-состояниях, z = 6) и образует электронные пары с четырьмя соседними атомами, симметрично расположенными в углах тетраэдра (рис. 2.4). Валентные электроны каждого атома алмаза распределены между четырьмя соседними так, что каждый атом образует свою группу из восьми электронов.
Кристаллы, в которых единственным типом связи является ковалентная, имеют высокие температуры плавления
иобладают высокой прочностью и твердостью. Подобно ионным кристаллам они являются изоляторами, поскольку, все их внешние электроны прочно связаны в ковалентных связях.
Ковалентной связь обладает насыщенностью, т.е. каждый атом может иметь связь только с тем количеством
своих соседей, которое необходимо для образования внешней устойчивой оболочки (пз)2(пр)6. Число таких соседей определяется правилом (8 – N). Здесь N – количество электронов на внешней оболочке данного атома. Это число одновременно соответствует его принадлежность к N-й группе периодической системы, а 8 – количество валентных s-
ир- состояний. В связи с этим правило (8 – N) не может быть применено к элементам I и III групп, поскольку в структуре этих атомов количество валентных электронов недостаточно
24
для образования путем обобществления внешних электронов завершенных (ns)2(np)6 – групп вокруг каждого атома.
2.4. Металлическая связь
Элементы металлической группы Периодической системы в основном обладают металлической связью. У атомов этих элементов не достаточно валентных электронов для образования ковалентной связи со всеми ближайшими соседями. В то же время между атомами металла не может возникнуть и ионная связь, так как они обладают одинаковым сродством к электронам. Например, атом меди с одним валентным электроном может образовать валентную связь только с одним атомом, тогда как в кристаллической решетке меди каждый атом окружен двенадцатью ближайшими соседними атомами.
При образовании металлической связи большое значение играют резонансные явления: переход валентных электронов в блуждающие, коллективизированные на весь объем металла. В этом случае при сближении атомов происходит перекрытие электронных оболочек не двух, а большего числа атомов (рис. 2.5).
Рис. 2.5. Схема металлической связи [11]
25
Выигрыш энергии при увеличении числа перекрытий обусловливает образование значительного числа связей. Результатом являются плотноупакованные структуры, неограниченно простирающиеся в пространстве.
Механизм образования атомных групп при металлической связи следующий. В ходе конденсации металлических паров валентные электроны теряют связь с собственными атомами и обобществляются на все количество атомов, содержащихся в объеме.
Атом при потере валентного электрона становится положительным ионом, поэтому металлическое жидкое или твердое тело представляет собой конденсат, состоящий из положительных ионов, погруженных в псевдо газ, образованный коллективизированными электронами. Так, например, при конденсации одного грамм-атома паров алюминия (26,98 г) количество обобществленных электронов равно 3×N (здесь 3 – число электронов в атоме алюминия на внешней оболочке, т.е. валентных электронов, а N = 6,023·1023
– число Авагадро).
Обобщённые электроны создают как бы своеобразный электронный газ, плотность которого возрастает с увеличением валентности металлического элемента. Связь в металлической решетке возникает за счёт кулоновского притяжения между положительными ионами и коллективными электронами. Свободные электроны такого газа, находящиеся между ионами, как бы стягивают их, уравновешивая силы отталкивания между одноименно заряженными ионами. При уменьшении расстояния между ионами плотность электронного газа увеличивается, а, следовательно, увеличиваются силы связи. С другой стороны, при уменьшении расстояния между ионами увеличиваются силы отталкивания, стремящиеся увеличить дистанцию между ионами. Равновесное расстояние между ионами достигается, когда притяжение уравновесится отталкиванием, решетка станет устойчивой.
26
Металлическая связь в отличии от ковалентной и ионной является ненасыщенной. Однако, хотя и предполагается, что в металлах коллективизируются все валентные электроны атомов, в то же время степень их обобщения зависит от силы связи валентных электронов с ядром. У щелочных металлов валентные электроны слабо связаны с атомами, и поэтому они легко коллективизируются. В общем случае, чем правее и выше расположен элемент в периодической системе, тем сильнее силы связи валентных электронов с атомами, тем труднее происходит их коллективизация. В связи с этим силы связи могут быть настолько большими, что при конденсации металлических паров может происходить лишь частичная коллективизация с одновременным образованием устойчивых кристаллов и атомных групп благодаря проявлению ковалентной связи. Так, например, в случае кристаллов из атомов переходных металлов образование устойчивых групп за счет коллективных электронов имеет подчиненное значение. Устойчивое существование кристаллов этих элементов прежде всего обеспечивается ковалентной связью, появление которой обусловлено наличием недостроенных внутренних оболочек в атомах. Поэтому энергия связи ионов в таких кристаллах очень высока по сравнению, например, со щелочными металлами (у железа энергия связи равна 96 кал/моль, а у натрия – 26 кал/моль) [11].
2.5. Ван-дер-Ваальсова связь
Образование молекул может происходить не только в случае обязательного перекрытия электронных оболочек. Силы, обусловливающие образование устойчивых молекул, а также систем из групп нейтральных атомов или молекул, находящихся на столь большом расстоянии друг от друга, что их волновые функции и электронные оболочки не перекрываются, называются Ван-дер-Ваальсовыми силами
[12].
27
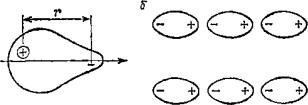
Возникновение сил связи в этом случае объясняется тем, что электронные оболочки атомов являются легкоподвижными и деформируемыми. Это их свойство приводит к появлению атомных электрических диполей (рис. 2.6) с электрическим моментом М = rе (r – расстояние между электроном и ядром, е – заряд электрона), значение и направление которого непрерывно меняются.
При достаточном приближении такого атомного диполя к другому атому движение электронов вокруг его ядра оказывает влияние на движение внешних электронов соседнего атома, вследствие чего у последнего возникает индуцированный дипольный момент. Например, если в конкретный момент у одного атома избыток электронов находится со стороны соседнего атома, то электроны последнего будут скапливаться под действием сил отталкивания с противоположной стороны (рис. 2.6).
Рис. 2.6. Схема связи Ван-дер-Ваальса [12]
Следствием согласованного распределения и движения внешних электронов, т.е. поляризации атомов, является уменьшение суммарной энергии системы атомов и появление сил кулоновского притяжения между ними, которые при определенных расстояниях между атомами уравновешиваются силами отталкивания. Результатом такого взаимодействия является образование устойчивых молекул или кристаллов, прочность которых обусловлена
28
способностью внешнего электронного облака атома к деформации: чем оно более деформируемо, тем прочнее связь.
Ван-дер-Ваальсова связь проявляется как между отдельными атомами, так и между молекулами в кристаллах. Образование молекул и кристаллов из атомов инертных элементов, внешняя оболочка которых устойчива, происходит только благодаря Ван-дер-Ваальсовым силам. В связи с тем, что их внешние атомные оболочки представляют собой устойчивые электронные группы, при сближении их атомов не наблюдается значительного перераспределения электронного облака, а, следовательно, не происходит и большого снижения энергии. Поэтому кривая (см. рис. 2.1) имеет слабо выраженный минимум U0, и для плавления и испарения этих веществ соответственно не требуется большого подвода тепла.
Повышение точки плавления и кипения этих элементов с возрастанием атомного номера (Не – 4, Nе – 27, Аr – 87, Кr – 121, Хе – 174 и Rn – 212) объясняется тем, что с увеличением количества электронов радиус внешней оболочки возрастает, а связь ее электронов с ядром атома уменьшается, поэтому такая оболочка деформируется сильнее, что приводит к значительному снижению энергии и повышению сил притяжения. Ван-дер-Ваальсовы связи могут возникать не только между атомами с заполненными оболочками но и между молекулами, поэтому они называются также
молекулярными силами. При наличии сильного взаимодействия (ковалентной связи) молекулярные силы играют роль небольшой добавки. В остальных случаях Ван- дер-Ваальсово взаимодействие составляет значительную долю общего взаимодействия.
29
3.ТЕПЛОТА
3.1.История познания теплоты
Втечение XIX столетия физикам удалось понять точный смысл двух основных величин в теории теплоты: количества тепла и температуры. На ранней стадии изучения казалось естественным считать тепло, «перетекающее» от горячего тела к холодному, некоторой особой субстанцией (теплородом). Однако около 1800 года многие эксперименты (особенно поставленные Румфордом) убедительно показали, что количество тепла в горячих телах связано с определенным видом движения, а именно с неорганизованным, хаотическим движением частиц, составляющих эти тела.
Таким образом, нагревание холодного тела сводится к тому, чтобы возбудить движение составляющих его частиц (молекул) посредством соударений с частицами (молекулами) горячего тела. С этой точки зрения и количество тепла, и разность температур, вынуждающую это тепло «перетекать», можно связать с такого рода молекулярными движениями.
Еще до 1800 года многократно измерялось количество тепла, необходимое для изменения температуры различных веществ на различную величину. На основе этих измерений были составлены таблицы теплоемкости – количества теплоты, необходимого для увеличения температуры данной массы вещества на один градус. Пытаясь систематизировать данные по теплоемкости, Пьер Дюлонг и Алексис Пти сделали одно важное наблюдение. Они заметили, что разные химические элементы в твердом состоянии поглощают примерно одинаковое количество тепла, при условии, что веса твердых тел, взятых для сравнения, пропорциональны их химическим атомным весам [12].
Атомные веса химических элементов – это числа, указывающие пропорции, в которых соединяются различные элементы при образовании сложных химических веществ. Например, углероду и кислороду приближенно припи-
30
