
Учебники 80359
.pdfКазалось бы, можно с равным основанием определить температуру как величину, пропорциональную средней кинетической энергии атомов твердого тела. Приведенное выше описание твердых тел позволяет предположить, что любая температурная шкала, основанная на свойствах газов, могла бы быть с тем же успехом основана на поведении твердого тела и все различие состояло бы в наличии множителя 2. Однако, в действительности тепловое поведение твердого тела много сложнее. Но это мы рассмотрим позже при изучении вопроса теплопроводности.
41

4. СТРОЕНИЕ КРИСТАЛЛИЧЕСКИХ ТВЕРДЫХ ТЕЛ
Тип химической связи во многом определяет спектр физических свойствах вещества. Например, ионные соединения обладают высокой твердостью и тугоплавкостью потому, что между зарядами их ионов "+" и "–" существуют мощные силы электростатического притяжения.
Например, в кристаллах хлористого натрия отрицательно заряженный ион хлора притягивает не только "свой" ион Na+, но и другие ионы натрия вокруг себя. Поэтому около любого из ионов находится не один ион с противоположным знаком, а несколько (рис. 4.1).
Рис. 4.1. Строение кристалла поваренной соли [13]
Фактически каждый иона хлора имеет в своём окружении 6 ионов натрия, а ион натрия – 6 ионов хлора. Такая упорядоченная упаковка ионов называется ионным кристаллом. В таком кристалле среди атомов хлора уже невозможно найти тот атом натрия, с которым хлор вступал в реакцию. Удержи-
42
ваемые электростатическими силами, ионы практически не меняют свое местоположение под влиянием внешнего усилия или повышения температуры. Но если хлорид натрия расплавить и продолжать нагревать в вакууме, то он испаряется, образуя двухатомные молекулы NaCl. Это свидетельствует о сохранении ковалентной связи [13].
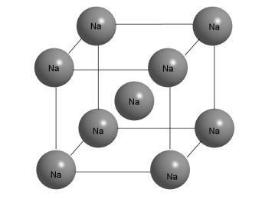
Строение металлические кристаллы иное. Структура металлического натрия, сильно отличается от поваренной соли. Натрий – мягкий металл, легко режется ножом, расплющивается молотком, его можно без труда расплавить в чашечке на спиртовке (температура плавления 97,8 С). В кристалле натрия каждый атом имеет в своём окружении 8 таких же атомов натрия.
Рис. 4.2. Строение кристалла металлического Na [13]
Из рисунка видно, что атом Na в центре куба имеет 8 ближайших соседей. Но, поскольку все они одинаковы, это выполняется для любого другого атома в кристалле, Кристалл состоит из "бесконечно" повторяющихся фрагментов, изображенных на этом рисунке.
На рис. 4.2 металлический кристалл выглядит достаточно простым, но на самом деле его электронное устройство сложнее, чем у кристаллов ионных солей. Число валентных
43

электронов у металлов недостаточно для образования полноценной ковалентной или ионной связи. Поэтому в газообразном состоянии большинство металлов состоит из отдельных, не связанных между собой атомов. Типичный пример - пары ртути. Металлическая связь между атомами металлов формируется только в процессе конденсации, т.е. в жидком и твердом агрегатных состояниях.
Металлическая связь описывается следующим образом: атомы металла в кристалле отдают свои валентные электроны в пространство между атомами, превращаясь в ионы. Уход валентных электронов происходит без затрат энергии. Ушедшие электроны формируют систему названную "электронным газом", который обеспечивает металлам хорошую тепло- и электропроводность.
Рис. 4.3. Упрощенная модель электронного строения металлического кристалла [13]
Попробуем рассмотреть природу металлической связи с точки зрения представлений об атомных орбиталях. Например, у атомов натрия имеется недостаток валентных электронов, зато имеются свободные валентные орбитали. Единственный 3s – электрон натрия может перемещаться на любую из свободных и близких по энергии соседних орбиталей. При
44
сближении атомов в кристалле внешние орбитали соседних атомов перекрываются и валентные электроны могут свободно перемещаются по всему кристаллу.
Однако "электронный газ" обладает собственным порядком. Составляющие его электроны в металлическом кристалле находясь на перекрывающихся орбиталях как бы обобществляются, образуя подобие ковалентных связей. Но у натрия, калия, рубидия и других металлических s- элементов обобществленных электронов просто мало, поэтому они непрочные и легкоплавкие. С увеличением числа валентных электронов прочность металлов, как правило, возрастает.
Рассмотри ещё раз кристалл NaCl. Он не проводит электрический ток, потому что в пространстве между ионами нет свободных электронов. Все электроны, отданные атомами натрия, прочно удерживают около себя ионы хлора. В этом одно из существенных отличий ионных кристаллов от металлических.
Металлическая связь позволяет объяснить и высокую пластичность большинства металлов. Дело в том, что электрические кулоновские силы, осуществляющие ковалентную и ионную связь направлены между центрами атомов, а в металлах эта кулоновская сила действует с равной вероятностью во всех во всех направлениях. Поэтому ионы в металлах можно сдвигать относительно друг друга увеличивать расстояние между ними без разрушения твёрдого тела.
Этого нельзя сделать с поваренной солью, хотя соль – тоже кристаллическое вещество. В ионных кристаллах валентные электроны прочно связаны с ядром атома (рис. 4.4). Сдвиг одного слоя ионов относительно другого приводит к сближению ионов одинакового заряда и вызывает сильное отталкивание между ними, в результате чего происходит разрушение кристалла (NaCl – хрупкое вещество).
Есть еще один вид кристаллов – это так называемые молекулярные кристаллы. "Строительными деталями" в них вы-
45

ступают отдельные молекулы, которые удерживаются рядом друг с другом силами межмолекулярного взаимодействия.
Рис. 4.4. Сдвиг слоев ионного кристалла вызывает появление больших сил отталкивания между одноименными ионами и разрушение кристалла [13]
Эти силы могут иметь различную природу. Например, у воды это водородные связи. Молекулы также могут связываться друг с другом слабым электростатическим дипольдипольным взаимодействием – т.е. притяжением разноименных частичных зарядов (как в кристаллических органических веществах). Это могут быть и межмолекулярные силы, возникающие при поляризации одних молекул другими – в результате случайного перераспределения электронной плотности в одной из молекул. Такое взаимодействие называется индукционным или наведенным. Например, молекулы I2 неполярные, но состоят из "больших" (относительно, конечно) атомов, электронные оболочки которых легко поляризуются под влиянием соседних частиц или стенок сосуда. Силы межмолекулярного взаимодействия слабее настоящих химических связей, поэтому молекулярные кристаллы непрочные. В принципе, эти же силы удерживают молекулы друг около друга и в жидкостях и молекулярные кристаллы обычно легко плавятся или даже возгоняются. Возгонка – переход вещества из твердого состояния в газообразное, минуя жидкое.
46

Но если температура не велика (ниже точки плавления или возгонки), то молекулы собираются в упорядоченные каркасы, где каждая из них ориентирована в пространстве строго определенным образом. Хороший пример - молекулярные кристаллы льда, в которых молекулы H2O располагаются в строгом порядке относительно друг друга (рис. 4.5).
Рис. 4.5. Модель растущего кристалла льда (красные шарики – атомы кислорода, белые шарики - атомы водорода в молекулах H2O) [13]
Отдельные молекулы воды связаны друг с другом водородными связями (показаны пунктирными линиями) в строгом порядке. Это приводит к причудливым симметричным формам кристаллов (вспомните форму снежинок). Лёд – молекулярный кристалл.
47

Наиболее прочными являются кристаллы, в которых атомы в решетке связаны ковалентными связями. Такие кри-
сталлы называют ковалентными каркасными кристаллами
или атомными кристаллами. В них отдельные атомы связанны ковалентными или полярными ковалентными связями в «бесконечный» трехмерный каркас. Тела с атомной кристаллической решеткой обладают высокой механической прочностью, не имеют запаха и нерастворимы в воде.
На рис. 4.6 приведен фрагмент атомной кристаллической решетки оксида кремния SiO2 (песок, кварц). Атомы кремния и кислорода связаны полярными ковалентными связями. Но структура SiO2 совсем не такая, как у углекислого газа СO2, который состоит из отдельных молекул O=C=O с двойными связями. Кремний не склонен образовывать двойные (и вообще кратные) связи.
Рис. 4.6. Оксид кремния SiO2 – фрагмент структурной формулы (а) и строение атомного кристалла (б) [13]
Большую роль в этом играет большой размер атомов кремния. Двойные связи действуют только на малых расстояниях между ядрами. Большой диаметр атомов кремния препятствует образованию кратных связей. Если бы SiO2 был
48
устроен так же, как СO2, то был бы, скорее всего, газообразным.
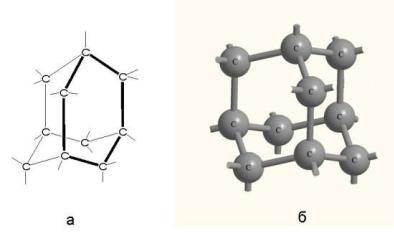
Хорошо известный атомный кристалл алмаз состоит только из одного элемента углерода, из которого состоит и графит. В алмазе каждый 4-х валентный атом углерода связан другим атомом углерода ковалентной связью и количество таких связанных в каркас атомов чрезвычайно велико. Алмаз является гигантской молекулой, если бы к молекулам не предъявлялось требование иметь постоянный состав.
Рис. 4.7. Структурная формула алмаза (а) и строение его атомного кристалла (б) [13]
Уалмаза каждый атом углерода находится в центре правильного тетраэдра, в вершинах которого – другие углеродные атомы. связанные с ним ковалентными связями (рис. 4.7).
Уграфита атомы углерода связаны по-иному (рис. 4.8). Они объединены в слои, состоящие из плоских шестиугольников. Расстояние между отдельными слоями в графите довольно велико, а силы взаимодействия между ними довольно слабы (в основном это слабые межмолекулярные связи, показанные вертикальными пунктирными линиями), поэтому гра-
49

фит может расщепляться на тонкие чешуйки. При легком нажатии чешуйки легко прилипают к бумаге – вот почему из графита делают грифели карандашей. Графит и алмаз очень несхожи по своим свойствам, хотя состоят из одного и того же элемента – углерода.
Внутри слоев атомы углерода связаны друг с другом прочными ковалентными связями, а между слоями действуют гораздо более слабые силы межмолекулярного взаимодействия.
Графит и алмаз построены из атомов углерода, но благодаря разным структурам обладают разными свойствами.
Рис. 4.8. Структурная формула участка одного углеродного слоя графита (а) и пространственное расположение атомов в кристаллической решетке графита (б) [13]
Графит обладает слабой прочностью, его легко превратить в порошок. Алмаз настолько тверд, что оставляет царапины на большинстве материалов.
Если химический элемент образует два или больше простых веществ то, такое явление называется аллотропией. Гра-
50
