
Учебники 80359
.pdfфит и алмаз – две аллотропные модификации углерода. Аллотропные модификации могут переходить друг в друга. Например, при очень высоких давлениях и температурах графит может переходить в алмаз.
Такие искусственные алмазы мелкие и черного цвета, поэтому не пригодны для ювелирных изделий, и применяются только в промышленности.
Иногда твердые вещества обладают комбинацией свойств кристаллов разного типа. Это связано с тем, что между металлами и неметаллами нет строго очерченной границы. Например, атомный кристалл кремния (Si) частично проявляет свойства металлического кристалла (является полупроводником). Проводят электрический ток и кристаллы графита (но не алмаза). Металлические кристаллы s- и p-элементов часто мягкие и легкоплавкие, однако у многих металлов – d- элементов (титан, железо, медь, вольфрам и т.д.) связь внутри металлического кристалла дополняется ковалентным перекрыванием между частично заполненными d-орбиталями. Это придает таким металлам в твердом состоянии замечательные свойства атомных кристаллов – твердость и тугоплавкость.
Например, титан Ti (...4s23d2) – чрезвычайно прочный металл, плавится при 1668оС; железо Fe (...4s23d6) плавится при 1539оС; вольфрам W (...6s25d4) используют при создании сверхпрочных и жаростойких сплавов, его температура плавления 3420оС. Но если d-оболочки полностью заполнены (здесь есть некоторая аналогия с благородными элементами), то атомы металлов проявляют гораздо меньшую склонность к связыванию. Например, цинк Zn (...4s23d10) и кадмий Cd (...5s24d10) – непрочные и легкоплавкие, а ртуть Hg (...6s25d10) при комнатной температуре – жидкий металл, притом легко испаряющийся (пары ртути состоят из отдельных атомов рту-
ти) [13].
51
5.СИММЕТРИЯ
Воснове кристаллографии лежит понятие симметрии. По отношению к кристаллографической симметрии так же различают макроскопический и атомистический подходы. С макроскопической точки зрения симметрия кристалла – это симметрия его наблюдаемых свойств, с атомистической – это симметрия в расположении его атомов. Но все наблюдаемые свойства в конечном счёте определяются свойствами его атомов, то оба подхода должны быть согласованы.
Наиболее очевидным свойством кристалла является его форма. Если росту кристалла ничто не препятствует, то его форма характеризует и вещество кристалла, и тип упорядочения молекул этого вещества. Поэтому все свободно растущие при одинаковых условиях кристаллы одного и того же вещества имеют одинаковую форму многогранника (полиэдра). Следовательно, эта форма может нести информацию и о свойствах самого вещества. Еще задолго до дифракционных методов анализа кристаллографы изучали формы твёрдых тел и их симметрию с целью получить информацию об их свойствах.
Многогранник ограничен конечным числом плоских граней, пересекающихся вдоль прямых рёбер, которые пересекаются в вершинах (точках).
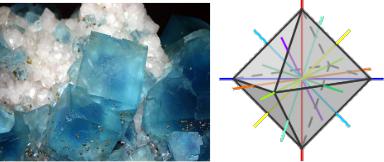
Например кристаллы флюорита имеют форму правильного восьмигранника (октаэдра) (рис. 5.1).
Не вызывает сомнений, что октаэдр симметричен потому, что с различных направлений он выглядит одинаково.
Самый простой способ доказать эту симметрию можно с помощью вращения октаэдра относительно вертикальной оси,
проходящей через противоположные вершины. При повороте на 900 октаэдр попадает в то же положение, что и вначале. За один полный оборот октаэдр 4 раза совпадает с начальным положением. Вертикальная ось вращения называется осью симметрии четвёртого порядка. Октаэдр имеет шесть вер-
шин и, следовательно, три оси четвёртого порядка.
52
а |
б |
Рис. 5.1 Фотография флюорита (а) и элементы его симметрии (б) [14]
Через центры каждой из шести пар противолежащих рё-
бер проходит ось симметрии второго порядка. Положения октаэдра через пол-оборота вокруг любой из шести осей второго порядка ничем не отличаются друг от друга. Аналогичным образом в октаэдре можно найти четыре оси третьего порядка: каждая проходит через центры пары противоположных граней. Отсюда начинается точное описание симметрии любого предмета. Для полного определения симметрии следует применить ещё некоторые операции.
Следующая операция – это отражение. Представьте плоскость, рассекающую предмет пополам при этом каждая половина выглядит как зеркальное отражение другой. Такая плоскость является плоскостью зеркального отражения. Ок-
таэдр, изображённый на рис. Обладает девятью плоскостями зеркальной симметрии: три проходят через вершины октаэдра, шесть – через две противоположные вершины и центры двух противолежащих рёбер.
Ещё одной операцией симметрии является инверсия относительно центра фигуры. При этой операции каждая точка предмета перемещается по прямой проходящей через
53

центр фигуры и удаляется на то же расстояние с другой стороны центра (рис. 5.2).
Помимо этого, существуют комбинированные элементы симметрии, например, поворот и сдвиг и т.д., которые мы не будем рассматривать.
Рис. 5.2. Пример фигуры, обладающей только центром симметрии
При атомистическом подходе можно дать следующее определение кристалла. Кристаллом называется твёрдое тело у которого атомы его составляющие расположены в строгой периодичности в любом направлении. На рис. 5.3
изображен двухмерный кристалл.
Рис. 5.3. Схема двухмерного кристалла
54
Видно, что в кристалле атомы для каждого направления расположены друг от друга на одном и том же расстоянии. Повторяющийся характер упорядочения в кристалле определяет основной тип операции симметрии для расположения атомов – трансляцию. Расположение атомов в кристалле можно целиком, не подвергая вращениям или отражениям, переместить в любое из бесконечного числа положений. Новое положение будет физически неотличимо от исходного. В этом случае вводится термин дальний порядок. Подобно многогранникам, расположения атомов также могут иметь все вышеуказанные элементы симметрии.
Если трансляция атомов в пространстве не выполняется, вещество имеет не кристаллическое, а аморфное строение. При этом атомы могут располагаться в пространстве упорядоченно, но этот порядок сохраняется лишь в очень малых объ-
ёмах вещества (ближний порядок).
55

6. КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ
Как было сказано выше кристаллическая структура характеризуется правильным (регулярным) расположением частиц в строго определенных местах в кристалле. Для анализа кристаллических структур вводится понятие кристаллической решетки. Она состоит из воображаемых прямых линий и плоскостей, проходящих через точки расположения частиц (атомов, ионов или молекул) в пространстве (рис. 6.1).
Рис. 6.1. Схема кристаллической решётки [8]
Для двухмерной решётки элементарная ячейка представляет собой параллелограмм, в трехмерном пространстве решётка представляется параллелепипедом. Последовательным перемещением наименьшего параллелепипеда (выделен жирными линиями) вдоль трех своих осей может быть построен весь кристалл. Весь кристалл можно построить, складывая друг с другом элементарные ячейки. Таким образом выделенная элементарная ячейка – это наименьший объем кристалла, дающий представление об атомной структуре металла. В качестве геометрических характеристик кристалла выделяют следующие величины: три ребра (a, b и c) и три угла между ними α, β и γ. Точки, в которых размещены частицы, называются узлами кристаллической решетки. в которых могут находиться ионы, атомы или молекулы.
56

В кристаллографии определены 14 типов неповторяющихся элементарных ячеек (рис. 6.2), из которых можно построить бесконечное множество кристаллических структур, как из семи нот можно создать бесконечное множество мелодий.
Рис. 6.2. Основные типы элементарных ячеек кристаллических решёток
57

У каждого узла решетки существует только определенное число соседних. Это число ближайших соседних частиц называется координационным числом. Например, в металлическом кристалле натрия (рис. 6.3.) каждый ион натрия окружен восемью ближайшими соседями
– на рисунке это особенно хорошо видно по атому, который помещен в центр куба. Но в металле все атомы натрия равноценны и имеют одинаковое окружение. Таким образом, координационное число натрия в металлическом кристалле равно 8.
Рис. 6.3. Строение кристалла металлического натрия [13]
В кристалле CsCl аналогичное координационное число у ионов цезия и хлора. Кристалл CsCl построен путем вложения друг в друга кубиков двух разных сортов. Следовательно, у кубика с вершинами из ионов цезия в центре окажется ион хлора (как на рис. 6.4). А для кубика из 8 ионов в центре которого окажется ион цезия.
Кристаллические решетки изображаются, чтобы обозначить только взаимное расположение частиц, но не их размеры. Если продолжить рисовать кристаллическую решетку CsCl, то окажется, что она состоит из повторяющихся элементарных ячеек.
58

Для изображения элементарной ячейки, надо выбрать любую частицу и расположить вокруг нее только ближайших соседних частицы в соответствии с координационным числом.
Рис. 6.4. Строение кристалла хлористого цезия CsCl. Координационное число 8 по цезию и по хлору [13]
Возвращаясь к элементарной ячейке кристалла CsCl (рис. 6.5.) видно, что в соединении на один атом хлора приходится 8 атомов цезия (или наоборот, если нарисовать ячейку с атомом цезия в середине).
Для кристалла NaCl, где координационное число 6 как для катиона, так и для аниона, элементарная ячейка будет выглядеть иначе (рис. 6.5).
Рис. 6.5. Элементарная ячейка кристалла NaCl. Координационное число 6 по натрию и по хлору [13]
59
Каждой элементарной ячейке соответствует свой способ
плотной упаковки.
Элементарной ячейке NaCl соответствует гранецентрированная кубическая упаковка (ГЦК), а рассмотренной выше ячейке кристалла CsCl – объемноцентрированная кубическая упаковка (ОЦК). Способ упаковки виден из названия: для ГЦК есть атом в центре каждой грани куба, а для ОЦК – атом в центре куба.
Возможны и другие способы плотной упаковки. Интересно, что виды плотных упаковок и элементарных ячеек универсальны, то есть могут встречаться в любых кристаллах – ионных, молекулярных и т.д. Способ плотной упаковки определяет форму кристалла. Прочностные, тепловые и другие физические свойства зависят от атомов и молекул, которые составляют кристалл и типа связи между ними.
Чтобы напрямую увидеть настоящую форму кристалла, он должен быть монокристаллом – то есть одним кристаллом во всем объеме. Большинство кристаллов, с которыми мы сталкиваемся в быту, например поваренная соль – это поликристаллы, то есть система множества сросшихся мелких кристаллов. По внешнему виду их трудно отличить от обычного порошка какого-нибудь не кристаллического (аморфного) соединения. В природе монокристаллы встречаются горных минералах, например, горный хрусталь, потому что было достаточно много времени для их выращивания буквально по "частичке" из расплавов или растворов глубоко в недрах Земли там, где температура, давление и другие внешние условия менялись очень медленно.
60
