- •А.А. Лукин з.С. Лукина
- •Введение
- •1. Сплошной спектр рентгеновских лучей
- •2. Характеристический спектр рентгеновских лучей
- •3. Поглощение рентгеновских лучей
- •4. Ослабление первичного рентгеновского излучения
- •5. Рассеивание рентгеновских лучей кристаллической решеткой (монокристаллом)
- •6. Интерференция в поликристаллических веществах
- •7. Основные методы исследования структуры
- •7.1. Метод неподвижного монокристалла (метод Лауэ)
- •7.2. Метод вращающегося монокристалла
- •7.3. Метод порошка
- •8. Дифрактометрия
- •8.1. Рентгеновские дифрактометры
- •8.2. Юстировка дифрактометра
- •8.3. Приставки к дифрактометру для высокотемпературных (гпвт-1500) и низкотемпературных (урнт-180) исследований
- •9. Текстура. Полюсные фигуры
- •9.1. Понятия текстуры
- •9.2. Разновидности текстур
- •9.2.1. Систематизация по Вайссенбергу
- •9.2.2. Волокнистые (аксиальные) текстуры
- •9.2.3. Простые аксиальные текстуры
- •9.2.4. Спиральная и кольцевая аксиальные структуры
- •9.3. Стереографическая проекция
- •10. Методы исследования и классификация текстур
- •10.1. Основные положения, используемые для описания текстурообразования при деформации
- •10.2. Текстуры протяжки
- •10.3. Текстуры прокатки
- •10.3.1. Текстуры прокатки металлов с о. Ц. К. Решеткой
- •10.3.2. Рассеяние текстуры прокатки металлов с о. Ц. К. Решеткой
- •10.3.3. Текстуры прокатки металлов с г. Ц. К. Решеткой
- •10.3.4. Рассеяние текстуры прокатки металлов с г. Ц. К. Решеткой
- •11. Методы съемки текстур
- •11.1. Рентгеновский метод
- •11.2. Фотографический метод
- •11.3. Метод съемки на просвет
- •11.4. Построение полюсных фигур по рентгенограммам
- •11.5. Приготовление образцов
- •Контрольные вопросы
- •Заключение
- •Библиографический список
- •Оглавление
- •8.1. Рентгеновские дифрактометры………………..……71
- •394026 Воронеж, Московский просп., 14
2. Характеристический спектр рентгеновских лучей
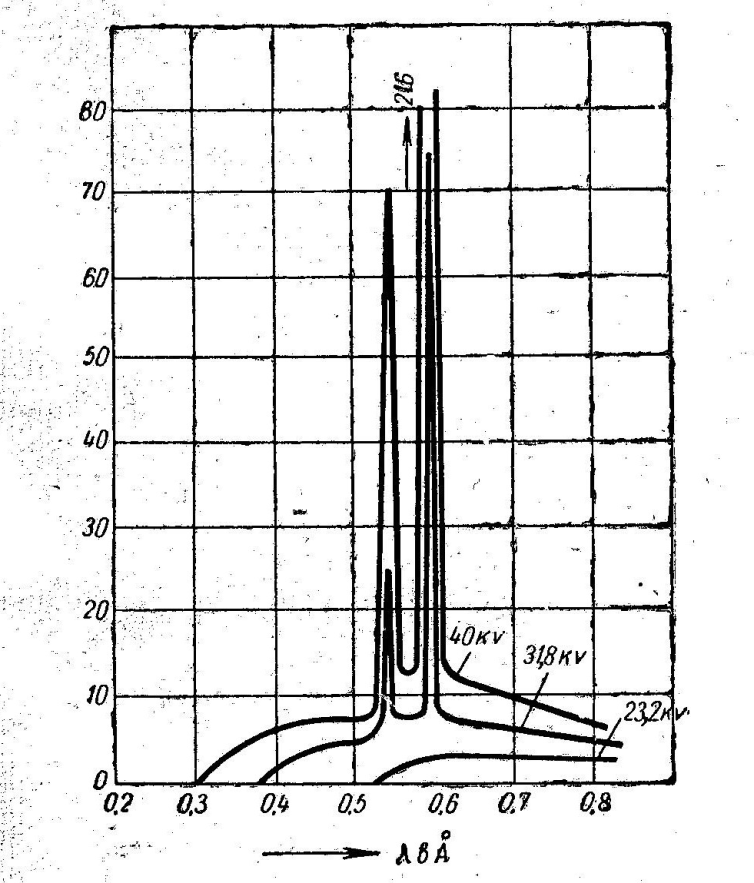
При некоторых условиях возбуждения рентгеновских лучей характер спектра может резко изменяться. На рис. 2 изображены три кривые спектра, полученные от рентгеновской трубки с родиевым анодом при различных напряжениях. По этим кривым можно судить, что при напряжениях на трубке ниже 23,2 кв получается только сплошной спектр. При более высоком напряжении (31,8 кв) на фоне сплошного спектра появляются резко выраженные пики интенсивности, Дальнейшее повышение напряжения, увеличивая интенсивность сплошного спектра и смещая его в сторону коротких волн, не изменяет положения пиков интенсивности, а лишь увеличивает их высоту, т. е. интенсивность.
|
Рис. 2. Кривые распределения интенсивности по длинам волн для трубки с родиевым анодом при различных напряжениях |
Волны, соответствующие по длине пикам интенсивности, зависят от материала анода и называются характеристическими спектрами рентгеновских лучей.
Можно отметить ряд закономерностей, наблюдаемых при исследовании характеристических спектров:
1) характеристические спектры рентгеновских лучей состоят из нескольких групп, или серий, линий,, отличающихся друг от друга по длине волны; для тяжелых элементов найдено пять таких серий линий, они обозначаются буквами К, L, М, N, О;
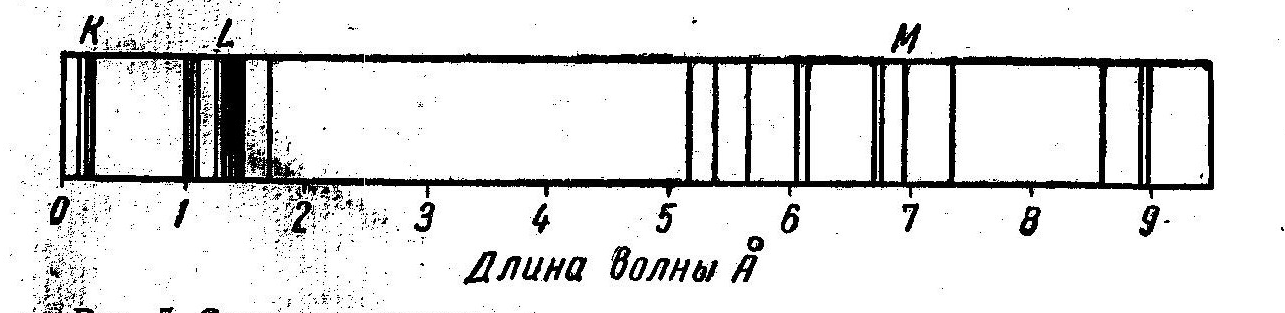
2) К-серия образована из волн, наиболее коротких по длине, L-серия — из волн более длинных и т. д.; на риc. 3 представлены три серии характеристического спектра вольфрама;
|
Рис.3. Схема расположения различных по длине волн характеристического излучения для вольфрама |
3) характеристические спектры лучей различных элементов одинаковы по числу и взаимному расположению линий, отличаются они друг от друга только длинами волн; это показано на графике, приведенном на рис. 4. По оси ординат отложены порядковые номера Z элементов, а по оси абсцисс — длины волн характеристического излучения К- и L-серий.
|
Рис. 4. Изменение длины волны характеристического спектра от порядкового номера элемента |
Если по оси ординат откладывать величину 1/λ= K в функции атомного номера, то получается чрезвычайно простая (прямолинейная) зависимость характеристических спектров рентгеновских лучей от положения элемента в таблице Менделеева.
Возникновение характеристических рентгеновских лучей вначале объяснялось квантовой теорией строения атома Бора: По этой теории атом представляет собой Сложную систему, в которой.вокруг положительного ядра вращаются Z электронов. Бор высказал два постулата.
Первый постулат Бора состоит в том, что электрон без изменения своей энергии может вращаться только по орбитам, удовлетворяющим определенным условиям. Эти орбиты называются стационарными; они обязательно должны отвечать следующему условию:
mVr =n h / 2π,
т. е. момент количества движения электрона является целым кратным величине h / 2π ;здесь т, V — соответственно масса и скорость электрона при движении по орбите радиусом r; h — постоянная Планка, а n — целое число (1, 2, 3 и т. д.).
В этом случае полная энергия электрона для водоро- доподобного атома (т. е. состоящего из ядра и одного внешйего электрона) в различных стационарных состояниях будет
E= - (2 π 2me4/h2)·• (z2/n2) (4)
Пользуясь формулой (4), можно схематически представить уровни стационарных орбит (а значит, и уровни энергии электрона), как это указано на рис. 5. При n = 1 получаем орбиту с наименьшей энергией, а по мере возрастания п (п = 2, 3, 4, и т. д.) энергия увеличивается.
|
Рис. 5. Схема возбуждения характеристического излучения |
Второй постулат Бора состоит в том, что если электрон переходит с более высокой орбиты (n2) на более низкую (n1) энергия атома уменьшается и переходит в один квант света hv, т. е. образуется один фотон:
E2-E1=2π2me4/h2•z2(1/n22-1/n21) = hv (5)
Предположим, что с первой орбиты (n1 = 1) электрон удален за пределы атома. Тогда атом окажется на более удаленных от ядра орбитах, будут стремиться перейти в состояние с меньшей энергией, поэтому начнутся перескоки электронов с более удаленных орбит на орбиту, с которой удален электрон. Когда мы имеем дело с большим числом атомов, то у одних перескок может произойти с L-орбиты на К, у других — с М на К, у третьих — с N на К и т. д. Таким образом, одновременно будут излучаться несколько волн различной длины (спектральная серия):
L → К — λ α
М → К — λ β1
N → К — λ β2
Если перескоки электронов заканчиваются на К-орбите, то возникает К-серия; если на L-орбите, то L – серия и т. д.
Исходя из схемы энергетических уровней (рис. 6), можно легко объяснить все закономерности спектров, которые были найдены экспериментально.
|
Рис. 6. Схема разности энергетических уровней |
1. Лучи каждой серии возникают тогда, когда напряжение на трубке становится критическим. Действительно, чтобы возможны были перескоки электронов с наиболее удаленных от ядра уровней, необходимо удалить электрон с одного из ближайших к ядру уровней, например с K-уровня, но для этого необходимо затратить энергию извне. Если в качестве такой энергии используется энергия быстролетящих электронов, которые возбуждают атомы анода; то быстролетящие электроны должны обладать вполне определенной энергией, равной eUкр. Напряжение Uкр называется, потенциалом возбуждения. Потенциал возбуждения может быть вычислен по формуле (2), где λ β2 — самая короткая волна данной серии.
Возбуждается одновременно громадное количество атомов, а так как освободившиеся места у различных атомов заполняются из различных вышележащих слоев и -подгрупп, то одновременно появляются все линии К-серии (α1, α2, β1 и т. д.).
Для появления линий L-серии необходимо удалить электрон с L-уровня, но для этого энергии потребуется гораздо меньше. Поэтому потенциал возбуждения для K-серии значительно больше, чем для L-серии.
2. К-серия образована из волн, наиболее коротких по длине. На схеме (рис. 6), как. уже указывалось, расстояния между отдельными уровнями характеризуют в некотором масштабе величину выделяющейся энергии. Для К-серии разность уровней значительно больше, чем для других серий, поэтому образующиеся кванты имеют большую частоту, а следовательно, меньшую длину волны.
Внутри данной серии волны также различаются по длине. Главные линии К-серии определяются следующими переходами:
L II → K — hvα2,
L II →К — h vα1,
MIII → К — h vβ1,
N III → К —h vβ2,
следовательно, vα2< vα1 < vβ1, < vβ или λ α2 > λ α1 > λβ1 > λβ2 причем; как видно из схемы, и Ха, мало отличаются по величине: друг от друга.
3. Спектр характеристических рентгеновских лучей состоит из нескольких серий. Действительно, при удалении электрона К-уровня появятся линии К-серии, но при этом будут освобождаться места и в L- и в М-уровнях, а следовательно, появятся линии и этих серий.
4. Спектры характеристических лучей различных элементов отличаются друг от друга длинами волн. Разность энергии каких-либо двух уровней (например, К и L) в разных атомах зависит от заряда ядра — чем больше заряд ядра (равный атомному номеру Z), тем сильнее, электрическое поле вокруг ядра. Следовательно, при переходе от атома с порядковым номером Z1 к атому с большим порядковым номером Z2, согласно формуле (4), имеем
Е(Z2) / Е(Z1) = Z22/ Z12
У атома с порядковым номером Z2 ступени энергии увеличиваются, а поэтому все серии излучают кванты с большей энергией; следовательно, характеристическое излучение будет состоять из волн, более коротких по длине.
Приведенная выше схема расположения энергетических уровней дает возможность объяснить, по крайней мере качественно, не только характер спектра, но и относительную интенсивность отдельных спектральных линий. Очевидно, интенсивность спектральных линий будет определяться вероятностью самопроизвольных переходов электронов между соответствующими уровнями. При возбуждении К-уровня наиболее вероятно, что чаще будут совершаться перескоки с L-уровня, так как он ближе всего находится к K-уровню, реже с М-уровня и еще реже с N-уровня. Следовательно, нужно ожидать, что интенсивность отдельных линий K-серии будет Iα >Iβ1,> Iβ2.
Так как характеристические рентгеновские лучи возникают вследствие процессов, происходящих в слоях, ближайших к ядру, а эти слои у всех атомов (более или менее тяжелых с Z ≥ 20) имеют одинаковое строение, спектры рентгеновских лучей у всех атомов одинаковы и различаются лишь по длине волн. Относительная интенсивность отдельных линий, очевидно, также должна сохраняться. Действительно, опыт показывает, что для главных линий K-серии соотношение их интенсивностей устойчиво сохраняется для всех атомов и равно примерно
Iα1/Iα2/Iβ1/Iβ2=100:50:23:1.
Линия λβ2имеет очень малую интенсивность и колеблется в зависимости от атомного номера в пределах 0,5—4.
Соотношение интенсивностей основных линий L-серии (например, вольфрама) равно
Iα1: Iα2 : Iβ1 :Iβ2: Iγ1: I β3 : Iβ4 :Iβ5:Iγ2 =
100: 12,5 :52: 20:9 : 8,2:5,2: 1: 1,5 .
Эта серия гораздо богаче линиями, но другие линии, кроме указанных, имеют меньшую интенсивность и поэтому здесь не приводятся.
Абсолютная интенсивность линий данной серии выражается с достаточной для практических целей точностью формулой
I = ki(U-UKp)n (6)
где U — напряжение (в кв), приложенное к рентгеновской трубке;
UKp — минимальное напряжение, необходимое для возбуждения данной серии;
k и п — константы (п = l,6÷ 2 для K-серии).