
- •Часть II рабочая тетрадь
- •Введение
- •1.1. Строение атома и периодическая система
- •1. 2. Химическая связь
- •2.1. Основы химической термодинамики
- •2.2. Химическая кинетика
- •Зависимость скорости реакции от температуры
- •2.3. Химическое равновесие
- •И стехиометрические расчёты
- •Характерные реакции оснóвных оксидов
- •4.1. Общие свойства растворов
- •4.2. Равновесия в растворах электролитов
- •Ионно-молекулярные реакции в растворах электролитов
- •Методы определения рН растворов
- •Гидролиз солей
- •5.1. Окислительно-восстановительные процессы
- •5.3. Электролиз
- •5.4. Коррозия металлов
- •Защитные покрытия
- •Электрохимические методы
- •6.1. Качественный химический анализ
- •6.2. Количественный химический анализ
- •6.3. Физико-химические и физические методы анализа
- •7.1. Общие сведения и методы получения полимеров
- •7.3. Природные полимеры
- •Библиографический список
- •Заключение
2.2. Химическая кинетика
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить;
· лекцию «Химическая кинетика» [Конспект лекций, раздел 2.2];
· видеозапись лабораторной работы «Химическая кинетика. Скорость химических реакций» [Приложение к УМК: диск 1, работа 1].
Цель выполнения задания
· Усвоить основные положения химической кинетики.
· Изучить факторы, влияющие на скорость химических реакций.
Теоретические сведения
Химическая кинетика изучает механизмы химических реакций и факторы, влияющие на скорость химических процессов.
Под скоростью химической реакции понимают число элементарных взаимодействий в единицу времени. Химические реакции подразделяются на элементарные (одностадийные) и сложные. Уравнение химической реакции раскрывает механизм только одностадийной реакции. Большинство реакций являются сложными и представляют суммарный результат нескольких элементарных процессов, в этом случае уравнение реакции не отражает их реальный механизм. в формальной кинетике в целях упрощения принимается, что реакции являются элементарными и их уравнения отражают механизм реакции.
Скорость реакции определяется, прежде всего, природой реагирующих веществ и может быть изменена под влиянием следующих основных факторов:
∙ температуры;
∙ концентрации реагирующих веществ;
∙ давления (если в реакции участвуют газы);
∙ присутствия катализатора;
∙ для гетерогенных процессов ─ величиной поверхности раздела фаз.
Влияние концентрации реагирующих веществ на скорость условно одностадийной химической реакции выражается законом действующих масс:
При постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для реакции а А + b B → e E + d D кинетическое уравнение имеет вид:
υ = k ∙ (сА)а ∙ (сB)b , (2.4)
где k ─ константа скорости реакции;
с А, с B ─ концентрации реагирующих веществ А и В;
a, b ─ коэффициенты в уравнении реакции соответственно.
С повышением температуры скорость химических реакций увеличивается.
По правилу Вант-Гоффа, установленному экспериментально, при изменении температуры на каждые 10 градусов скорость химической реакции изменяется в (2-4) раза
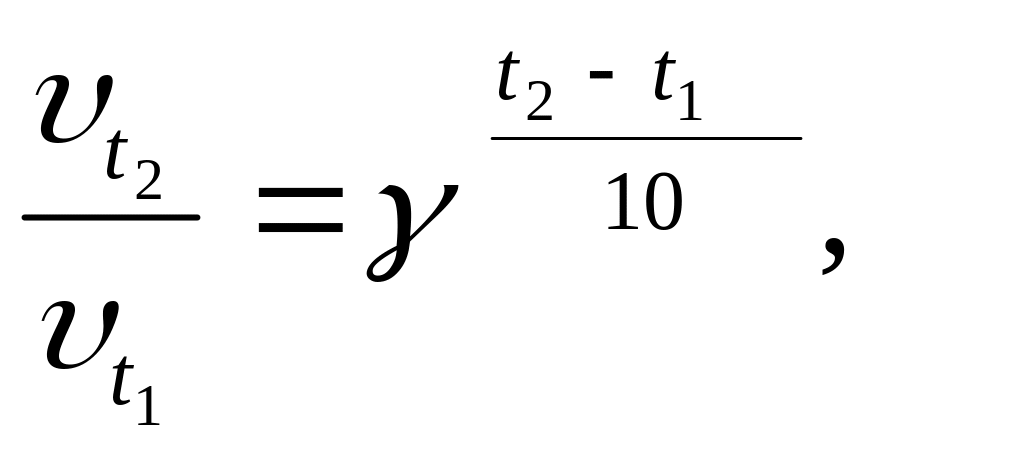 (2.5)
(2.5)
где υ t1 и υ t2 – скорость реакции при температурах t1 и t2 ;
γ – температурный коэффициент скорости реакции, показывающий во сколько раз изменяется скорость реакции, при изменении температуры на каждые 10 0.
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Влияние концентрации реагирующих веществ на скорость химической реакции
Схема проведения эксперимента и полученные результаты представлены на рис. 2.1.


Взаимодействие тиосульфата натрия (Na2S2O3) с серной кислотой
Na2S2O3 + H2SO4 = Na2SO4 + H2SO3 + S↓
сопровождается образованием осадка серы коллоидной степени дисперсности, что вызывает опалесценцию и дальнейшее помутнение раствора. По данному признаку можно судить о скорости химической реакции.
В три пробирки из бюретки наливается соответственно 1, 2, 3 мл раствора тиосульфата натрия, затем в первую пробирку добавляется 2 мл дистиллированной воды, во вторую – 1 мл, в третью ─ вода не добавляется. Таким образом, имеются три раствора с увеличивающейся концентрацией Na2S2O3.
Заметив время, в первую пробирку приливается 1 мл раствора серной кислоты, содержимое перемешивается и при наблюдении на темном фоне в проходящем свете отмечается время помутнения раствора. Число секунд, прошедшее от момента приливания кислоты (начало реакции) до помутнения указано на рис. 2.1. Аналогично выполняется опыт со второй и третьей пробирками.
Внесите в табл. 2.1 время помутнения раствора и рассчитаете относительную скорость реакции с точностью до третьего знака, разделив единицу на время помутнения.
Таблица 2.1
Зависимость скорости реакции от концентрации тиосульфата натрия
Номер пробирки |
Объем раствора, мл |
Время помутнения, τ, с |
Относительная скорость реакции, υ = 1: τ, с‾ 1 |
||
Na2S2O3 |
H2O |
H2SO4 |
|||
1 |
1 |
2 |
1 |
|
|
2 |
2 |
1 |
1 |
|
|
3 |
3 |
− |
1 |
|
|
Представьте результаты эксперимента в виде графика (рис. 2.2), отложив по оси абсцисс объём раствора тиосульфата натрия (концентрация), а по оси ординат – относительную скорость реакции.
Рис. 2.2. Зависимость скорости реакции от концентрации тиосульфата натрия
Запишите кинетическое уравнение реакции взаимодействия тиосульфата натрия с серной кислотой. ________________________________________________________________
Сделайте вывод о влиянии концентрации Na2S2O3 на скорость химической реакции.
________________________________________________________________________________________________________________________________________________________________
Пример 2.4. Как изменится скорость реакции образования аммиака
N2 (газ) + 3 H2(газ) → 2 NH3 (газ),
если первоначальную концентрацию водорода увеличить в три раза?
Решение. Запишем кинетическое уравнение реакции
υ = k с (N2) · (с (Н2) )3.
При увеличении концентрации водорода в три раза кинетическое уравнение примет вид:
υ/ = k с (N2) · (3с (Н2) )3.
Отношение «υ/» к «υ» показывает во сколько раз увеличится скорость реакции:
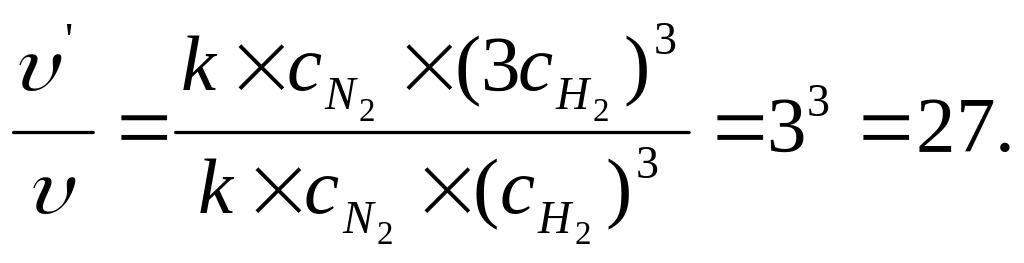
Ответ: скорость увеличится в 27 раз.
Упражнение 2.8. Как изменится скорость сгорания метана
СН4 (г) + 2 О2 (г) → СО2 (г) + 2 Н2О (г),
если парциальные давления исходных веществ увеличить в два раза?
Кинетическое уравнение реакций с участием газообразных веществ может быть выражено не через концентрации, а через парциальные давления (р):
υ = k ∙р (СН4)∙ р2 (O2) .
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 2.5. Для увеличения скорости обратной реакции
4 HCl (газ) + O2 (газ) <==> 2 H2O (пар) + 2 Cl2 (газ)
в 16 раз парциальные давления продуктов реакции следует увеличить в ____ раз
1)16 2) 8 3) 4 4) 2
Запишем кинетическое уравнение обратного процесса
![]() .
.
Обозначим через «х» величину изменения парциального давления и запишем изменённое кинетическое уравнение
![]()
Отношение «υ/» к «υ» показывает во сколько раз увеличится скорость реакции:
υ/обратной реакции : υобратной реакции = х4.
По условию задачи эта величина равна 16-и, следовательно, х4 = 16 и х = 2.
Правильный ответ: 2.
Упражнение 2.9. Для увеличения скорости прямой реакции
2 NO (газ) + O2 (газ) ↔ 2 NO2 (газ) в 1000 раз необходимо увеличить давление в ____ раз.
1) 330 2) 200 3) 500 4) 10
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Влияние температуры на скорость химической реакции
Зависимость скорости реакции от температуры изучается также на примере взаимодействия тиосульфата натрия с серной кислотой. Объёмы растворов берутся такими же, как в первой пробирке предыдущего опыта.
Вначале выполняется опыт при комнатной температуре (Т1), а затем при температуре на 20 0С выше (Т2), для чего пробирки с исходными растворами предварительно выдерживаются в водяной бане при температуре Т2 в течение 5–7 минут. Схема проведения эксперимента и полученные результаты представлены на рис. 2.3.
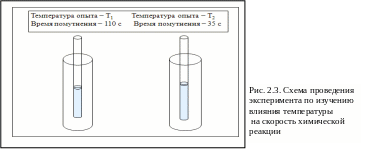
Внесите в табл. 2.2 экспериментальные данные: температуру, при которой проводились опыты, время помутнения раствора.
Таблица 2.2
