
- •Часть II рабочая тетрадь
- •Введение
- •1.1. Строение атома и периодическая система
- •1. 2. Химическая связь
- •2.1. Основы химической термодинамики
- •2.2. Химическая кинетика
- •Зависимость скорости реакции от температуры
- •2.3. Химическое равновесие
- •И стехиометрические расчёты
- •Характерные реакции оснóвных оксидов
- •4.1. Общие свойства растворов
- •4.2. Равновесия в растворах электролитов
- •Ионно-молекулярные реакции в растворах электролитов
- •Методы определения рН растворов
- •Гидролиз солей
- •5.1. Окислительно-восстановительные процессы
- •5.3. Электролиз
- •5.4. Коррозия металлов
- •Защитные покрытия
- •Электрохимические методы
- •6.1. Качественный химический анализ
- •6.2. Количественный химический анализ
- •6.3. Физико-химические и физические методы анализа
- •7.1. Общие сведения и методы получения полимеров
- •7.3. Природные полимеры
- •Библиографический список
- •Заключение
6.1. Качественный химический анализ
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить:
лекцию «Качественный химический анализ» [Конспект лекций, раздел 6.1]
Цель выполнения задания
∙ Усвоить суть и задачи идентификации состава строительных материалов.
∙ Ознакомиться с качественными реакциями обнаружения катионов и анионов.
Теоретическое введение
Под идентификацией понимают установление тождества неизвестного соединения с другим известным, т.е. определение качественного (что) и количественного (сколько) состава исследуемого объекта.
Основанием для проведения исследования является наличие аналитического сигнала, т.е. свойства, функционально зависящего от качественного и количественного состава анализируемого объекта. В качественном анализе фиксируется наличие аналитического сигнала, а в количественном ─ измеряется его интенсивность.
Методы качественного анализа базируются на ионных реакциях, которые позволяют идентифицировать элементы в форме тех или иных ионов. В ходе реакций образуются труднорастворимые соединения, окрашенные комплексные соединения, происходит окисление или восстановление с изменением цвета раствора (рис. 6.1). Эти явления называются аналитическими сигналами.
Если присутствуют несколько катионов, то любой катион можно идентифицировать с помощью определенной (специфической) реакции, если удалить другие катионы, мешающие этой идентификации.
Некоторые качественные реакции приведены в табл. 6.1.
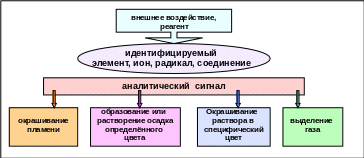
Рис. 6.1. Виды аналитических сигналов в качественном химическом анализе
Таблица 6.1
Качественные химические реакции обнаружения некоторых катионов и анионов
Ион, вещество |
Реактив |
Реакция |
Наблюдаемое явление |
Fe2+ |
K3[Fe(CN) 6] красная кровяная соль |
3Fe2+ + 2K3[Fe(CN) 6] → Fe3[Fe(CN) 6]2 + 6K+
|
Синее окрашивание |
Fe3+ |
K4[Fe(CN) 6] жёлтая кровяная соль |
2Fe2+ + 3K2[Fe(CN) 6] → Fe2[Fe(CN) 6]3 + 6K+
|
Синее окрашивание |
Fe3+ |
NH4CNS роданид аммония |
Fe3+ + 3 NH4CNS → Fe(CNS)3 + 3NH4+
|
Красное окрашивание |
Са2+ |
(NH4)2С2О4 оксалат аммония |
Са2+ + (NH4)2С2О4 → CaC2O4↓ + 2NH4+ |
Белый осадок |
Bа2+ |
Н2SO4 |
Bа2+ + Na2SO4 → BaSO4↓ + 2Н+ |
Белый осадок |
Cu2+ |
NH4OH |
Cu2+ + 4NH4OH → [Cu(NH3)4]2+ + 4H2O |
Ярко-синее окрашивание |
Pb2+ |
KJ |
Pb2+ + 2KJ → PbJ2↓ + 2K+ |
Жёлтый осадок |
Ca2+, Sr2+,Ba2+ |
H2S |
Ca2+(Sr2+, Ba2+) + H2S → Ca(Sr,Ba)S↓ + 2H+ |
Осадок |
NH4+ |
NaOH |
t NH4+ + NaOH → NH3↑ + H2O + Na+ |
Выделение аммиака |
Cr3+→Cr6+ |
Щелочная среда |
Cr3+→ CrO42ˉ |
От зелёной к жёлтой окраске |
СО32ˉ |
HCl |
СО32ˉ + 2H+ → H2O + CO2↑ |
Выделение газа |
SO42ˉ |
BaCl2 |
SO42ˉ + BaCl2→ BaSO4↓ + 2Clˉ |
Белый осадок |
NO3ˉ |
Дифениламин |
[O] (С6Н5)2−NH —→ (C6H4)2−NH + H2O |
Синее окрашивание |
РО43ˉ |
Магнезиальная смесь |
РО43ˉ + Mg2+ + NH4+ → Mg NH4РО4↓ |
Белый осадок |
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Рисунок 6.2 даёт наглядное представление о некоторых качественных реакциях.

Рис. 6.2. Вид качественных реакций на некоторые ионы
Изучите примеры, а в упражнениях, на основании табл. 6.1, укажите правильные ответы или напишите соответствующие реакции.
Пример 6.1. Для обнаружения в растворе катионов кальция используют …
1) нитрат аммония 2) сульфид аммония 3) оксалат аммония 4) хлорид аммония
Решение. Для обнаружения в растворе катионов кальция используют оксалат аммония
CaCl2 + (NH4)2C2O4 → СаС2O4↓ + 2NH4C1,
Ca2+ + С2O42‾ → СаС2O4↓
Правильный ответ: 3.
Упражнение 6.1. Наиболее селективным реагентом для обнаружения катионов аммония является … 1) раствор щелочи 2) раствор кислоты 3) раствор CuSO4 4) раствор KMnO4
Упражнение 6.2. Присутствие нитрат-ионов в растворе можно доказать, используя в качестве реактива … 1) магнезиальную смесь 2) дифениламин 3) раствор щелочи 4) раствор иода
Упражнение 6.3. Доказать присутствие карбонат-иона можно с помощью раствора … 1) сильной кислоты 2) перманганата калия 3) сероводорода 4) щелочи
Пример 6.2. Определить степень окисления ионов железа (+2 или +3) в растворе можно с помощью реагентов …
1) NH4CNS и (NH4)2С2О4 2) K3[Fe(CN) 6] и KJ 3) NH4OH и HCl 4) NH4CNS и K3[Fe(CN) 6]
Решение. Специфической реакцией на ион Fe2+ является взаимодействие с красной кровяной солью, сопровождающееся синим окрашиванием раствора
3Fe2+ + 2K3[Fe(CN) 6] → Fe3[Fe(CN) 6]2 + 6K+.
Ион Fe3+ обнаруживается специфической реакцией с роданидом аммония (красное окрашивание) Fe3+ + 3 NH4CNS → Fe(CNS)3 + 3NH4+.
Правильный ответ: 4.
Упражнение 6.4. Качественным реагентом на фосфат-ионы является …
1) красная кровяная соль 2) реактив Несслера 3) дифениламин 4) магнезиальная смесь
Пример 6.3. Признаком протекания качественной реакции между йодом и крахмалом является ... 1) выпадение бурого осадка 2) образование синей окраски
3) выделение бурого газа 4) образование бурой окраски
Решение. Взаимодействие йода и крахмала сопорвождается образованием окрашенного в синий цвет соединения
(С6Н10О5)n + nJ2 → n(С6Н10О5)∙J2.
Правильный ответ: 2.
Упражнение 6.5. Качественная реакция на ион аммония описывается уравнением …
1) 2NH4C1 + Na2S04→(NH4)2S04 +2NaCl 2) NH4Cl + AgN03→AgCl + NH4NO3
t
3) 2NH4C1 + Cu(OH)2→2NH4OH + CuCl2 4) NH4C1 + NaOH → NaCl + NH3↑+H20
