
- •Часть II рабочая тетрадь
- •Введение
- •1.1. Строение атома и периодическая система
- •1. 2. Химическая связь
- •2.1. Основы химической термодинамики
- •2.2. Химическая кинетика
- •Зависимость скорости реакции от температуры
- •2.3. Химическое равновесие
- •И стехиометрические расчёты
- •Характерные реакции оснóвных оксидов
- •4.1. Общие свойства растворов
- •4.2. Равновесия в растворах электролитов
- •Ионно-молекулярные реакции в растворах электролитов
- •Методы определения рН растворов
- •Гидролиз солей
- •5.1. Окислительно-восстановительные процессы
- •5.3. Электролиз
- •5.4. Коррозия металлов
- •Защитные покрытия
- •Электрохимические методы
- •6.1. Качественный химический анализ
- •6.2. Количественный химический анализ
- •6.3. Физико-химические и физические методы анализа
- •7.1. Общие сведения и методы получения полимеров
- •7.3. Природные полимеры
- •Библиографический список
- •Заключение


Защитные покрытия
Электрохимические методы
Рис. 5.11. Схема основных направлений защиты металлов от коррозии
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Электрохимическая коррозия при контакте двух металлов
Контакт двух металлов создаётся закреплением в стальной (Fe) скрепке цинковой и медной пластинок (рис. 5.12).
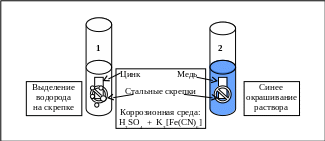

Рис. 5.12. Схема электрохимической коррозии при контакте двух металлов
Металлы помещаются в разбавленный раствор серной кислоты, куда добавляется несколько капель раствора красной кровяной соли, которая с ионами Fe2+ образует «турнбулеву синь» Fe3[Fe(CN)6]2 по уравнению
3 Fe2+ + 2 K3[Fe(CN)6] = Fe3[Fe(CN)6]2 + 6 K+.
Запишите в табл. 5.6 стандартные электродные потенциалы Zn, Fe, Cu (табл. 5.1) и уравнения электрохимических процессов, протекающих при коррозии. Для составления катодного процесса воспользуйтесь данными табл. 5.5.
Укажите, какой из металлов корродирует (окисляется) в первом и во втором случаях, имея в виду, что в присутствии ионов железа Fe2+ раствор окрашивается в синий цвет.
Таблица 5.6
Процессы электрохимической коррозии при контакте двух металлов
|
|
Контакт железа с цинком |
Контакт железа с медью |
Анодный процесс: (окисление) |
Анодный процесс: (окисление) |
Катодный процесс: (восстановление) |
Катодный процесс: (восстановление) |
Составьте правило, по которому можно определить, какой металл будет корродировать при контакте с другим металлом.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Защитные свойства металлических покрытий
В одну пробирку с раствором соляной кислоты с добавкой красной кровяной соли помещается пластинка луженого (покрытого оловом), а в другую – оцинкованного железа. На каждой пластинке предварительно делаются глубокие царапины, которые повреждают покрытия и делают доступным для коррозионной среды защищаемый металл ─ железо (рис. 5.13). Через некоторое время на лужёном образце появляется синее окрашивание (признак коррозии железа).
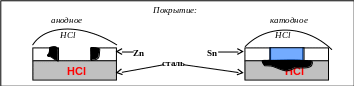
Рис. 5.13. Схема поведения металлических защитных покрытий
при нарушении их целостности
Составьте электронные уравнения процессов, происходящих при нарушении целостности металлических защитных покрытий (табл. 5.7).
Таблица 5.7
Процессы электрохимической коррозии при нарушении защитных покрытий
|
|
Сталь (Fe) покрыта цинком |
Сталь (Fe) покрыта медью |
Анодный процесс: (окисление) |
Анодный процесс: (окисление) |
Катодный процесс: (восстановление) |
Катодный процесс: (восстановление) |
В каком случае корродирует защищаемый металл, а в каком − защитное покрытие?
________________________________________________________________________________________________________________________________________________________________
Цинк в контакте со сталью выполняет функцию анода и разрушается, это покрытие анодное. Олово ─ менее активный металл, чем железо, поэтому корродировать будет железо, как более активный металл. Функцию катода выполняет олово, это будет катодное покрытие. В качестве анодных покрытий по стали выполняют цинковые, хромовые и кадмиевые (в морской воде). Материалом для катодных покрытий стали служат никель, олово, медь, серебро, золото.
Упражнение 5.7. Для защиты стального изделия в качестве катодного покрытия может быть использован металл
1) Никель 2) Цинк 3) Хром 4) Марганец
Для ответа пользуйтесь табл. 5.1.
________________________________________________________________________________________________________________________________________________________________
Упражнение 5.8. При нарушении свинцового покрытия на железном изделии в кислоте на катоде будет протекать реакция…
1) Pb0 – 2 ē → Pb2+ 2) Pb2+ + 2 ē → Pb0 3) H+ + 2 ē → H2 4) O2 + 2H2O + 4 ē → 4OH ˉ
Укажите правильный ответ в соответствии с табл. 5.5.
Упражнение 5.9. Уравнение процесса, протекающего на катоде при электрохимической коррозии железных изделий в нейтральной среде, имеет вид …
1)O2 + 4H+ + 4 ē → 2H2O 2) 2H+ + 2 ē → H2
3)Fe2+ + 2 ē → Fe0 4)O2 + 2H2O + 4 ē → 4OH-
Укажите правильный ответ в соответствии с табл. 5.5.
Упражнение 5.10. Уравнение процесса, протекающего на аноде при электрохимической коррозии кадмия в нейтральной среде, …
1)2H2O – 4 ē → O2 + 4H+ 2) Cd0 – 2 ē → Cd2+
3) 2H2O + 2 ē → H2 + 2OH ˉ 4) Cd2+ + 2 ē → Cd0
Задание 6. АНАЛИТИЧЕСКАЯ ХИМИЯ
