
- •Часть II рабочая тетрадь
- •Введение
- •1.1. Строение атома и периодическая система
- •1. 2. Химическая связь
- •2.1. Основы химической термодинамики
- •2.2. Химическая кинетика
- •Зависимость скорости реакции от температуры
- •2.3. Химическое равновесие
- •И стехиометрические расчёты
- •Характерные реакции оснóвных оксидов
- •4.1. Общие свойства растворов
- •4.2. Равновесия в растворах электролитов
- •Ионно-молекулярные реакции в растворах электролитов
- •Методы определения рН растворов
- •Гидролиз солей
- •5.1. Окислительно-восстановительные процессы
- •5.3. Электролиз
- •5.4. Коррозия металлов
- •Защитные покрытия
- •Электрохимические методы
- •6.1. Качественный химический анализ
- •6.2. Количественный химический анализ
- •6.3. Физико-химические и физические методы анализа
- •7.1. Общие сведения и методы получения полимеров
- •7.3. Природные полимеры
- •Библиографический список
- •Заключение
6.3. Физико-химические и физические методы анализа
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить лекцию «Физико-химические и физические методы анализа» [Конспект лекций, раздел 6.3].
Цель выполнения задания
Ознакомиться с инструментальными методами исследования состава, структуры и свойств строительных материалов.
Теоретические сведения
Любое (физическое, химическое, физико-химическое) явление, в результате которого изменяются свойства системы, может служить основанием для проведения анализа, если есть возможность зафиксировать эти изменения качественно или количественно. Можно считать, что основанием для появления аналитического сигнала в химических методах служит химическая реакция, в физико-химических методах аналитическим сигналом является физическое явление, возникшее в результате химической реакции, а в физических методах фиксируется определённое физическое свойство аналита. Как правило, в инструментальных методах анализа применяются сенсоры (датчики), которые дают информацию о составе и свойствах среды, в которой они находятся.
Наиболее часто для исследования состава, структуры и свойств строительных материалов применяют следующие группы методов анализа:
· оптические;
· электрохимические;
· термоаналитические;
· хроматографические.
Оптические спектроскопические методы исследования основаны на взаимодействии электромагнитного излучения с веществом и изучают спектры испускания (эмиссия), поглощения или рассеяния.
Возникающие аналитические сигналы несут качественную и количественную информацию в виде спектра. Спектр − совокупность спектральных линий, принадлежащих данной частице. Качественную информацию несёт частота сигнала ν (длина волны λ), связанная с природой вещества, количественную − интенсивность сигнала, зависящая от его количества (концентрации).
Методы, основанные на изучении спектров излучения, получили название эмиссионно-спектральных методов. Атомный эмиссионный спектральный анализ основан на изучении спектра паров исследуемого вещества. Прибор для эмиссионного анализа содержит следующие основные узлы:
· атомизатор, в котором идентифицируемое вещество переводится в атомарное состояние, например в пламени;
· диспергирующее устройство (призмы, дифракционные решётки, светофильтры) для выделения монохроматических составляющих излучения;
· приёмник излучения (детектор) для преобразования электромагнитной энергии в другие виды энергии, более удобные для измерения;
· устройство, регистрирующее спектр (рис. 6.4).
Эмиссионная пламенная фотометрия используется для идентификации щелочных и щелочноземельных металлов, которые окрашивают пламя в характеристические цвета:
Li, Sr, Ra ─ карминово-красный;· Na ─ ярко-жёлтый;· K ─ фиолетовый;· Rb ─ синевато-красный;· Cs ─ синий;· Ca ─ оранжево-красный.
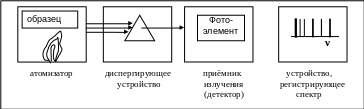
Рис. 6.4. Схема основных узлов прибора для эмиссионного спектрального анализа
Методы, основанные на изучении спектров поглощения, называются абсорбционно-спектральными методами. На поглощении света в видимой части спектра истинными растворами основаны фотоколориметрия и спектрофотометрия; взвесями − турбидиметрия, на рассеянии света взвесями − нефелометрия.
Спектрофотометр или фотоколориметр содержат по пять основных узлов:
1) источник излучения; 2) монохроматор, где выделяется длина волны, при которой происходит наиболее интенсивное поглощение; 3) исследуемый образец; 4) приёмник излучения; 5) устройство, регистрирующее спектр.
В фотоколориметрии проводится сравнение интенсивности окраски растворов: стандартного (с точно известной концентрацией) и исследуемого (с определяемой концентрацией). Основные узлы фотоэлектроколориметра представлены на рис. 6.5.
.

Рис.6.5. Схема основных узлов фотоэлектроколориметра
При прохождении через раствор аналита интенсивность падающего на раствор светового потока уменьшается вследствие перехода световой энергии во внутреннюю энергию вещества. Падающий световой поток интенсивностью ─ J0 отражается, поглощается и рассеивается до величины J ─ интенсивности прошедшего через раствор светового потока. Десятичный логарифм отношения lg [(J0) : (J)] = D называется оптической плотностью.
Согласно закону Бугера ─ Ламберта ─ Бера оптическая плотность D пропорциональна концентрации раствора ─ c и толщине слоя светопоглощающего раствора ─ l:
D = ε · c · l,
где ε ─ молярный коэффициент погашения раствора с концентрацией 1 моль/л, зави-
сящий от длины волны падающего света, природы аналита, температуры.
График в координатах: концентрация - оптическая плотность должен быть линеен и прямая должна проходить через начало координат. По калибровочному графику, который строят по нескольким растворам с точно известной концентрацией, определяют концентрацию анализируемого вещества.
Электрохимические методы идентификации основаны на окислительно-восстановительных свойствах веществ и таких химических процессах, протекание которых сопровождается возникновением электрического тока, или, наоборот, происходит при воздействии тока.
Аналитическим сигналом служит любой электрический параметр:
· в потенциометрии − электродный потенциал, ЭДС
· в кондуктометрии − электропроводимость
· в кулонометрии − количество электричества,
величина которого зависит от состава исследуемой системы (концентрации аналита).
В потенциометрическом методе исследования измеряют электродвижущую силу (ЭДС) обратимых электрохимических систем, для чего необходимо наличие двух электродов: индикаторного и электрода сравнения.
Индикаторный электрод обнаруживает и фиксирует аналитический сигнал, а электрод сравнения помогает измерить этот сигнал (рис. 6.6).

Рис. 6.6. Схема измерения ЭДС в потенциометрии
Потенциал индикаторного электрода зависит от концентрации анализируемого вещества, потенциал электрода сравнения не меняется при проведении исследований. В качестве последнего часто используют хлоридсеребряный электрод, потенциал которого при постоянной концентрации Сl ˉ остаётся неизменным.
Особую группу индикаторных электродов составляют ионоселективные (мембранные) электроды, потенциал которых в зависимости от типа мембраны и может определяться активностью различных ионов. В частности, потенциал стеклянного электрода зависит от активности ионов водорода ан+. Поскольку рН = − lg ан+, то с помощью индикаторного стеклянного электрода можно измерять рН растворов и суспензий. Примером является измерение рН водных вытяжек цементного камня, которые получают путём отделения жидкой фазы суспензии измельчённого цементного камня и воды.
Кондуктометрические методы основаны на измерении электропроводимости. В области сравнительно невысоких концентраций эквивалентная электрическая проводимость электролитов λ, [ Cм · м2 · моль-1] обычно растет с уменьшением концентрации раствора. На существовании линейной зависимости между электропроводимостью и концентрацией основана прямая кондуктометрия.
Электрическая проводимость разбавленных растворов обратно пропорциональна концентрации электролитов, что даёт возможность определять содержание аналита в растворе по методу калибровочного графика, который строится по значениям электрической проводимости того же раствора с известными концентрациями (рис. 6.7 − а).
В методе кондуктометрического титрования могут быть использованы химические реакции, в ходе которых достаточно заметно изменяется электрическая проводимость и в точке эквивалентности изменение происходит скачкообразно (рис. 6.7 − б).

Рис. 6.7. Калибровочный график (а) и кривая кондуктометрического титрования (б)
Кулонометрический метод идентификации основан на законе М. Фарадея (закон электролиза), согласно которому масса, образующегося на электродах вещества (испытавшего электрохимическое превращение) прямо пропорциональна количеству прошедшего электричества:
![]()
где m ─ масса вещества, окисленного или восстановленного на электроде, г;
М э ─ молярная масса эквивалента вещества, г/моль; I ─ сила тока, А;
t ─ время электролиза, с; 96500 ─ число Фарадея, Кл/моль (А · с/моль).
Установка для проведения анализа должна содержать источник постоянного тока, по которому фиксируется сила тока I, а также ячейку, в которой происходит электрохимическое превращение аналита. По окончании электролиза, проведённого в течение определённого времени t, определяется количество преобразованного вещества: взвешиванием катода, измерением объёма выделившегося газа или титрованием − изменение концентрации раствора (рис. 6.8).

Рис. 6.8. Схема установки для кулонометрического анализа
Хроматографические методы анализа основаны на многократно повторяющихся процессах сорбции и десорбции в динамических условиях и позволяют разделять многокомпонентные смеси, т.к. способность к сорбции зависит от природы веществ. Разделение сложных смесей основано на различных физико-химических свойствах аналита и осуществляется пропусканием подвижной фазы через неподвижную (стационарную). По характеру стационарной фазы хроматография подразделяется на адсорбционную, распределительную, ионообменную.
Вещество, на поверхности которого происходит разделение и концентрирование фаз анализируемых веществ, называется сорбентом. В адсорбционной хроматографии сорбент является стационарной фазой, которая адсорбирует порцию каждого компонента из смеси. Вещество, поглощаемое сорбентом, называется сорбтивом. Процесс, обратный адсорбции, называется десорбцией. Десорбцию, осуществляемую с помощью жидкости, называют элюцией, а жидкости или растворители, применяемые для этого, называют элюэнтами. Принципиальная схема газового хроматографа представлена на рис. 6.9.

Рис. 6.9. Схема газового хроматографа
Подвижной фазой в газовой хроматографии является инертный газ, пробу подают в дозатор в виде паров. В хроматографической колонке компоненты пробы распределяются на сорбенте в зависимости от сорбционной способности и перемещаются вдоль колонки под действием газа-носителя. Детектор − устройство для непрерывной регистрации концентрации компонентов, выходящих из колонки. Для регистрации хроматограммы можно использовать измерение любого аналитического сигнала, идущего от подвижной фазы и связанного с природой и количеством компонентов смеси: теплопроводность, интенсивность светопоглощения, электропроводность.
К достоинствам хроматографического метода анализа относится быстрота и надёжность, возможность определения нескольких компонентов смеси или раствора. Хроматография используется для выяснения механизма реакций, для контроля содержания токсичных веществ в строительных материалах.
ВЫПОЛНЕНИЕ ЗАДАНИЯ
В нижеследующих упражнениях отметьте правильные ответы.
Упражнение 6.6. Наиболее удобным источником перевода вещества в атомарное состояние, является ... 1) радиочастота 2) механическое воздействие 3) ультразвук 4) пламя
Упражнение 6.7. Ионы натрия окрашивают пламя в _______________ цвет.
1) красный 2) желтый 3) зеленый 4) фиолетовый
Упражнение 6.8. Величина, которая является качественной характеристикой вещества и зависит от его природы в методе спектрофотометрии, называется...
1) длиной волны 2) амплитудой сигнала
3) интенсивностью поглощения 4) световым потоком
Упражнение 6.9. По закону Бугера-Ламберта-Бера в методе спектрофотометрии ____________ зависит от концентрации анализируемого вещества
1)интенсивность излучения 2)длина волны
3)интенсивность окраски 4)оптическая плотность
Упражнение 6.10. Интенсивность излучения при прохождении через образец в методе атомно-адсорбционной спектроскопии ... 1) не изменяется 2) увеличивается 3) уменьшается 4) изменяется неоднозначно
Упражнение 611. Для определения концентрации вещества в фотометрическом методе строят градуировочный график зависимости в координатах:
1) цветность - масса раствора 2) оптическая плотность - концентрация раствора
3) оптическая плотность - толщина кюветы 4) длина волны - содержание вещества в растворе
Упражнение 6.12. Электрохимические методы анализа основаны на _______ способности веществ
1) окислительно-восстановительной 2) ионообменной
3) окислительной 4) восстановительной
Упражнение 6.13. Метод анализа, основанный на зависимости потенциала электрода от концентрации ионов, называется … 1) потенциометрия 2) кондуктометрия 3) кулонометрия 4) полярография
Упражнение 6.14. Для определения рН растворов потенциометрическим методом в качестве индикаторного наиболее часто используется ______ электрод. 1) металлический 2) газовый 3) стеклянный 4) хлоридсеребряный
Упражнение 6.15. Метод анализа, основанный на зависимости электропроводности раствора от концентрации электролита, называется ...
1) рефрактометрией 2) кулонометрией
3) полярографией 4) кондуктометрией
Упражнение 6.16. На каком процессе основан кулонометрический анализ:
1) электролитическая диссоциация 2) электролиз
3) гидролиз 4) гальванический элемент
Упражнение 6.17. Метод кулонометрии основан на использовании закона ...
1) Фарадея 2) Клайперона-Клаузиуса 3) Ламберта-Бугера-Бера 4) Эйнштейна
Упражнение 6.18. Метод анализа, основанный на зависимости массы преобразованного вещества от количества электричества, называется … 1) потенциометрия 2) кулонометрия 3) полярография 4) кондуктометрия
Упражнение 6.19. Хроматографические методы анализа основаны на различной _____________ способности определяемых веществ. 1) сорбционной 2) фотохимической
3)электрохимической 4)окислительно-восстановительной
Упражнение 6.20. Хроматография - это процесс
1) осаждения 2) разделения 3) растворения 4) сорбции
Задание 7. ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ
