
- •Часть II рабочая тетрадь
- •Введение
- •1.1. Строение атома и периодическая система
- •1. 2. Химическая связь
- •2.1. Основы химической термодинамики
- •2.2. Химическая кинетика
- •Зависимость скорости реакции от температуры
- •2.3. Химическое равновесие
- •И стехиометрические расчёты
- •Характерные реакции оснóвных оксидов
- •4.1. Общие свойства растворов
- •4.2. Равновесия в растворах электролитов
- •Ионно-молекулярные реакции в растворах электролитов
- •Методы определения рН растворов
- •Гидролиз солей
- •5.1. Окислительно-восстановительные процессы
- •5.3. Электролиз
- •5.4. Коррозия металлов
- •Защитные покрытия
- •Электрохимические методы
- •6.1. Качественный химический анализ
- •6.2. Количественный химический анализ
- •6.3. Физико-химические и физические методы анализа
- •7.1. Общие сведения и методы получения полимеров
- •7.3. Природные полимеры
- •Библиографический список
- •Заключение
5.1. Окислительно-восстановительные процессы
Цель выполнения задания
· Усвоить суть процессов окисления и восстановления.
· Научиться рассчитывать коэффициенты в уравнениях окислительно-восстановительных реакций.
· Ознакомиться с влиянием среды на характер окислительно-восстановительных процессов.
Теоретические сведения
Окислительно-восстановительные реакции сопровождаются перемещением электронов от одних частиц (восстановителей) к другим частицам (окислителям), при этом изменяются степени окисления этих частиц. Под степенью окисления понимают воображаемый заряд атома, вычисленный из предположения, что соединение состоит из ионов. Степени окисления имеют знак «+» или «−» и целочисленное значение.
Степени окисления элемента в простом веществе равны нулю. В химических соединениях более электроотрицательный элемент имеет отрицательную степень окисления, а менее электроотрицательный − положительную. Алгебраическая сумма степеней окисления в нейтральной молекуле равна нулю, в сложном ионе − заряду иона.
У большинства элементов высшая степень окисления имеет положительный знак и равна номеру группы в периодической системе. Для неметаллов низшая степень окисления равна высшей минус восемь, а поэтому имеет отрицательный знак, Например, высшая степень окисления серы равна «+6», а низшая равна: 6 − 8 = −2.
Обычно в соединениях степень окисления фтора равна «─1», кислорода ─ «─2», водорода ─ «+1».
Пример 5.1. Вычислить степени окисления всех элементов в соединениях:
HNO2, H2SO4, Cr2O3, Fe2(SO4)3.
Одни элементы проявляют постоянную степень окисления, а другие − переменную. Постоянные степени окисления укажем как известные, а неизвестные обозначим через «х».
+1 х −2 +1 х −2 х −2
H N O2, H2 S O4, Cr2 O3,
Составим соответствующие алгебраические уравнения:
[+1 + х + (−2) 2] = 0 [+1 + х + (−2) 4] = 0 [2х + (−2) 3] = 0
Вычислим степени окисления:
«N» в HNO2: х = +3; «S» в H2SO4: х = +6; «C»r в Cr2O3: 2х = +6, х = +3.
В соединении Fe2(SO4)3 два элемента: железо и сера проявляют переменную степень окисления, поэтому вначале вычисляем степень окисления серы в сложном ионе SO42‾: [х + (−2)4] = −2, => х = +6.
Затем вычисляем степень окисления железа:
х +6 −2
Fe2 (S O4)3
[2х + (+6)3 + (−2) ·4 ·3] = 0, => х = +3.
Упражнение 5.1. Вычислить степени окисления всех элементов в соединениях:
H2O, HCl, K2CO3, KCl, KClO3, Gr2(SO4)3, H2S
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 5.2. Правила расчёта коэффициентов в уравнениях окислительно-восстановительных реакций рассмотрим на примере взаимодействия дихромата калия с йодидом калия в кислой среде. Запишем схему реакции, определим степени окисления всех элементов и подчеркнём те из них, которые изменили степени окисления:
+1 +6 −2 +1 −1 +1 +6 −2 +3 +6 −2 0 +1 +6 −2 +1−2
K2 Cr2 O7 + K J + H2 S O4→ Cr2 (S O4)3 + J2 + K2 S O4 + H2 O
Составим уравнения электронного баланса, в которых определим число электронов, принимаемых окислителем и отдаваемых восстановителем:
+6 +3
2 Cr + 6 ē → 2 Cr, процесс окисления;
−1 0
2 J + 2 ē → J2, процесс восстановления.
Кратное число отдаваемых и принимаемых электронов равно шести. Отсюда находим коэффициенты перед окислителем и восстановителем в уравнении реакции:
+6 +3
окислитель: 1 │ 2 Cr + 6 ē → 2 Cr, процесс окисления;
│ −1 0
восстановитель: 3 │ 2 J − 2 ē → J2, процесс восстановления
1 K2Cr2O7 + 6 KJ + H2SO4→ 1 Cr2(SO4)3 + 3J2 + K2 SO4 + H2O.
Уравниваем количества всех остальных атомов по закону сохранения массы веществ в следующем порядке:
а) количество атомов металла, не изменивших степень окисления (слева направо);
б) ионы кислотных остатков среды (справа налево);
в) количество ионов водорода.
K2Cr2O7 + 6 KJ + 7H2SO4→ Cr2(SO4)3 + 3J2 + 4K2 SO4 + 7H2O.
Проверку правильности определения коэффициентов осуществляют путём подсчёта атомов кислорода ─ их должно быть равно слева и справа: 35 = 35.
Упражнение 5.2. Рассчитать коэффициенты в реакции:
КСlO3 + FeSO4 + H2SO4 → KCl + Fe2(SO4)3 + H2O
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Окислительно-восстановительные процессы с участием простых веществ
Схема проведения эксперимента и полученные результаты представлены на рис. 5.1.
В пробирку наливается раствор сульфата меди и в него помещается образец железа. Через некоторое время на железе появляется красно-коричневый налёт мелкодисперсной меди и уменьшается интенсивность окраски раствора, обусловленная гидратированными ионами меди. Схема происходящей окислительно-восстановительной реакции:
Fe + CuSO4 → Cu + FeSO4.
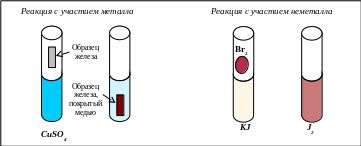
Рис. 5.1. Схема проведения окислительно-восстановительных реакций
с участием простых веществ
Во второй пробирке находится раствор йодида калия и в него вносится небольшое количество жидкого брома. Раствор окрашивается в красно-коричневый цвет раствора йода в KJ. Схема происходящей окислительно-восстановительной реакции:
KJ + Br2 → KBr + J2.
Рассчитайте коэффициенты в обеих реакциях, предварительно, определив степени окисления всех участников реакций и написав уравнения электронного баланса. Укажите, какую функцию (окислителя или восстановителя) выполняет металл, а какую − неметалл.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Влияние реакции среды на окислительные свойства перманганата калия
Схема проведения эксперимента и полученные результаты представлены на рис. 5.2.
В три пробирки наливается фиолетово-розовый раствор перманганата калия. В первую пробирку наливается раствор серной кислоты (кислая среда), во вторую − раствор КОН (щелочная среда), в третьей пробирке среда остаётся нейтральной. Затем в каждую пробирку добавляется сульфит натрия.
В первой пробирке раствор обесцвечивается, во второй появляется зелёная окраска, а в третьей − бурый осадок. Схемы происходящих окислительно-восстановительных реакций написаны ниже.
Рассчитайте коэффициенты, укажите процесс (окисления или восстановления), окислитель и восстановитель.
KMnO4 + Na2SO3 + H2SO4 → K2SO4 + MnSO4 + Na2SO4 + H2O
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
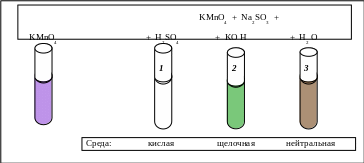
Рис. 5.2. Схема изучения окислительных свойств KMnO4 в различных средах
KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O
________________________________________________________________________________________________________________________________________________________________
KMnO4 + Na2SO3 + H2O → MnO2 + Na2S O4 + KOH
________________________________________________________________________________________________________________________________________________________________
В какой среде в наибольшей степени проявляются окислительные свойства KMnO4, т.е. где в бóльшей мере изменяется степень окисления марганца?
________________________________________________________________________________
ТИПОВЫЕ КОНТРОЛЬНЫЕ УПРАЖНЕНИЯ
1. Коэффициент перед окислителем в уравнении реакции
K2S + NaClO + H2SO4 → S + NaCl + K2SO4 + H2O
равен… 1) 2 2) 1 3) 4 4) 3.
2. Общая сумма коэффициентов в уравнении реакции
KNO2 + KЈ + H2SO4 → Ј2 + NO + K2SO4 + H2O
равна … 1)12 2) 7 3) 10 4) 13.
3. В реакции Cr2O3 + KNO3 + KOH → K2CrO4 + KNO2 + H2O
окислителем является … 1) Cr2O3 2) KOH 3) KNO2 4) KNO3
5.2. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить:
· лекцию «Электродные потенциалы. Гальванический элемент» [Конспект лекций, раздел 5.2].
· видеофильм «Активность металлов в растворах электролитов» [Приложение к УМК]
· видеозапись лабораторной работы «Химическая активность металлов» [Приложение к УМК: диск 4].
Цель выполнения задания
· Рассмотреть механизм работы гальванического элемента.
· Научиться рассчитывать электродные потенциалы и ЭДС гальванического элемента.
Теоретические сведения
Все металлы являются восстановителями. Они сравнительно легко отдают валентные электроны, так как имеют низкое значение потенциала ионизации. Низшая степень окисления металлов равна нулю, они вступают в реакции с различными окислителями, при этом в полученных соединениях их ионы всегда имеют положительную степень окисления.
При контакте металла с раствором собственной соли протекают два противоположных процесса: 1) переход ионов из металла в раствор;
2) адсорбция катионов из раствора на поверхности металла.
Если в начальный момент времени скорость первого процесса больше скорости второго, поверхность металла приобретает избыточный отрицательный заряд, а прилегающий слой раствора – положительный; и наоборот, если скорость второго процесса больше скорости первого, поверхность металла заряжается положительно, а прилегающий слой раствора – отрицательно. И в том, и в другом случае между двумя заряженными слоями возникает разность потенциалов, называемая электродным потенциалом. Величина электродного потенциала зависит от природы металла, концентрации ионов в растворе, температуры и определяется уравнением Нернста:
![]() (5.1)
(5.1)
где
![]() ―
стандартный электродный потенциал,
возникающий на границе раздела
―
стандартный электродный потенциал,
возникающий на границе раздела
металл – раствор при концентрации ионов металла 1 моль/л, температуре
298 К и давлении 101 кПа;
n ― число электронов, принимающих участие в процессе на электроде;
![]() ―
концентрация ионов металла в растворе.
―
концентрация ионов металла в растворе.
Значения стандартных электродных потенциалов содержатся в справочной литературе, некоторые из них представлены в табл. 5.1.
Металлы, расположенные в порядке возрастания алгебраической величины их электродных потенциалов, образует ряд электрохимической активности металлов, называемый «рядом активности» (рис. 5.3).

Рис. 5.3. Ряд активности металлов
Чем отрицательнее значение электродного потенциала, тем более активным восстановителем является металл. Ряд стандартных электродных потенциалов характеризует электрохимическую активность металлов в окислительно-восстановительных реакциях, протекающих в водной среде при стандартных условиях.
Таблица 5.1
Стандартные электродные потенциалы в водных растворах

Так как в любой окислительно-восстановительной реакции происходит переход электронов от восстановителя к окислителю, можно создать такие условия, при которых окислительная и восстановительная реакции будут протекать на разных участках поверхности. При этом электроны будут переходить от восстановителя к окислителю не непосредственно, а по проводнику электрического тока, т.е. энергия химической реакции будет превращена в электрическую энергию.
Устройства, которые применяются для преобразования энергии химической реакции в электрическую энергию, называются гальваническими элементами (рис. 5.4). Действие любого гальванического элемента основано на протекании в нем окислительно-восстановительной реакции.
В простейшем случае гальванический элемент состоит из двух металлических электродов, погруженных в раствор электролита. Процесс окисления протекает на более активном металле, его называют анодом; процесс восстановления – на менее активном, его называют катодом. Электроны при этом переходят от анода к катоду по внешней цепи, ионы движутся от катода к аноду в растворе и через электролитический мостик.
Электродвижущая сила гальванического элемента (ЭДС) равна разности электродных потенциалов катода и анода:
ЭДС = Е к − Е а, (5.2)
где Ек – потенциал катода; Еа – потенциал анода.
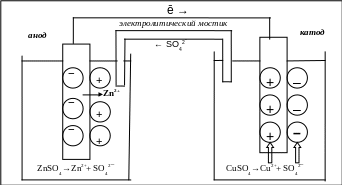
Рис. 5.4. Графическое изображение медно-цинкового гальванического элемента
Пример 5.3. Гальванический элемент состоит из железного электрода, помещённого в раствор нитрата железа (II) c молярной концентрацией 0,01 моль/л и серебряного электрода, помещённого в раствор нитрата серебра с молярной концентрацией 1 моль/л. Запишите схему гальванического элемента, процессы на электродах и вычислите ЭДС.
Решение. Для определения функции электрода (анод – катод) следует рассчитать величины их электродных потенциалов по уравнению Нернста (значения стандартных электродных потенциалов в табл. 5.1).
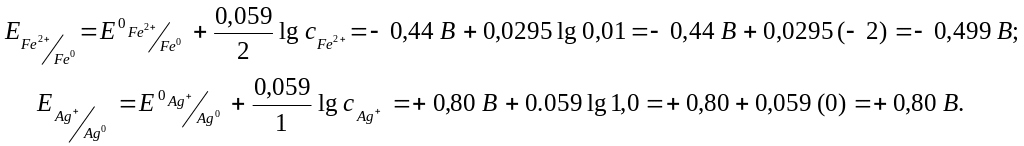 Железный электрод имеет
отрицательное значение потенциала
(является более активным металлом),
поэтому будет выполнять функцию анода.
Серебряный электрод менее активный, он
будет катодом.
Железный электрод имеет
отрицательное значение потенциала
(является более активным металлом),
поэтому будет выполнять функцию анода.
Серебряный электрод менее активный, он
будет катодом.
Схема гальванического элемента записывается следующим образом:
(анод) Fe | Fe(NO3)2 || Ag(NO3) | Ag (катод). (5.3)
Процессы на электродах:
Анод: Fe0 – 2е → Fe2+; процесс окисления. (5.4)
Катод: 2Ag+ + 2е → 2Ag0; процесс восстановления. (5.5)
Реакция, в результате которой возникает электрический ток (токообразующая реакция):
Fe + 2Ag(NO3) → Fe(NO3)2 + 2Ag .
Электродвижущая сила гальванического элемента равна:
ЭДС = Екатода – Еанода = 0,80 В – (– 0,499 В) = 1,299 В.
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Измерение ЭДС гальванического элемента
Медный и цинковый электроды помещаются в стаканы, наполненные соответственно растворами сульфата меди (0,1 М CuSO4) и сульфата цинка (0,1 М ZnSO4) (рис. 5.4).
Растворы соединяются электролитическим мостиком, а электроды подключаются к выводам измерительного прибора: (катод – к «+», анод – к «–»). Измеряется величина ЭДС и записывается в графу: величина ЭДС экспериментальная, табл. 5.2.
По уравнению Нернста (формула 5.1) вычислите значения электродных потенциалов медного и цинкового электродов, значения Е0 возьмите в табл. 5.1. Запишите схему гальванического элемента (подобно выражению 5.3), процессы на электродах (подобно выражениям 5.4, 5.5) и вычислите ЭДС (формула 5.2). Значения электродных потенциалов и рассчитанную теоретическую величину ЭДС запишите в табл. 5.2.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Таблица 5.2
ЭДС медно-цинкового гальванического элемента
Электрод (полуэлемент) |
Концентрация электролита, моль/л |
Стандартный электродный потенциал, В |
Величина электродного потенциала, В |
Величина ЭДС |
|
теоретическая |
экспериментальная |
||||
Zn/ZnSO4 |
0,1 |
|
|
|
1,07 |
Cu/CuSO4 |
0,1 |
|
|
||
Сравните теоретическое и экспериментальное значения ЭДС медно-цинкового гальванического элемента.
Пример 5.4. При работе гальванического элемента, состоящего из никелевого и кадмиевого электродов, погруженных в 0,01 М растворы их хлоридов, на катоде будет протекать реакция, уравнение которой имеет вид …
1) Ni2+ + 2 ē = Ni0 2) Cd0 – 2 ē = Cd2+ 3) Ni0 – 2 ē = Ni2+ 4) Cd2+ + 2 ē = Cd0
Решение. Вычислим значения электродных потенциалов по уравнению Нернста (формула 5.1):
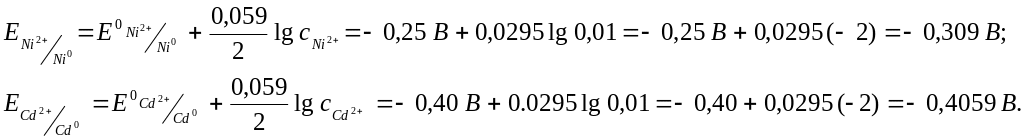 Кадмий
имеет более отрицательное значение
электродного потенциала, поэтому в
гальваническом элементе он будет анодом,
а никель − катодом.
Кадмий
имеет более отрицательное значение
электродного потенциала, поэтому в
гальваническом элементе он будет анодом,
а никель − катодом.
На катоде протекает реакция восстановления катионов из раствора, в который погружен никелевый катод: NiCl2 → Ni2+ + SO42‾, т.е. ионов Ni2+. Правильный ответ: 1.
Упражнение 5.3. При работе гальванического элемента, состоящего из серебряного и медного электродов, погруженных в 0,01 М растворы их нитратов (Е0(Ag+/Ag) = 0,80 В, Е0(Cu2+/Cu) = 0,34 В), на аноде протекает реакция, уравнение которой имеет вид…
1) Cu0 – 2 ē = Cu2+ 2) Ag+ + ē = Ag0 3) Ag0 - ē = Ag+ 4) Cu2+ + 2 ē = Cu0
Вычислите значения электродных потенциалов серебряного и медного электродов, определите, какой из них будет анодам, а какой катодом, Запишите схему гальванического элемента, процессы на аноде и катоде.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 5.5. Если гальванический элемент содержит стандартный свинцовый электрод (Е0 = −0,13 В), то для достижения наибольшего значения ЭДС второй электрод должен быть изготовлен из …
1) Co (Е0 = − 0,28 В) 2) Ag (Е0 = + 0,80 В) 3) Mn (Е0 = − 1,18 В) 4) Ni (Е0 = − 0,76 В)
Решение. ЭДС равна алгебраической разности электродных потенциалов катода и анода (формула 5.2), поэтому для достижения наибольшего значения ЭДС потенциал катода должен быть наименее отрицательным, а потенциал анода − наиболее отрицательным. В нашем случае этому условию отвечает гальванический элемент, составленный из свинца (катод) и марганца (анод):
ЭДС = (− 0,13) В − (− 1,18) В = 1,05 В.
Правильный ответ: 3
Упражнение 5.4. Если гальванический элемент содержит стандартный никелевый электрод (Е0 = − 0,25 В), то для достижения наибольшего значения ЭДС второй электрод должен быть изготовлен из …
1) Cd (Е0 = − 0,40 В) 2) Ti (Е0 = − 1,63 В) 3) Ag (Е0 = + 0,80 В) 4) Zn (Е0 = − 0,76 В).
Вычислите значения ЭДС всех предлагаемых элементов и найдите наибольшее значение.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
ТИПОВЫЕ КОНТРОЛЬНЫЕ УПРАЖНЕНИЯ
1. ЭДС гальванического элемента, состоящего из свинцового и цинкового электродов, погруженных в 0,001 М растворы их хлоридов
(Е0(Pb2+/Pb) = −0,13 В, Е0(Zn2+/Zn) = − 0,76 В), равна_________ В.
1) 0, 69 2) 0,63 3) 1,10 4) 0,28
2. При работе гальванического элемента, состоящего из марганцевого и цинкового электродов, погруженных в 0,01 М растворы их сульфатов, на аноде будет протекать реакция, уравнение которой имеет вид …
1) Mn2+ + 2e- = Mn0 2) Zn0 – 2e- = Zn2+ 3) Mn0 – 2e- = Mn2+ 4) Zn2+ + 2e- = Zn0
3. Если гальванический элемент содержит стандартный медный электрод (Е0 = +0,34 В), то для достижения наибольшего значения ЭДС второй электрод должен быть изготовлен из .. 1) Cd (Е0 = − 0,40 В) 2) Ag (Е0 = + 0,80 В) 3) Zn (Е0 = − 0,76 В) 4) Mg (Е0 = − 2,37 В)
