
- •Часть II рабочая тетрадь
- •Введение
- •1.1. Строение атома и периодическая система
- •1. 2. Химическая связь
- •2.1. Основы химической термодинамики
- •2.2. Химическая кинетика
- •Зависимость скорости реакции от температуры
- •2.3. Химическое равновесие
- •И стехиометрические расчёты
- •Характерные реакции оснóвных оксидов
- •4.1. Общие свойства растворов
- •4.2. Равновесия в растворах электролитов
- •Ионно-молекулярные реакции в растворах электролитов
- •Методы определения рН растворов
- •Гидролиз солей
- •5.1. Окислительно-восстановительные процессы
- •5.3. Электролиз
- •5.4. Коррозия металлов
- •Защитные покрытия
- •Электрохимические методы
- •6.1. Качественный химический анализ
- •6.2. Количественный химический анализ
- •6.3. Физико-химические и физические методы анализа
- •7.1. Общие сведения и методы получения полимеров
- •7.3. Природные полимеры
- •Библиографический список
- •Заключение
Введение
Рабочая тетрадь служит как для описания химического эксперимента, так и для самоконтроля усвоенного материала, что очень важно в дистанционном обучении.
Тетрадь содержит 7 заданий по четырём блокам (дидактическим единицам) рабочей программы, т.е. изучается полный курс дисциплины «Химия». Для выполнения каждого задания следует изучить и усвоить относящийся к данному заданию материал по источникам, указанным в разделе «Подготовка к выполнению задания».
Краткие теоретические сведения рабочих заданий являются основой для понимания описываемых экспериментов и приводимых примеров. Упражнения предназначены для самостоятельного выполнения и являются методом самоконтроля усвоения учебного материала.
Разделы «Выполнение задания» содержат типовые примеры, ориентируясь на которые студент может самостоятельно выполнить предлагаемые упражнения, причём, следует не только указывать правильные ответы, но и давать достоверные пояснения на свободных строчках. Если перед номерами ответов стоят значки «□», то правильных ответов несколько.
Задание, выполненное без пояснения, не зачитывается.
При изучении экспериментальной части раздела «Выполнение задания» в соответствующих местах рабочей тетради составляется уравнения реакций описанных опытов, формулируются и записываются выводы.
Рабочие задания сопровождается типовыми контрольными упражнениями, аналогичными заданиям экзаменационного тестирования и предназначены для самоконтроля степени усвоения материала студентами.
Задания 1и 7 написаны О.В. Артамоновой; 2-5 – О.Р. Сергуткиной, 6 – О.Б. Кукиной.
Задание 1. СТРОЕНИЕ ВЕЩЕСТВА
1.1. Строение атома и периодическая система
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить:
· лекцию «Строение атома и периодическая система» [Конспект лекций, раздел 1.1]
Цель выполнения задания
∙ Установить связь между положением элементов в периодической системе, строением их электронных оболочек и свойствами.
∙ Выяснить причины и закономерности периодического изменения свойств элементов и их соединений.
Теоретические сведения
Атом химического элемента представляет собой сложную квантово-механическую систему. Охарактеризовать состояние электрона в атоме можно с помощью квантовых чисел: главного, орбитального, магнитного, спинового. В квантово-механической модели строения атома используют вероятностный подход. Область пространства, в котором наиболее вероятно нахождение электрона, называется атомной орбиталью.
Атомные орбитали, разрешённые на первых четырёх энергетических уровнях и соответствующие им состояния электронов представлены в табл. 1.1.
Таблица 1.1
Значения квантовых чисел и состояния электронов
Главное квантовое число |
n = 1 |
n = 2 |
n = 3 |
n = 4 |
Орбитальное квантовое число и типы АО |
s (l=0) |
s (l=0), p(l=1)
|
s(l=0), p(l=1), d(l=2) |
s(l=0), p(l=1), d(l=2), f(l=3) |
Состояние электрона |
1s |
2s, 2p |
3s, 3p, 3d |
4s, 4p, 4d, 4f |
Электронное строение атома может быть представлено в виде электронных формул или энергетических (квантовых) ячеек. При распределении электронов в атоме учитывают:
∙ принцип минимальной энергии,
∙ правило Клечковского;
∙ принцип (запрет) Паули;
∙ правило Гунда.
Электроны в атоме в первую очередь заполняют атомные орбитали с минимальной энергией. Последовательность заполнения атомных орбиталей:
l s < 2 s < 2р < 3 s < 3р < 4 s < 3d < 4р < 5 s ≈ 4 d < 5р < 6 s ≈ 5 d ≈ 4f …. (1.1)
В соответствии с принципом Паули на одной атомной орбитали максимально может быть только два электрона.
Порядок написания электронных формул следующий:
1) по таблице Д.И. Менделеева находят символ элемента и записывают его;
2) слева внизу от символа ставят порядковый номер элемента, который указывает общее количество электронов в атоме;
3) после символа – номер энергетического уровня: 1, 2, 3, 4, …, значение которого численно совпадает с главным квантовым числом;
4) затем − тип орбитали (s, p, d, f). Сверху справа над типом орбитали записывают количество электронов на данной орбитали.
Электронное строение атома определяет положение элемента в периодической системе. Номер периода совпадает с максимальным значением главного квантового числа. Количество неспаренных электронов определяет валентность в стационарном состоянии, номер группы совпадает с максимальной степенью окисления элемента.
С ростом заряда ядра периодически меняется электронная конфигурация атомов, поэтому периодически меняются различные характеристики атомов, например, их размеры, энергия ионизации, сродство к электрону, относительная электроотрицательность, валентность, степень окисления и другие, определяющие окислительно-восстановительную способность и кислотно-основную характеристику элементов.
Тенденции изменения энергии ионизации (J), сродства к электрону (E) и относительной электроотрицательности (ОЭО) элементов главных подгрупп II − IV периодов периодической системы представлены на рис. 1.1.
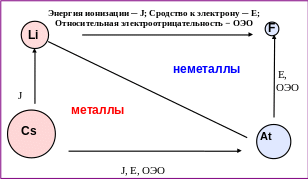
Рис. 1.1. Изменение энергии ионизации, сродства к электрону и относительной
электроотрицательности в главных подгруппах периодической системы элементов
В одних и тех же группах и в одних и тех же подгруппах расположены элементы с одинаковым строением внешних электронных оболочек (электронные аналоги), которые оказывают наибольшее влияние на химические свойства элементов. Поэтому можно сказать, что в одних и тех же группах и подгруппах находятся элементы со сходными свойствами, что находит своё выражение в составе высших оксидов, гидроксидов и летучих водородных соединений (табл. 1.2)
Таблица 1.2
Формулы некоторых соединений в зависимости от положения
элементов в периодической системе
Главные подгруппы периодической системы |
||||||
I |
II |
III |
IV |
V |
VI |
VII |
Число электронов на внешнем электронном уровне |
||||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
Формулы высших оксидов |
||||||
Э2О |
ЭО |
Э2О3 |
ЭО2 |
Э2О5 |
ЭО3 |
Э2О7 |
Формулы газообразных водородных соединений |
||||||
|
|
|
ЭН4 |
ЭН3 |
Н2Э |
НЭ |
Формулы высших гидроксидов |
||||||
ЭОН |
Э(ОН)2 |
Э(ОН)3 |
Н2ЭО3 |
НЭО3 |
Н2ЭО4 |
НЭО4 |
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Пример 1.1. Максимальное число электронов на орбитали n = 2, l = 1 равно …
1) 4 2) 6 3) 8 4) 2
Решение. В соответствии с табл. 1.1, значению n = 2, l = 1 соответствуют атомные орбитали 2р, которых максимально может быть три. В соответствии с принципом Паули на одной орбитали максимально может быть только два электрона, а на трёх − 6.
Правильный ответ: 2.
Упражнение 1.1. Максимальное число электронов на орбитали n = 3, l = 2 равно …
1) 4 2) 6 3) 10 4) 2
________________________________________________________________________________________________________________________________________________________________
Пример 1.2. Относительная величина электроотрицательности элементов уменьшается в ряду … □ 1) Se, S, O □ 2) B, C, N □ 3) Cl, Br, J □ 4) P, Si, Al
Решение. Относительная величина электроотрицательности элементов уменьшается в периодах справа налево (ответ 4) и в главных подгруппах сверху вниз (ответ 3).
Правильные ответы: 3 и 4.
Упражнение 1.2. Относительная величина электроотрицательности элементов увеличивается в ряду … □ 1) As, P, N □ 2) Al, Si, P □ 3) O, S, Se □ 4) P, Al, Si
________________________________________________________________________________________________________________________________________________________________
Пример 1.3. Порядковый номер элемента, валентные электроны атома которого расположены на орбиталях 4s24p4, равен 1) 22 2) 32 3) 34 4) 24
Решение. В соответствии со строением внешнего энергетического уровня 4s24p4 данный элемент расположен в четвёртом периоде (заполняются четыре квантовых слоя, n = 4). На АО внешнего энергетического уровня 6 электронов, следовательно, это элемент 6 группы главной подгруппы, т.к. валентные электроны находятся в состоянии «s» и «p». В периодической системе это элемент селен, него порядковый номер 34, Для подтверждения правильности ответа напишем электронную формулу селена 34 Se 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4.
Правильный ответ: 3.
Упражнение 1.3. Порядковый номер элемента, валентные электроны атома которого расположены на орбиталях 3s23p2, равен 1) 12 2) 6 3) 14 4) 4
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 1.4. Хлорид-иону соответствует электронная конфигурация…
1) 1s22s22p63s23d6 2) 1s22s22p63s23p6 3) 1s22s22p63s23p4 4) 1s22s22p63s23р5
Решение. Электронная формула хлора 17Cl 1s22s22p63s23p5. Хлорид-ион Cl¯ имеет на один электрон больше: 1s22s22p63s23p6.
Правильный ответ 2.
Упражнение 1.4. Иону О2ˉ соответствует электронная конфигурация…
1) 1s22s22p3 2) 1s22s22p6 3) 1s22s22p0 4) 1s22s22p5
____________________________________________________________________
Пример 1.5. Частицы, обладающие одинаковым строением внешнего энергетического уровня, расположены в ряду …
1) Ar, Clˉ, Ca2+ 2) O2-, Mg2+, Ar 3) Ne, Al3+,S2- 4) Ne, Clˉ , Ca2+
Решение.
Электронная формула аргона 18 Ar 1s22s22p63s23p6
Электронная формула хлора 17Cl 1s22s22p63s23p5
Электронная формула хлорид-иона Clˉ 1s22s22p63s23p6
Электронная формула кальция 20Са 1s22s22p63s23p64s2
Электронная формула иона кальция Са2+ 1s22s22p63s23p6
Правильный ответ 1.
Упражнение 1.5. Частицы, обладающие одинаковым строением внешнего энергетического уровня, расположены в ряду …
1) Ar, Cl, Ca2+ 2) O2-, Mg2+, Ne 3) Ne, Al3+, S2- 4) Ne, Clˉ , Ca2+
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 1.6. Число неспаренных электронов в атоме брома в основном состоянии равно … 1) 7 2) 1 3) 3 4) 5
Решение. Электронная формула атома брома 35 Br 1s22s22p63s23p63d104s24p5. Состоянию электронов 4р соответствует три АО, на которых максимально может быть шесть электронов. Атом брома имеет в состоянии 4р пять электронов, следовательно, у него один неспаренный электрон:

Правильный ответ 2.
Упражнение 1.6. Число неподеленных электронных пар на валентном энергетическом уровне атома азота в основном состоянии равно … 1) 0 2) 3 3) 2 4) 1.
Ответ подтвердите, написав электронную формулу атома азота.
_____________________________________________________________________________
Пример 1.7. Формула высшего оксида элемента, электронная конфигурация атома которого 1s22s22p63s23p64s13d5, имеет вид … 1) Э2О 2) Э2О3 3) Э2О5 4) ЭО3
Решение. По числу электронов порядковый номер данного элемента «24». Это элемент хром, расположенный в шестой группе, поэтому максимальная степень окисления равна «+6» и формула высшего оксида CrO3 (ЭО3).
Упражнение 1.7. Формула водородного соединения элемента с электронной конфигурацией атома в основном состоянии 1s22s22p63s23p4 имеет вид …
1) ЭН 2) ЭН4 3) ЭН3 4) ЭН2
________________________________________________________________________________________________________________________________________________________________
Пример 1.8. Число завершенных энергетических уровней и максимальная степень окисления элемента с электронной конфигурацией 1s22s22p63s23p63d104s24р1
соответственно равно … 1) 2 и 6 2) 2 и 5 3) 3 и 3 4) 3 и 1
Решение. Порядковый номер элемента «31», это галлий, расположенный в четвёртом периоде, третьей группе, главной подгруппе. Полностью завершены у него три энергетических уровня: 1-й − 1s2, 2-й − 2s22p6, 3-й − 3s23p63d10. На внешнем уровне галлий имеет три электрона, которые может отдать, вступая в химическую связь, следовательно, максимальная степень окисления элемента равна трём.
Правильный ответ: 3.
Упражнение 1.8. Число завершенных энергетических уровней и максимальная степень окисления элемента с электронной конфигурацией 1s22s22p63s23p64s13d5
соответственно равно … 1) 2 и 6 2) 2 и 5 3) 3 и 3 4) 3 и 5
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
ТИПОВЫЕ КОНТРОЛЬНЫЕ УПРАЖНЕНИЯ
1. Квантовое число l характеризует…
1) форму электронной орбитали 2) собственный магнитный момент
3) ориентацию электронной орбитали 4) энергию электронной орбитали
2. В состоянии 5p максимально может находиться ____ электронов
1) 6 2) 10 3) 2 4) 14
3. Число завершенных энергетических уровней и максимальная степень окисления элемента с электронной конфигурацией 1s22s22p63s23p64s23d5
соответственно равно … 1) 2 и 7 2) 2 и 5 3) 3 и 5 4) 3 и 7
4. Иону Fˉ соответствует электронная конфигурация…
1) 1s22s22p3 2) 1s22s22p6 3) 1s22s22p0 4) 1s22s22p5
5. Порядковый номер элемента, валентные электроны атома которого расположены на орбиталях 4s24p2, равен … 1) 22 2) 32 3) 34 4) 24
6. Формула водородного соединения элемента с электронной конфигурацией атома в основном состоянии 1s22s22p63s23p3 имеет вид … 1) ЭН 2) ЭН4 3) ЭН3 4) ЭН2
7. Формула высшего оксида элемента, электронная конфигурация атома которого 1s22s22p63s23p64s23d5, имеет вид … 1) Э2О 2) Э2О7 3) Э2О5 4) ЭО3
8. Относительная величина электроотрицательности элементов увеличивается в ряду … □ 1) Se, S, O □ 2) B, C, N □ 3) Cl, Br, J □ 4) P, Si, Al
