
- •Часть II рабочая тетрадь
- •Введение
- •1.1. Строение атома и периодическая система
- •1. 2. Химическая связь
- •2.1. Основы химической термодинамики
- •2.2. Химическая кинетика
- •Зависимость скорости реакции от температуры
- •2.3. Химическое равновесие
- •И стехиометрические расчёты
- •Характерные реакции оснóвных оксидов
- •4.1. Общие свойства растворов
- •4.2. Равновесия в растворах электролитов
- •Ионно-молекулярные реакции в растворах электролитов
- •Методы определения рН растворов
- •Гидролиз солей
- •5.1. Окислительно-восстановительные процессы
- •5.3. Электролиз
- •5.4. Коррозия металлов
- •Защитные покрытия
- •Электрохимические методы
- •6.1. Качественный химический анализ
- •6.2. Количественный химический анализ
- •6.3. Физико-химические и физические методы анализа
- •7.1. Общие сведения и методы получения полимеров
- •7.3. Природные полимеры
- •Библиографический список
- •Заключение
1. 2. Химическая связь
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить:
· лекцию «Химическая связь» [Конспект лекций, раздел 1.2]
Цель выполнения задания
· Ознакомиться с квантово-механическими представлениями об основных типах химической связи.
· Рассмотреть механизм образования ковалентной и ионной связи.
· Научиться устанавливать тип химической связи и описывать основные химические свойства веществ.
Теоретические сведения
Химическая связь возникает при взаимодействии электронных оболочек и ядер атомов, в результате которого понижается полная энергия системы и образуются молекулы и кристаллические вещества. Различают три основных вида химической связи: ковалентная, ионная, металлическая (рис. 1.2).
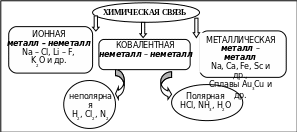
Рис. 1.2. Основные виды химической связи
Согласно методу валентных связей (МВС) ковалентная связь образуется двумя атомами за счёт двух электронов с антипараллельными спинами, т.е. она локализована между двумя атомами. Общая электронная пара может образоваться в результате взаимодействия двух атомов, имеющих непарные электроны с антипараллельными спинами (обменный механизм) или одного атома, имеющего неподелённую электронную пару и другого атома, имеющего свободную атомную орбиталь (донорно-акцепторный механизм).
В зависимости от положения области перекрывания электронных облаков различают ковалентную связь полярную и неполярную. Если область перекрывания расположена симметрично относительно ядер атомов и принадлежит им в равной степени, то такая связь называется ковалентной неполярной. Этот вид связи наблюдается, обычно, в молекулах, образованных атомами с одинаковой электроотрицательностью. Например, Н2, Сl2, F2, N2, О2 и т.д.
В молекулах, атомы которых различаются по электроотрицательности, общая электронная пара смещена с атому с бóльшей электроотрицательностью (ЭО). Такая ковалентная связь называется ковалентной полярной. Чем больше разница ЭО, тем более полярной будет химическая связь. Электроотрицательность элементов главных подгрупп 1–7 групп первых пяти периодов периодической системы приведена в табл. 1.3.
Таблица 1.3
Электроотрицательность атомов (по Полингу)
-
Период
Группы
1
2
3
4
5
6
7
I
H
2,10
II
Li
0,98
Be
1,50
B
2,00
C
2,50
N
3,07
O
3,50
F
4,00
III
Na
0,93
Mg
1,20
Al
1,60
Si
1,80
P
2,20
S
2,60
Cl
3,00
IV
K
0,91
Ca
1,04
Ga
1,80
Ge
1,80
As
2,10
Se
2,50
Br
2,80
V
Rb
0,89
Sr
0,99
In
1,50
Sn
1,80
Sb
1,80
Te
2,10
J
2,60
Большинство химических соединений можно представить образованными по ковалентному полярному типу химической связи. Вследствие смещения электронной плотности к более ЭО атому и направленности в пространстве ковалентной химической связи, молекулы, как правило, представляют собой диполи. Однако имеются молекулы, построенные по полярному типу связи, но не являющиеся диполями, например, СО2, СН4 (см. ниже).
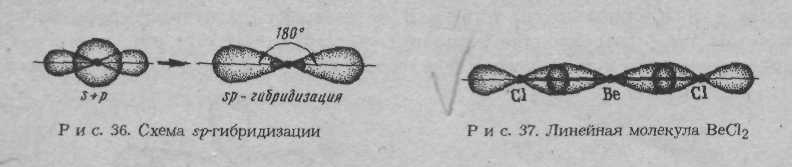
При образовании химической связи электронные облака претерпевают гибридизацию (изменение формы) и располагаются в пространстве таким образом, чтобы быть равноудалёнными друг от друга (рис 1.3).
sp2 − гибридизация sp3 − гибридизация
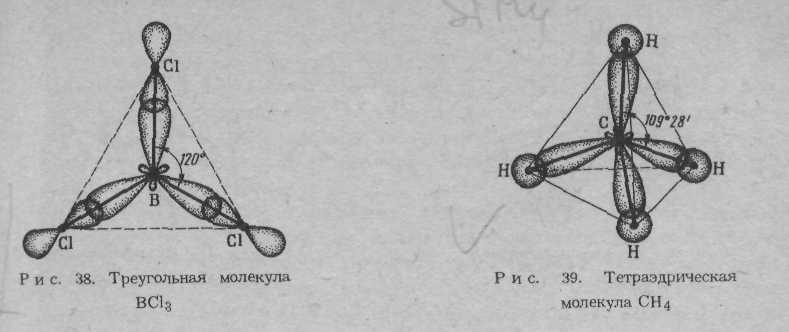
Рис. 1.3. Схема пространственной конфигурации молекул: линейная (при sp − гибридизации), треугольная (при sp2 − гибридизации), тетраэдрическая (при sp3 − гибридизации)
В соответствии с sp- гибридизацией молекула BeCl2 (аналогично и СО2) линейна, т.к. смещение электронных облаков от бериллия к хлору и от углерода к кислороду направлено под углом 180 0 в противоположную сторону и молекула будет неполярной при наличии полярной связи.
Также неполярны молекулы при sp3- гибридизации ( в нашем случае CН4), т.к. геометрическое сложение векторов химических связей С −Н, направленных к вершинам пространственного тетраэдра, приводит к нулевому результату.
Пространственная конфигурация молекул определяется числом атомов в молекуле и направленностью химической связи. Если в молекуле больше двух атомов, то в зависимости от типа гибридизации АО центрального атома, угол под которым направлены химические связи к другим атомам принимает величину близкую к значениям, указанным в табл. 1.4. Если одна или несколько гибридных орбиталей заняты неподелёнными парами электронов, то пространственная конфигурация молекул может меняться.
Таблица 1.4
Пространственная конфигурация некоторых соединений
Тип гибридизации центрального атома |
Угол между связями, град |
Наличие несвязывающих электронных пар |
Конфигурация молекулы |
Примеры соединений |
sp |
180 |
− |
линейная |
ZnCl2, CaCl2, BeCl2, CO2, С2Н2 |
sp2 |
120 |
− |
треугольная |
BCl3, CO32‾, AlF3, С2Н4 |
sp3 |
~ 109 |
нет |
тетраэдрическая |
CH4, СCl4 |
sp3 |
108 |
1 пара |
пирамидальная |
NH3, PCl3 |
sp3 |
104,5 |
2 пары |
угловая |
H2O |
При очень большой разности ЭО у взаимодействующих атомов электронное облако химической связи максимально смещается в сторону атома с бóльшей ЭО. Электрон почти полностью переходит от одного атома к другому, в результате чего атомы превращаются в ионы. Ионная связь – результат электростатического взаимодействия противоположно заряженных ионов, она является предельным случаем ковалентной полярной связи.
Способностью наиболее легко отдавать электроны обладают атомы элементов, имеющих наименьшую энергию ионизации, а принимать электроны ─ имеющих наибольшее сродство к электрону (рис.1.1).
Наименьшей энергией ионизации обладают атомы щелочных и щелочноземельных металлов, при образовании ионной связи они будут образовывать положительно заряженные ионы, отдавая электроны. Атомы галогенов имеют наибольшее сродство к электрону, и они будут принимать электроны, образуя отрицательно заряженные ионы. Типично ионные соединения образуются при взаимодействии щелочных и щелочноземельных металлов с галогенами, например, NaCl, KF и т.п. Большинству солей присущ ионный тип связи.
Современные методы экспериментальных исследований показывают, что в кристаллах таких соединений сохраняется некоторая доля ковалентности, т.к. электроны не переходят полностью от одних атомов к другим. Поэтому принято говорить об определённой степени ионности связи в зависимости от разности в электроотрицательности взаимодействующих атомов.
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Пример 1.9. Суть обменного механизма образования ковалентной химической связи состоит …
1) в перекрывании двух свободных орбиталей двух атомов
2) в перекрывании одноэлектронных орбиталей взаимодействующих атомов
3) в перекрывании любых электронных орбиталей
4) в перекрывании двухэлектронной орбитали одного атома и свободной орбитали другого
атома
Решение. Ковалентная химическая связь двухэлектронная и двуцентровая. Согласно обменному механизму общая пара электронов (двухэлектронная) образуется двумя атомами (двуцентровая), имеющими по одному непарному электрону с антипараллельными спинами. Правильный ответ 2.
Например, так можно представить образование молекулы водорода (рис. 1.4).
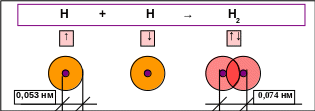
Рис. 1.4. Схема перекрывания электронных облаков при образовании молекулы водорода
Пример 1.10. Суть донорно-акцепторного механизма образования ковалентной химической связи состоит …
1) в перекрывании двух свободных орбиталей двух атомов
2) в перекрывании одноэлектронных орбиталей взаимодействующих атомов
3) в перекрывании любых электронных орбиталей
4) в перекрывании двухэлектронной орбитали одного атома и свободной орбитали другого атома
Решение. В этом случае один атом (донор) предоставляет пару электронов, а второй атом (акцептор) − свободную атомную орбиталь. Правильный ответ 4.
Типичным представителем соединения, образовавшегося по донорно-акцепторному механизму, является ион [NH4]+ (рис. 1.5).
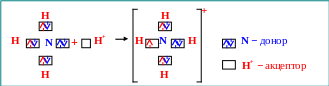
Рис. 1.5. Донорно-акцепторный механизм образования ковалентной связи в ионе [NH4]+
Упражнение 1.9. Укажите соединение, в котором реализуется связь, образованная по донорно-акцепторному механизму …
1) хлорид аммония 2) молекула хлороводорода 3) аммиак 4) молекула азота.
Ответ поясните.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Упражнение 1.10. Частицей, которая может являться акцептором электронной пары, является … 1) Fˉ 2) H+ 3) S2ˉ 4) NH3.
Ответ поясните.
________________________________________________________________________________
Пример 1.11. Только полярные молекулы представлены в ряду …
1) CO2, SO3, NH3 2) NH3, SO2, H2O 3) CCl4, NO, NO2 4) BF3, CO2, SO2
Решение. Среди приведённых молекул СО2 и CCl4 являются неполярными (см. рис. 1.3). Правильный ответ 2.
Упражнение 1.11. Валентный угол равен соответственно 180 ° и 120 ° в соединениях … (табл. 1.4)
1) NH3 и C2H4 2) C2H2 и CH4 3) ZnCl2 и C2H4 4) CH4 и H2O
______________________________________________________________________________
Упражнение 1.12. Молекулы PCl3 и NF3 имеют _______ пространственную конфигурацию...
1) угловую 2) треугольную 3) пирамидальную 4) линейную
Для пояснения используйте табл. 1.4.
_______________________________________________________________________________
Пример 1.12. Наибольшим дипольным моментом обладает молекула …
1) H2Se 2) H2O 3) H2Te 4) H2S
Решение. Все приведённые молекулы построены однотипно и имеют угловую форму с несколько отличающимся углом связи между водородом и соответствующим элементом. В целом молекулы представляют собой диполи. В ряду сходно построенных молекул дипольный момент увеличивается по мере увеличения разности ЭО атомов. В ряду элементов Te →Se → S → O электроотрицательность увеличивается (табл. 1.3), в этом же направлении увеличивается полярность молекул.
Правильный ответ 2.
Упражнение 1.13. Наибольшим дипольным моментом обладает молекула …
1) HCl 2) HF 3) HJ 4) HBr.
Ответ поясните, сравнив электроотрицательности водорода и галогенов.
________________________________________________________________________________
Упражнение1.14. Наибольшей степенью ионности характеризуется химическая связь в соединении…
1) BN 2) NH3 3) NO2 4) Li3N
Для объяснения используйте представления о механизме образования ковалентной полярной связи и относительные электроотрицательности элементов.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание 2. ОБЩИЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
