
- •Лекция 1
- •Лекция 2
- •Лекция 3 Временная организация клетки. Клеточный цикл, его периодизация. Митотический цикл. Репликация днк. Митоз. Механизм регуляции митотической активности.
- •Лекция 4
- •Лекция 5 Законы наследственности г. Менделя
- •Лекция 6
- •Лекция 7
- •Лекция 8
- •Лекция 9
- •Лекция 10
- •Лекция 11
- •Лекция 12
- •Лекция 13
- •Лекция 14
- •Лекция 15
- •Лекция 16
- •Лекция 17
- •Лекция 18
Лекция 9
Молекулярные основы наследственности. Реализация биологической информации. Трансляция (биосинтез белка). Регуляция экспрессии генов.
Трансляция (от англ. translation - перевод) - процесс синтеза белка из аминокислот на матрице и(м)РНК. При трансляции информация с языка последовательности нуклеотидов и(м)РНК переводится на язык аминокислотной последовательности белка. Матричная РНК эукариот, являясь моноцистронной, несет информацию только об одной полипептидной цепи. Биосинтез белка наиболее сложный из всех генетических процессов. У эукариот в трансляции участвует более 300 макромолекул. Это наиболее энергоемкий процесс, потребляет 90% энергии всех биосинтетических реакций в клетке.
Реакции синтеза белка протекают на рибосомах. Рибосома представляет собой крупный мультиферментный комплекс, состоящий из молекул белков и рибосомных РНК. Каждая рибосома, а их в клетке около 10 млн., состоит из двух субъединиц - большой и малой. В эукариотических клетках приблизительно половину массы рибосом составляет РНК. Малая субъединица состоит из одной молекулы 18SрРНК, связанной приблизительно с 33 различными рибосомными белками. В большой субъединице свыше 40 различных рибосомных белков, которые связаны с тремя разными молекулами рРНК (5SрРНК, 5,8SрРНК, 28SрРНК).
Таким образом, по химичекской природе рибосома - это рибонуклеопротеид, состоящий из белков и РНК. Функционально рибосома – это молекулярная машина, протягивающая вдоль себя цепь и(м)РНК, считывающая закодированную в ней генетическую информацию и синтезирующая полипептидную цепь белка.
Роль главных агентов в процессе синтеза белка играют молекулы транспортных РНК (тРНК). Всё дело в том, что триплетный кодон и(м)РНК не может непосредственно узнавать боковые радикалы аминокислот, поскольку между ними нет стерического соответствия. Поэтому существует семейство малых молекул РНК с двойной функцией. Каждая из них ковалентно связывает определенный аминокислотный остаток и в тоже время имеет в своем составе нуклеотидный триплет, комплементарный кодону на и(м)РНК для этой аминокислоты.
Таким образом, эти молекулы обладают акцепторной и адапторной функциями. Акцепторная - способность ковалентно связываться с остатком аминокислоты, превращаясь в аминоацил-тРНК. Адапторная - способность взаимодействовать своим антикодоном с кодоном и(м)РНК, соответствующим транспортируемой аминокислоте, и обеспечивать включение этой аминокислоты на законное место в растущей цепи белка. Эти РНК были обнаружены в 1957 году и получили название транспортных РНК. Это молекулы небольшие, состоят из 70-90 нуклеотидов и, как все нуклеиновые кислоты, имеют первичную, вторичную и третичную структуру.
Вторичная структура тРНК напоминает по форме лист клевера. «Стебли» с петлями образуются в силу внутреннего спаривания азотистых оснований (рис.1).
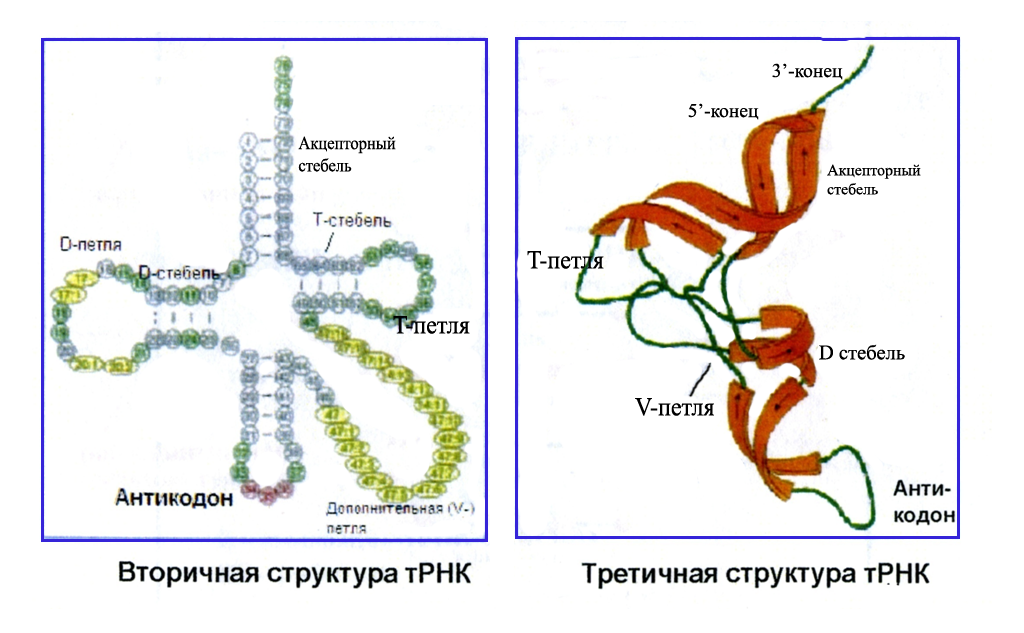
Рис. 1. Вторичная структура тРНК
Центральная петля содержит особый триплет (антикодон), который по принципу комплементарности узнает соответствующий кодон на и(м)РНК, определяя место приносимый аминокислоты. На 3`-конце молекулы тРНК имеет акцепторный участок, к которому присоединяется аминокислота. Как ранее было показано, количество смысловых кодонов на и(м)РНК для аминокислот составляет 61. Можно было ожидать, что число разных тРНК в клетке такое же. Однако установлено, что в биосинтезе белков в цитоплазме эукариотической клетки задействовано гораздо меньше тРНК (порядка 35-40). Оказалось, что антикодон одной тРНК может узнавать несколько кодонов на и(м)РНК. Это связано с тем, что третий остаток кодона (3`) не существенен для кодирования большинства аминокислот, для которых существует 2-4 кодона (исключение невырожденный код для аминокислот метионина и триптофана). В третьем положении кодона допускается и неверное спаривание (так называемое неоднозначное соответствие). Поэтому тРНК может узнавать более одного кодона вследствие образования неканонических пар между первым нуклеотидом антикодона и третьим нуклеотидом кодона. Например, У взаимодействует в кодоне не только с А (канонический вариант), но и с Г, а Г не только с Ц (канонический вариант), но и с У. Таким образом, один и тот же антикодон 3`-ЦГГ-5` взаимодействует с кодонами 5`-ГЦУ-3` и 5`-ГЦЦ-3`. Оба названных кодона соответствуют аминокислоте аланин. Этим объясняется, почему многие альтернативные кодоны аминокислот различаются лишь по своему третьему нуклеотиду.
Каким образом тРНК узнает «свою» аминокислоту? Существует специальный набор ферментов аминоацил-тРНК-синтетаз, которые присоединяют аминокислоты к соответствующим молекулам тРНК с образованием аминоацил-тРНК. Для каждой из аминокислот имеется своя особая синтетаза.
Присоединяясь к молекуле тРНК своим карбоксильным концом, аминокислоты активируются, переходят в богатую энергией форму (за счет АТФ), способную спонтанно образовывать пептидную связь, что и приводит к синтезу полипептидов.
Таким образом, молекулы тРНК играют роль конечных «адапторов», переводящих информацию, заключенную в нуклеотидной последовательности и(м)РНК, на язык аминокислотной последовательности белка. Однако не менее важную роль играет в процессе декодирования также и второй набор специфических адапторов - молекул аминоацил-тРНК-синтетаз.
Как и при других реакциях матричного синтеза при трансляции выделяют 3 стадии: инициацию, элонгацию и терминацию. Процесс инициации слагается из ряда этапов, катализируемых белками, которые носят название факторов инициации. Инициация начинается после диссоциации рибосомы на малую и большую субъединицы. Малая субъединица рибосомы принимает участие в формировании инициаторного комплекса, состоящего из малой субъединицы, и(м)РНК и инициаторной метионил-тРНК, несущей первую аминокислоту метионин. Малая субъединица связывает и(м)РНК, узнавая кэп, и нагружается инициаторной тРНК. Субъединица рибосомы присоединяется к тому участку и(м)РНК, где должен начаться синтез полипептидной цепи, путем спаривания антикодона инициаторной тРНК со старт-кодоном АУГ на и(м)РНК. Обеспечивая взаимодействие кодона и(м)РНК с антикодоном специальной инициаторной метионил-тРНК, малая субчастица рибосомы задает рамку считывания. После присоединения большой субъединицы рибосомы образуется готовая функциональная единица для синтеза белка. Другие аминоацил-тРНК связываются только с полной рибосомой. Инициаторная метионин-тРНК попадает в П-участок рибосомы и участвует в образовании первой пептидной связи (-СО-NН-) со второй аминокислотой.
В полной рибосоме имеется два разных участка, связывающих молекулы тРНК. Один из них удерживает молекулу тРНК, присоединенную к растущему концу полипептида. Поэтому он называется пептидил-тРНК-связывающим участком или П-участком. Второй служит для удержания только что прибывшей молекулы тРНК, нагруженной аминокислотой. Его называют аминоацил-тРНК-связывающим участком или А-участком (рис. 2).

Рис. 2. П- и А-участки рибосомы
К обоим участкам молекула тРНК прочно прикрепляется лишь в том случае, если ее антикодон спаривается с комплементарным ему кодоном и(м)РНК. А- и П- участки располагаются так близко друг к другу, что две связанные с ними молекулы тРНК спариваются с двумя соседними кодонами в молекуле и(м)РНК.
Процесс наращивания (элонгации) полипептидной цепи на рибосоме может рассматриваться как цикл, слагающийся из трех отдельных этапов: узнавание кодона, образование пептидной связи, транслокация. На первом этапе очередная молекула аминоацил-тРНК связывается со свободным А-участком рибосомы, примыкающим к занятому П-участку. Связывание осуществляется путем спаривания нуклеотидов антикодона с тремя нуклеотидами и(м)РНК, находящимися в А-участке. На втором этапе карбоксильный конец полипептидной цепи отделяется в П-участке от молекулы тРНК и образует пептидную связь со свободной аминогруппой аминокислоты, присоединенной к молекуле тРНК в А - участке. Эта реакция катализируется пептидилтрансферазой – ферментом, прочно связанным с рибосомой и формирующей с ней пептидилтрансферазный центр (ПТФ-центр). На третьем этапе новая пептидил-тРНК переносится в П-участок рибосомы, в то время как рибосома продвигается вдоль молекулы и(м)РНК ровно на три нуклеотида (на один кодон). Процесс транслокации, составляющий третий этап, включает в себя и возвращение свободной молекулы тРНК, отделившейся от полипептидной цепи в П-участке, в цитоплазматический пул тРНК. После завершения третьего этапа незанятый А-участок может принять новую молекулу тРНК, нагруженную очередной аминокислотой, и цикл повторяется вновь.
Элонгация продолжается до тех пор, пока в А-участке рибосомы не окажется терминирующий кодон и(м)РНК - УАА, УАГ или УГА. В природе не существует тРНК, антикодоны которых узнавали бы эти триплеты. Указанные терминирующие кодоны узнают факторы терминации и связываются с ними. После этого происходит гидролиз связи между тРНК и полипептидом с участием ПТФ-центра рибосомы и выход полипептида. Покидают рибосому тРНК, и(м)РНК и «пустая» рибосома легко диссоциирует на субъединицы, которые поступают в цитоплазму и повторно могут использоваться в синтезе белка.
Матричная РНК может быть ассоциирована со многими рибосомами, которые ее одновременно транслируют. При этом образуется полисома или полирибосома. Каждая рибосома полисомы самостоятельно ведет синтез полипептидной цепи. При интенсивном синтезе белка рибосомы в полирибосоме могут находиться вплотную друг к другу и каждую секунду происходит соскакивание одной рибосомы у 3`-конца и(м)РНК и посадка другой рибосомы на 5`-конце и(м)РНК (рис. 3). При полирибосомном белковом синтезе повышается производительность процесса биосинтеза белка.
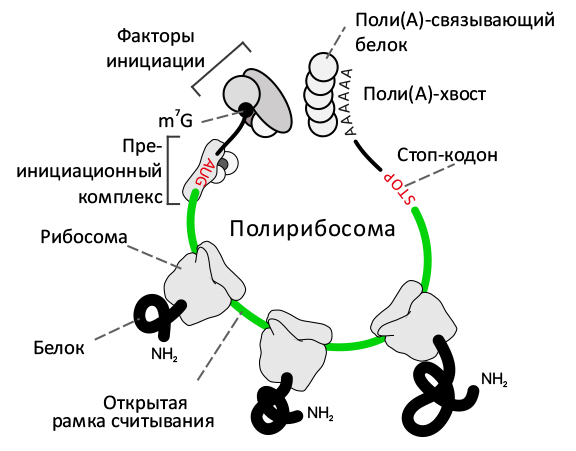
Рис. 3. Полирибосома
Посттрансляционные изменения белка
Ко-трансляционно (во время самой трансляции) и по окончанию синтеза полипептидной цепи белок принимает характерную для его функционирования пространственную структуру и с ним могут происходить следующие наиболее частые модификации:
- отщепление инициирующего метионина;
- образование дисульфидных связей;
- гликозилирование (присоединение углеводного компонента);
- фосфорилирование (присоединение фосфатных групп);
- метилирование (присоединение метильного радикала);
- отщепление фрагментов.
Регуляция экспрессии генов
Изучение механизмов регуляции экспрессии генов у эукариот является одним из наиболее интенсивно развивающихся направлений современной генетики. Первые представления о регуляции генной активности появились в самом начале 70-х годов прошлого столетия. Они касались только прокариотической клетки, которая организована гораздо проще эукариотической. Впервые модель регуляции активности генов была предложена в 1961 г. двумя французскими учеными Франсуа Жакобом и Жаном Моно. В 1965 г. за эти работы они были удостоены Нобелевской премии по физиологии и медицине.
Эти ученые исследовали регуляцию активности генов (цистронов) лактозного оперона бактерии кишечной палочки (рис. 4).

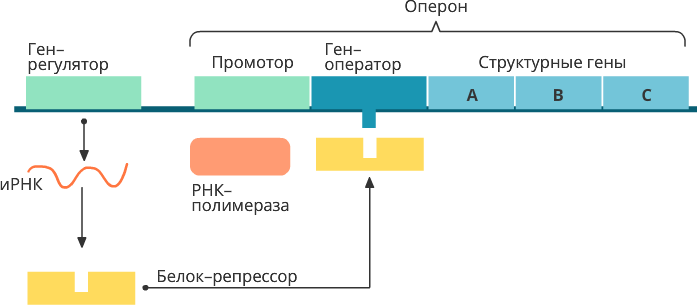
Рис. 4. Схема регуляции lac-оперона
Оперон - группа тесно сцепленных генов, находящихся под контролем общего промотора и общего оператора и транскрибируемых как единая мРНК. Синтезируемая на оперонах бактерий мРНК является полицистронной и может быть использована для синтеза нескольких белков. Лактозный оперон (lac-оперон) кишечной палочки, дающий бактерии возможность утилизировать лактозу (молочный сахар), имеет три цистрона (гена), которые принимают участие в утилизации лактозы и находятся под контролем общего промотора (А, В, С). Последовательность промотора перекрывается с еще одной регуляторной последовательностью - оператором. За пределами оперона находится ген-регулятор, который обеспечивает синтез белка-репрессора. В отсутствие поступления в бактериальную клетку лактозы белок-репрессор связывается с оператором и через промотор блокирует транскрипцию. Синтеза мРНК не будет, не будет трансляции и образования белков-ферментов, расщепляющих лактозу. При появлении в среде лактозы она, выполняя роль индуктора, взаимодействует с белком-репрессором, освобождается при этом оператор, активируется промотор и, как следствие, РНК-полимераза транскрибирует структурные гены. На матрице мРНК будут синтезироваться белки-ферменты участвующие в расщеплении лактозы в клетке. Такую регуляцию активности генов следует отнести к регуляции на уровне инициации транскрипции.
В эукариотических клетках много механизмов, которые могут приостановить работу гена, замедлить или, напротив, активировать его функцию. Механизмы регуляции экспрессии генов эукариот весьма многообразны, функционируют на всех этапах реализации генетической информации. Можно выделить несколько уровней функционирования регуляторных механизмов у эукариот.
Регуляция экспрессии генов на уровне инициации транскрипции. Регуляция инициации транскрипции - один из основных механизмов регуляции активности генов эукариот. В регуляции на уровне инициации транскрипции принимает участие ряд регуляторных нуклеотидных последовательностей ДНК:
- прежде всего, это расположенные близко от кодирующих последовательностей гена промоторы. Промоторы связывают РНК-полимеразу, факторы транскрипции и запускают синтез РНК;
- энхансеры (усилители) - дополнительные регуляторные элементы (последовательности ДНК), которые увеличивают эффективность транскрипции гена в десятки и сотни раз. Характерными свойствами энхансера является его способность осуществлять регуляторное действие на промотор на больших расстояниях от него (более 1000 п.н.) и независимо от расположения относительно регулируемого гена. Их функционирование основано на связывании с специфическими белками-регуляторами, которые взаимодействуют с транскрипционными факторами и, таким образом, усиливают инициацию транскрипции;
- сайленсеры (глушители) - регуляторные элементы (последовательности ДНК), которые ингибируют транскрипцию генов эукариот. Сайленсеры действуют на промоторы, расположенные также на большом расстоянии, связываясь с регуляторными белками, осуществляют негативную регуляцию транскрипции;
- инсуляторы - последовательности ДНК, расположенные между промоторами и энхансерами, которые блокируют действие энхансеров на соседние гены.
Важную роль в регуляции транскрипции играют транскрипционные факторы, которые представлены регуляторными белками. Согласно базе данных TRANSFAC известно более 2785 факторов транскрипции. Выделяют группу общих транскрипционных факторов (базовые) и группу специфических транскрипционных факторов. Базовые транскрипционные факторы связываются с «ТАТА» последовательностью промотора, необходимого для функционирования РНК-полимеразы II и, следовательно, запуска транскрипции. Функции специфических факторов транскрипции состоят в активации промоторов различных генов.
Регуляция экспрессии генов на уровне процессинга пре-и(м)РНК и транспорта транскрипта и(м)РНК из ядра.
На уровне процессинга регуляция функциональных генов связана с альтернативным сплайсингом. При альернативном сплайсинге образуются различные формы и(м)РНК из одного и того же гена и, как результат, образование разных белков. Пока неизвестно, каким образом происходит отбор конкретных РНК, подлежащих участию в трансляции. Однако можно считать это одним из механизмов регуляции активности генов.
Регуляторные механизмы экспрессии генов на уровне трансляции.
Это подавление трансляции и(м)РНК в результате связывания с ней малых некодирующих РНК: малых интерферирующих РНК (миРНК) и микроРНК (мкРНК). Регуляторные малые интерферирующие РНК- это двухцепочечные РНК длиной 19-25 п.н., которые вызывают деградацию и(м)РНК. Они дают сигнал ферментам (эндонуклеазам), которые разрушают молекулу и(м)РНК и таким образом блокируют трансляцию, а значит, блокируют работу генов. РНК-интерференция обнаружена у большинства эукариотических организмов, включая человека.
МикроРНК - одноцепочечные РНК длиной 18-24 нуклеотида, кодирующие специальными генами. Они связываются с и(м)РНК мишенью и при полной комплементарности и(м)РНК разрушают ее путем разрезания эндонуклеазами. При неполной комплементарности (чаще!) мкРНК подавляет трансляцию и(м)РНК, и(м)РНК при этом переносится в цитоплазматические структуры и там хранится.
Кроме того, выделяют позитивную и негативную регуляцию на уровне трансляции:
- позитивная регуляция на основе сродства и(м)РНК с факторами инициации, факторы инициации (специфические белки) катализируют образование инициаторного комплекса;
- негативная регуляция с помощью белков-репрессоров, которые, связываясь с и(м)РНК, блокируют инициацию трансляции.
Посттрансляционные механизмы регуляции
- сборка белка (фолдинг) - процесс, при котором белок принимает характерную для его функционирования пространственную структуру;
- отщепление фрагментов;
- химическая модификация (ацетилирование, фосфорилирование, гликозилирование и др.);
- достижение места своего функционирования.
