
- •Лекция 1
- •Лекция 2
- •Лекция 3 Временная организация клетки. Клеточный цикл, его периодизация. Митотический цикл. Репликация днк. Митоз. Механизм регуляции митотической активности.
- •Лекция 4
- •Лекция 5 Законы наследственности г. Менделя
- •Лекция 6
- •Лекция 7
- •Лекция 8
- •Лекция 9
- •Лекция 10
- •Лекция 11
- •Лекция 12
- •Лекция 13
- •Лекция 14
- •Лекция 15
- •Лекция 16
- •Лекция 17
- •Лекция 18
Лекция 14
Человек как специфический объект генетического анализа. Методы изучения наследственности человека. Пренатальная диагностика наследственных болезней.
Развитие современной медицины характеризуется все более возрастающим изучением человека как генетического объекта, что связано с рядом причин. Во-первых, по мере накопления знаний о закономерностях индивидуального развития организма человека стало ясным, что процессы развития представляют реализацию генетической программы, унаследованной от родителей через половые клетки. Во-вторых, существует большое число генетически обусловленных заболеваний человека, которые касаются всех органов, систем и функций организма. Наследственные заболевания составляют все большую долю в общей патологии человека. В-третьих, имеет существенное значение наследственная предрасположенность в возникновении многих болезней человека, которые прямо не детерминированы наследственностью. В связи со сказанным очевидно возрастающее значение генетики для медицины.
В то же время человек оказался весьма трудным объектом с точки зрения изучения его генетики. Многие методы классической генетики для изучения человека оказались не применимы. Например, у человека нельзя использовать гибридологический метод. Вступление в брак мужчин и женщин совершенно случайное явление, подбирать родительские пары нельзя. У людей низкая плодовитость и медленная сменяемость поколений, что затрудняет наблюдение и использование статистического метода для расчета наследования признака в поколениях. Трудности связаны с большим генетическим разнообразием человека, что обусловлено большим числом хромосом в кариотипе и большим числом генов. Наконец, на людях нельзя ставить эксперименты.
С другой стороны, человек как биологическое существо подчиняется тем же законам наследственности, что и другие организмы. Более того, моногенно обусловленные нормальные признаки и патологические состояния наследуются в соответствии с законами Г. Менделя. Несмотря на особенности человека как генетического объекта в настоящее время разработан целый спектр методов, позволяющих изучать проявления генетики человека в соответствующий фенотип. Основными методами при изучении генетики человека являются:
- генеалогический;
- близнецовый;
- цитогенетические;
- молекулярно-цитогенетические;
- биохимические;
- молекулярно-генетические;
- метод генетики соматических клеток;
- дерматоглифический;
- популяционно-статистический.
Генеалогический метод
Наиболее универсальным методом исследования наследственности человека является генеалогический метод. Этот метод широко используется в медицинской генетике. Он применяется для решения теоретических и практических задач:
- установления наследственного характера признака;
- для определения типа наследования и пенетрантности изучаемого гена;
- при анализе сцепления генов и картировании хромосом;
- при изучении интенсивности мутационного процесса;
- при расшифровке механизмов взаимодействия генов;
- при медико-генетическом консультировании.
Генеалогический метод – это метод родословных, который предусматривает прослеживание признака в семье или роду с указанием типа родоственных связей между членами родословной. Сбор сведений о семье начинается с пробанда. Пробанд – это лицо, которое первым попало в поле зрения исследователя (врача). Это может быть носитель изучаемого признака или больной человек; но не обязательно. Дети одной родительской пары называются сибсами (братья и сестры). Братья и сестры от другого брака одного из родителей – полусибсы. Обычно родословная собирается по одному или по нескольким признакам. Составление родословной сопровождают краткой записью о каждом члене родословной с точной характеристикой его родства по отношению к пробанду (легенда родословной). Для наглядности родословную изображают графически, используя соответствующие стандартные символы (рис. 1 )
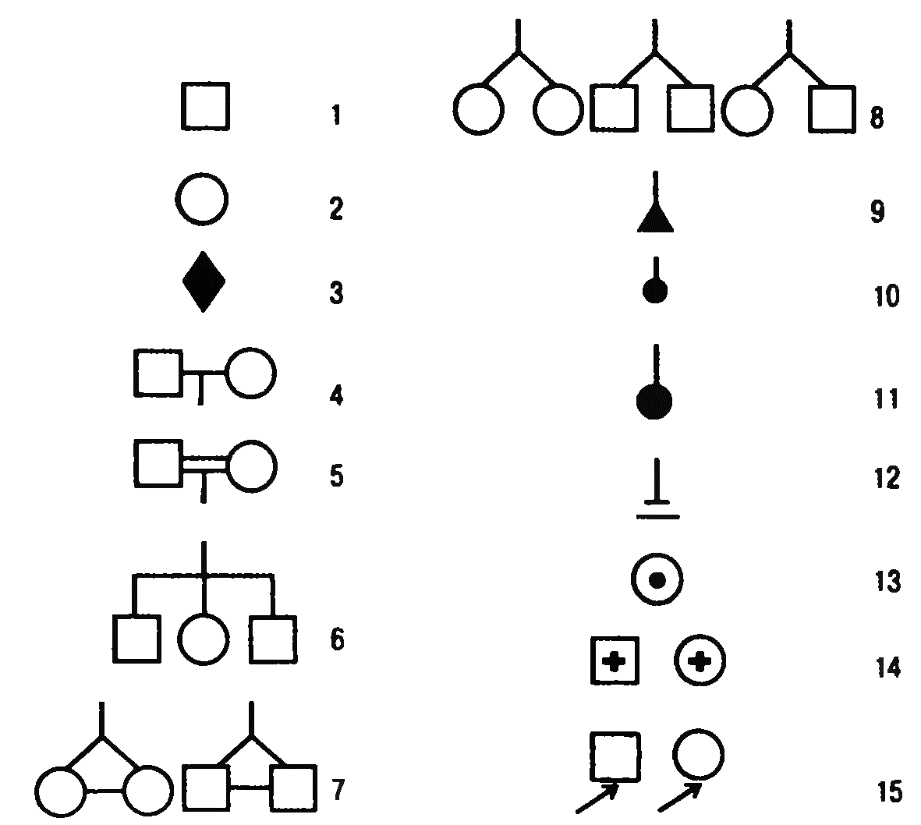
Рис. 1. Символы, используемые при составлении родословных
1 – лицо мужского пола; 2 – лицо женского пола; 3 – пол неизвестен; 4 – брак; 5 – кровнородственный брак; 6 – сибсы; 7 – монозиготные близнецы; 8 – дизиготные близнецы; 9 – выкидыш; 10 – аборт; 11 – мертворождённый; 12 – бездетный брак; 13 – гетерозиготная носительница мутантного гена; 14 – умершие; 15 – пробанд.
Поколения в родословной обозначают римскими цифрами сверху вниз. Обычно цифры ставят слева от родословной. Арабскими цифрами нумеруют потомство одного поколения слева направо последовательно. Братья и сестры располагаются в родословной в порядке рождения. Таким образом, каждый член родословной имеет свой шифр, например, II-2, III-8.
Первая задача при анализе родословной – установление наследственного характера признака. Если в родословной один и тот же признак повторяется несколько раз, то надо думать о его наследственной природе. Однако при этом надо исключить возможность фенокопии. Например, если на женщину во время всех беременностей действовал патогенный фактор, то у такой женщины могут родиться несколько детей с одинаковыми врожденными пороками. После установления наследственного характера признака устанавливается тип наследования. Выделяют пять типов наследования признаков:
- аутосомно-доминантный;
- аутосомно-рецессивный;
- Х-сцепленный доминантный;
- Х-сцепленный рецессивный;
- Y-сцепленный.
Аутосомно-доминантный тип наследования. Этот тип наследования характеризуется:
- признак проявляется в каждом поколении (передача признака по вертикали);
- признак проявляется в одинаковой степени у мужского и женского пола;
- один из родителей ребенка, имеющего признак, как правило имеет такой же признак;
- мутантный ген проявляется в гетерозиготном состоянии;
- признак проявляется у ½ потомства пораженного гетерозиготного родителя (рис. 2).

Рис. 2. Родословная с аутосомно-доминантным типом наследования
Аутосомно-рецессивный тип наследования. Для этого типа наследования характерно:
- признак проявляется по горизонтали, не в каждом поколении;
- признак проявляется в одинаковой степени у мужского и женского пола;
- мутантный ген проявляется только в гомозиготном состоянии;
- вероятность проявления признака у гетерозиготных родителей равна ¼;
- вероятность проявления признака возрастает при кровном родстве (рис. 3).

Рис. 3. Родословная с аутосомно-рецессивным типом наследования
Х-сцепленный доминантный тип наследования. Этот тип наследования характеризуется:
- признак проявляется у мужчин и женщин;
- признак проявляется по горизонтали и вертикали;
- отец передает свой признак дочерям (100%);
- признак никогда не передается от отца к сыну;
- один из родителей ребенка, имеющего признак, имеет этот признак (рис. 4).
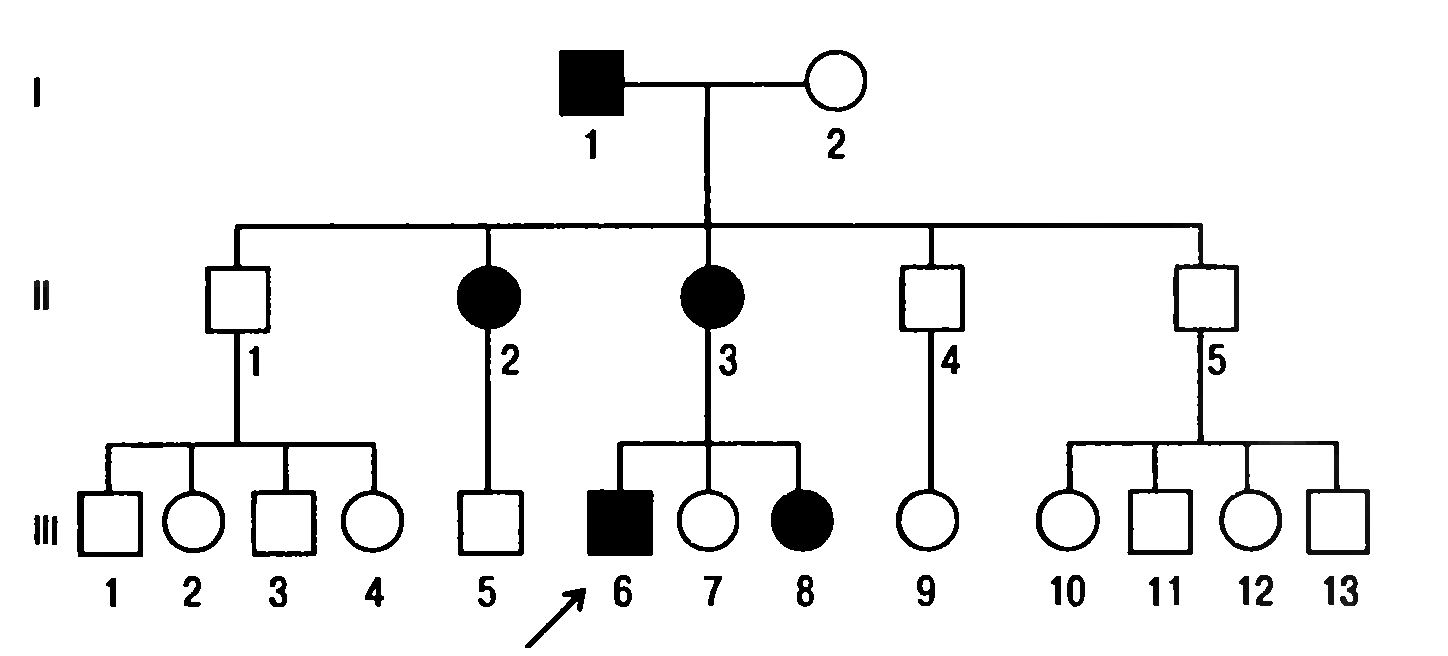
Рис. 4. Родословная с Х-сцепленным доминантным типом наследования
Х-сцепленный рецессивный тип наследования. Признаки Х-сцепленного типа наследования:
- преимущественно признак имеют лица мужского пола;
- признак передается от матери-носительницы сыновьям;
- отсутствует передача признака от отца к сыну;
- женщина-носительница передает ген в 50% случаев сыновьям (они имеют признак) и в 50% дочерям (они носительницы) (рис. 5).
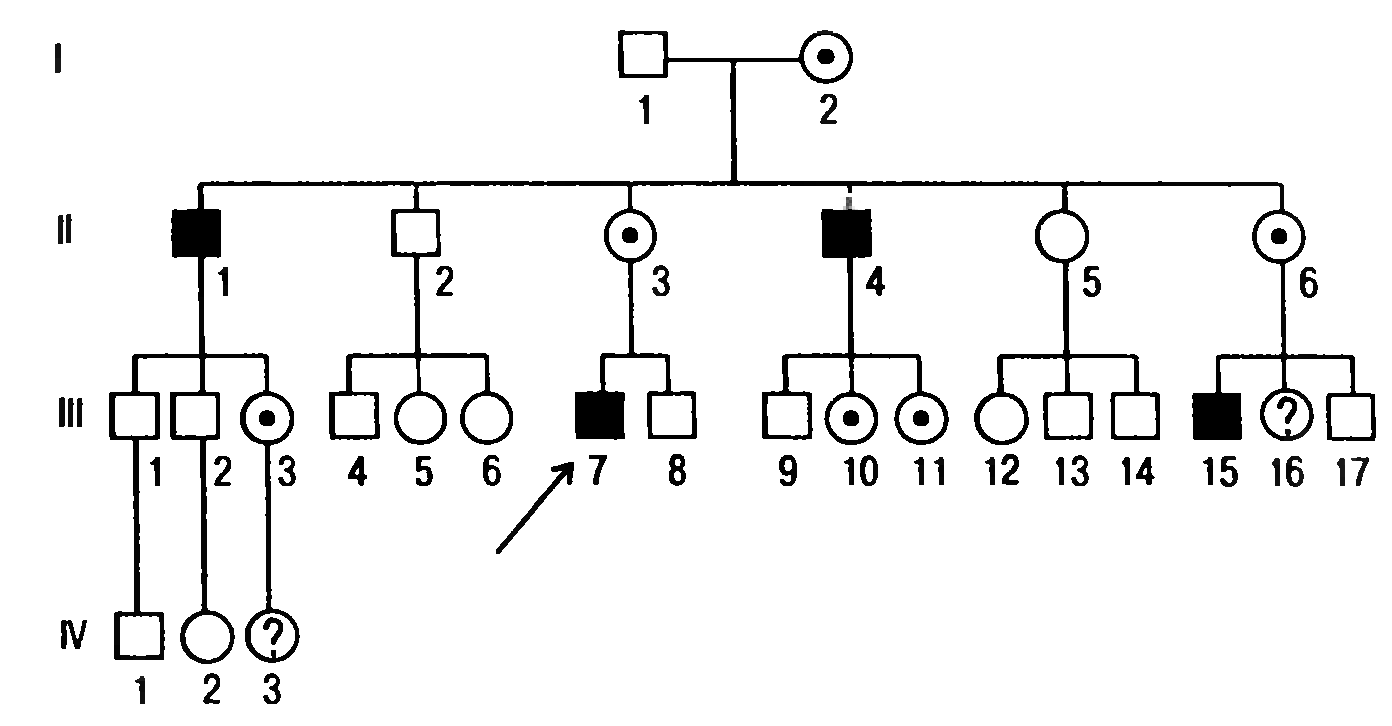
Рис. 5. Родословная с Х-сцепленным рецессивным типом наследования
Y-сцепленный тип наследования (голандрический тип). Признаки, гены которых локализованы в Y-хромосоме, передаются от отца всем мальчикам (рис. 6).
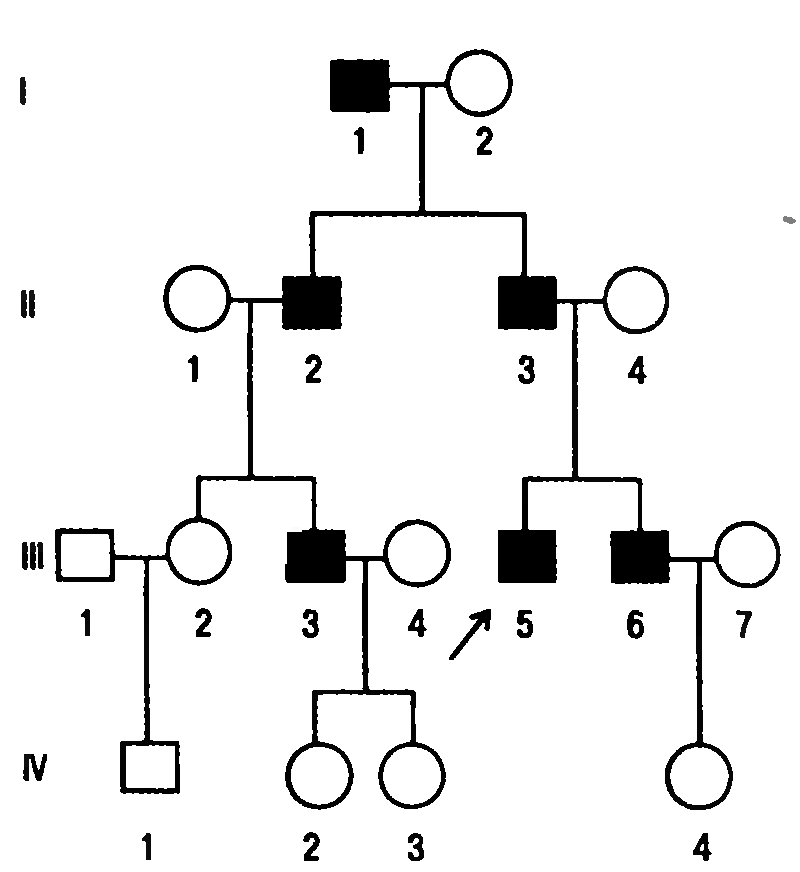
Рис. 6. Родословная с Y-сцепленным типом наследования
Близнецовый метод
Близнецовый метод заключается в изучении закономерностей наследования признаков у близнецов. Причины и условия возникновения многоплодной беременности окончательно не выявлены. Можно говорить о наследственной предрасположенности к данному явлению, которая передается со стороны матери. Близнецы бывают монозиготными (однояйцевыми) и дизиготными (двуяйцевыми). Дизиготные близнецы рождаются в результате одновременного созревания, оплодотворения и развития двух и более яйцеклеток. По генотипу и наследственным свойствам дизиготные близнецы сходны не более, чем братья и сестры, родившиеся в разное время. В противоположность этому монозиготные близнецы развиваются из одной оплодотворенной яйцеклетки, которая при первом делении зиготы дает начало развитию двух самостоятельных индивидов. Поэтому их генотипы идентичны, они всегда одного пола и если у них возникает различие признаков, то оно целиком связано с влиянием факторов внешней среды.
Трудности близнецового метода связаны, во-первых, с относительно низкой частотой рождения близнецов в популяции (1:86-1:88), что осложняет подбор достаточного количества пар с данным признаком; во-вторых, с идентификацией монозиготности близнецов, что имеет большое значение для получения достоверных выводов. При анализе близнецов сначала необходимо определить их зиготность. Определение зиготности проводят путем сравнения у близнецов внешних признаков (форма носа, губ, ушей, ногтей; пальцевые узоры; пигментация волос, глаз, кожи), по наследованию групповой принадлежности крови по разным системам (АВО, Rh-фактору и др.), по иммунологическим показателям.
Близнецовость – удобный естественный эксперимент, позволяющий оценить роль эндогенного (генетического) и экзогенного (средового) факторов в детерминации нормальных и патологических признаков у человека, в том числе выяснить удельный вес наследственного фактора в возникновении многих заболеваний. Этот метод позволяет выявить наследственный характер признака, определить пенетрантность аллеля, оценить эффективность действия на организм некоторых внешних факторов (лекарстьвенных препаратов, обучения, воспитания). В процессе обследования близнецов учитывается совпадение (конкордантность) и различия (дискордантность) по ряду нормальных и патологических признаков. Если какой-то признак встречается у обоих близнецов данной пары, то такую пару называют конкордантной по данному признаку. Если признак встречается у одного из пары - дискордантная пара. Высокая степень конкордантности признака свидетельствует о его наследственной обусловленности.
При использовании близнецового метода проводят сравнение трех групп близнецов: двуяйцевых в одинаковых условиях жизни, однояйцевых близнецов в одинаковых условиях и однояйцевых близнецов в разных условиях среды. Монозиготные близнецы, развивающиеся из одной оплодотворенной яйцеклетки, генетически идентичны, так как имеют 100% общих генов. Поэтому среди монозиготных близнецов наблюдается высокий процент конкордантных пар, у которых признаки развиваются у обоих близнецов. Сравнение монозиготных близнецов, воспитывающихся в разных условиях постэмбрионального периода, позволяет выявить признаки, в формировании которых существенная роль принадлежит факторам среды. По этим признакам между близнецами наблюдается дискордантность, т.е. различия. Напротив, сохранение сходства между монозиготными близнецами, несмотря на различия условий их существования, свидетельствует о наследственной обусловленности признака.
Сопоставление парной конкордантности по данному признаку у генетически идентичных монозиготных и дизиготных близнецов, которые имеют в среднем около 50% общих генов, дает возможность более объективно судить о роли генотипа в формировании признака. Высокая конкордантность в парах монозиготных близнецов и существенно более низкая конкордантность в паре дизиготных близнецов свидетельствует о значении наследственных различий в этих парах для определения признака. Сходство показателя конкордантности у моно- и дизиготных близнецов свидетельствует о незначительной роли генетических различий и определяющей роли среды в формировании признака или развития заболевания. Достоверно различающиеся, но достаточно низкие показатели конкордантности в обеих группах близнецов дают возможность судить о наследственной предрасположенности к формированию признака, развивающегося под действием факторов среды.
Установление соотносительной роли наследственности и среды в развитии различных патологических состояний позволяет врачу правильно оценивать ситуацию и проводить профилактические мероприятия при наследственной предрасположенности к заболеванию или осуществлять вспомогательную терапию при его наследственной обусловленности.
Цитогенетические методы
Цитогенетические методы предназначены для изучения структуры хромосомного набора и отдельных хромосом. Для этого используются световая микроскопия (главным образом в проходящем свете), включая люминесцентную микроскопию. Большинство цитогенетических исследований выполняется на делящихся соматических клетках. С этой целью могут использоваться клетки разных тканей, но наиболее удобным объектом для медицинских генетиков оказалась культура лимфоцитов периферической крови (рис. 7). Для ее получения берут 1-2 мл венозной крови, помещают в питательную среду с митогеном (фитогемагглютинином) для запуска деления клетки. После культивирования в течение 48-72 часов в среду добавляют колхицин, который разрушает веретено деления и останавливает клеточное деление на стадии метафазы. Используя специальные реагенты, из суспензии клеток выделяют метафазные хромосомы, которые наносят на чистое предметное стекло. На стекле хромосомы расправляются и формируется метафазная пластинка, в пределах которой располагаются отдельные хромосомы. После фиксации и высыхания препарата проводят его окраску, используя различные красители. Наиболее распространенный метод окраски по Гимзе (простая окраска). Краситель Гимзы окрашивает все хромосомы равномерно по всей длине, при этом контурируются центромера, спутники и вторичные перетяжки. Простая окраска используется в основном для определения числовых аномалий кариотипа, но этот тип окраски позволяет выявлять и явные структурные аномалии хромосом (делеции, транслокации, инверсии).

Рис. 7. Методика приготовления цитогенетических препаратов путем культивирования лимфоцитов периферической крови
Однако хромосомные аберрации идентифицируются, как правило, с применением дифференциального окрашивания, которое позволяет выявить даже незначительные изменения в структуре хромосом. Метод основан на химической неоднородности хромосом по длине и избирательному включению флюоресцирующих красителей в отдельные участки хромосомы. При этом выявляется структурная дифференцировка хромосом по длине, выражающаяся в виде чередования темных и светлых полос. Протяженность этих участков специфична для каждой хромосомы, соответствующего плеча и района. Каждая хромосома имеет свой рисунок исчерченности (рис. 8).

Рис. 8. Дифференциальное окрашивание хромосом
С целью определения изменения числа Х-хромосом в ядре клетки в цитогенетике применяют метод определения телец полового хроматина (телец Барра) в неделящихся клетках слизистой щеки. Тельце Барра в норме образуется в клетках гомогаметного пола (женщин) и представляет собой гетерохроматизированную Х-хромосому. Одна из двух Х-хромосом в клетках женского организма сворачивается, плотно укладывается, хорошо прокрашивается и выглядит в виде тельца у ядерной оболочки (рис. 9).
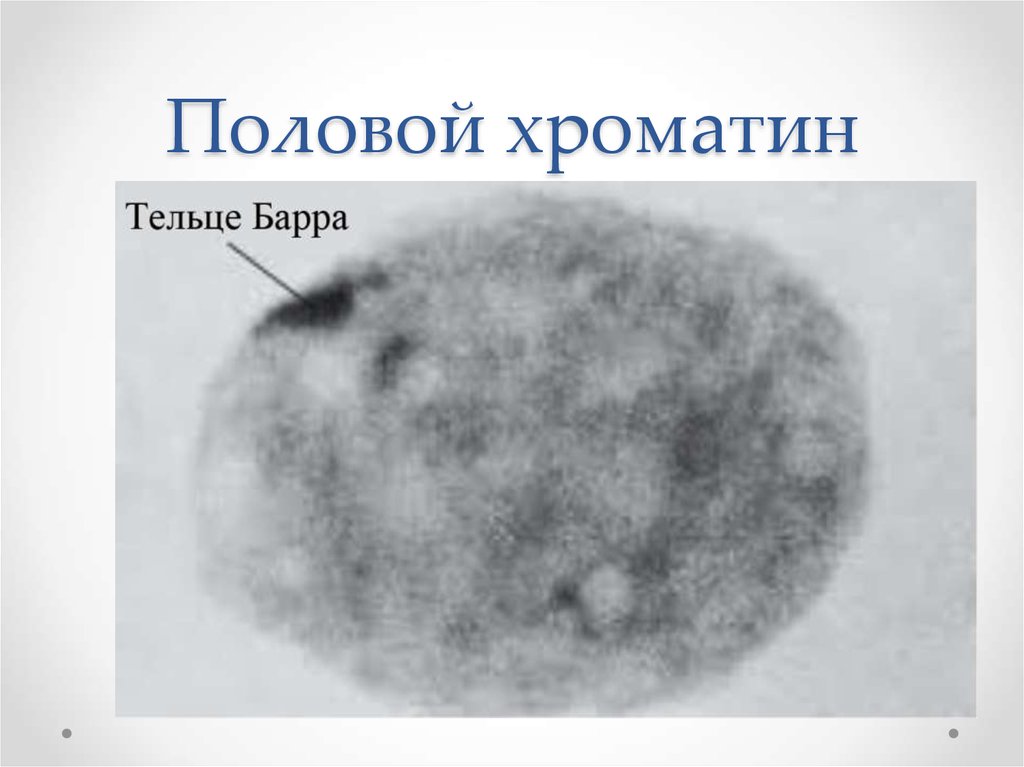
Рис. 9. Половой хроматин (тельце Барра)
Число телец Барра в ядре клетки всегда на единицу меньше числа Х-хромосом. У женщин в норме выявляется одно тельце Барра. При уменьшении числа Х-хромосом до одной (моносомия Х, кариотип 45ХО) тельце Барра в ядрах соматических клеток отсутствует.
Молекулярно-цитогенетические методы
К молекулярно-цитогенетическим методам относится метод флюоресцентной гибридизации in situ (англ. FISH-fluorescent in situ hybridization). Это метод изучения хромосом основан на гибридизации и имеет большую разрешающую способность. Принцип этого метода состоит в следующем (рис. 10).
1. Для изучаемой хромосомы или конкретного ее участка, исходя из специфичности последовательности оснований ДНК хромосомы, готовят ДНК-зонд. ДНК-зонд – это однонитевой участок ДНК с определенной последовательностью нуклеотидов к которому присоединен флюоресцентный краситель.
2. На предметное стекло помещают выделенные из клеток исследуемые хромосомы. Хромосомные препараты готовят стандартным способом из лимфоцитов периферической крови. На микроскопическом препарате in situ при щелочной обработке каждая хромосомная ДНК денатурирует, то есть разрываются связи между двумя нитями ДНК.
3. ДНК-зондом обрабатывают микроскопический препарат. Поскольку последовательность оснований ДНК-зонда и соотвествующий участок ДНК хромосомы взаимно комплементарны, то зонд присоединяется к хромосоме. Происходит гибридизация ДНК-зонда с одноцепочечной ДНК-мишенью хромосомы.
4. С помощью люминесцентного микроскопа выявляют меченые ДНК-зондом хромосомы (окрашенные) на фоне неокрашенных.
,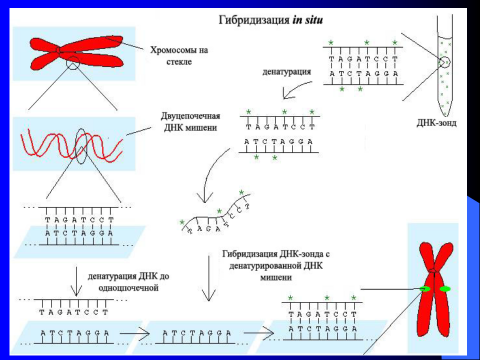
Рис. 10. FISH- метод
Метод FISH имеет широкие границы применения - от определения локализации гена до расшифровки сложных перестроек между несколькими хромосомами.
В клинической цитогенетике метод FISH занимает все большее место. В случаях сложных хромосомных перестроек, захватывающих более двух хромосом, дифференциальная окраска не всегда позволяет идентифицировать измененные участки хромосом. В этих случаях применяют уже не одноцветный, а многоцветный вариант метода FISH. Метод FISH может применяться для диагностики анеуплоидий в интерфазных ядрах (интерфазный FISH). Например, специфичный для хромосомы 21 ДНК-зонд гибридизируется с денатурированными клетками пациента на предметном стекле. Если у пациента в кариотипе две хромосомы 21, в ядре будут видны две флюоресцирующие соответствующим цветом точки. Если у больного трисомия 21, то в ядре будут видны 3 точки.
Прогрессивным молекулярно-цитогенетическим методом является метод сравнительной геномной гибридизации на микрочипах (CGH-comparative genome hybridization).
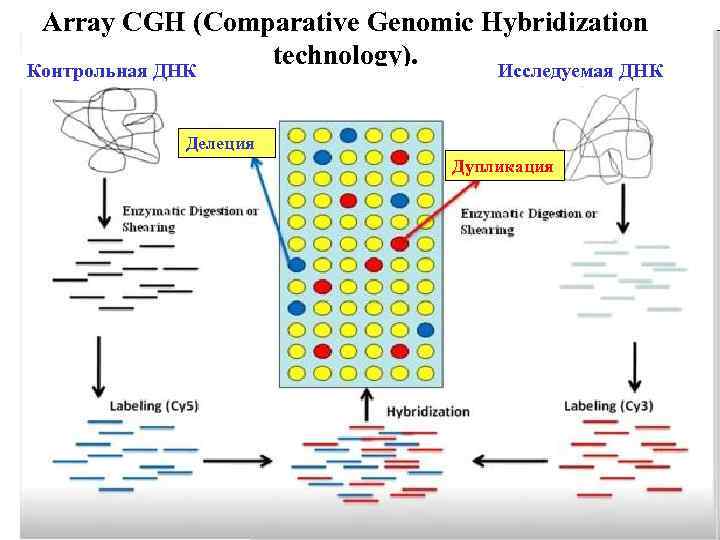
Рис. 11. Сравнительная геномная гибридизация на микрочипах
ДНК-микрочип состоит из многих тысяч коротких однонитевых зондов, которые сгруппированы в виде микроскопических точек на подложке. Каждая точка содержит ДНК-зонд с определенной нуклеотидной последовательностью. Суть метода CGH состоит в том, что из клеток пациента выделяют ДНК (опытная) и метят одним флюорохромом (зеленым). Из клеток здорового индивидуума выделяют такую же ДНК (контрольная) и метят другим флюорохромом (красным). Опытную и контрольную ДНК наносят на микрочип. Происходит конкурентная гибридизация опытной и контрольной ДНК с ДНК-зондами на микрочипе. После этого измеряют флюоресцентный сигнал (соотношение интенсивности флюоресценции между одним и другим флюорохромом) с использованием сканера для микрочипов. Соотношение интенсивности флюоресцентного сигнала исследуемой и контрольной ДНК дает информацию о копийности ДНК: зеленный цвет свидетельствует о дупликации, красный цвет – о делеции. Желтый цвет свидетельствует о том, что копийность ДНК не изменена. Анализ полученных данных проводят с использованием компьютерных программ. (рис. 11).
Метод CGH позволяет одновременно выявлять анеуплоидии, делеции, дупликации любого локуса хромосомы, представленного на микрочипе. Один анализ CGH эквивалентен 1000 FISH анализам. Это мощный метод детекции субмикроскопических хромосомных аномалий у пациентов с идиопатической умственной отсталостью и множественными врожденными пороками развития.
Биохимические методы
Это целый набор биохимических методов, позволяющих определять первичные белковые продукты генов, накопление патологических метаболитов внутри клетки и во внеклеточных жидкостях человека, которые появляются вследствие генетического блока реакций обмена. Объектом биохимических исследований для диагностики наследственных болезней, могут быть плазма и сыворотка крови, моча, пот, слюна, околоплодные воды, культура клеток (лимфоцитов, фибробластов и др). Несмотря на сложность, необходимость аппаратуры разных классов, нередко и дороговизну, биохимическим методам принадлежит важная роль в диагностике моногенных наследственных болезней.
Использование лабораторно-биохимических методов оказалось эффективным в решении диагностических задач и выявления звеньев патогенеза большой группы наследственных болезней обмена веществ. В частности обмена аминокислот (альбинизм, фенилкетонурия), углеводов (галактоземия) и др. С помощью биохимических методов выявлено у человека более 1000 наследственных заболеваний обмена веществ.
Практически во всех случаях биохимическая диагностика включает 2 уровня: первичный и уточняющий. Целью первичного уровня диагностики является исключение здоровых индивидов из дальнейшего обследования и отбор индивидов для последующего уточнения диагноза. Для этого используют 2 вида программ диагностики: массовые и селективные. В таких программах первичной диагностики в качестве объектов используется, как правило, моча и небольшое количество крови. Массовые просеивающие программы применяют для диагностики у новорожденных таких заболеваний как фенилкетонурия, врожденный гипотериоз, муковисцедоз, галактоземия. Например, для диагностики фенилкетонурии кровь новорожденных берут на 3-5 день после рождения для определения фенилаланина. Для определения врожденного гипотиреоза в крови ребенка на 3 день жизни определяют уровень тироксина.
Селективные диагностические программы предусматривают проверку биохимических аномалий обмена у пациентов с подозрением на генные наследственные болезни. В селективных программах могут использоваться простые качественные реакции (например, тест с хлоридом железа для выявления фенилкетонурии или тест с динитрофенилгидрозином для выявления кетокислот в моче) или более точные методы.
Целью уточняющего уровня является постановка диагноза заболевания с использованием более точных и сложных биохимических методов. В частности применяя методы тонкослойной хроматографии мочи и крови можно выявить более 140 наследственных болезней обмена веществ, такие как болезни углеводного обмена, лизосомальные болезни накопления, болезни обмена металлов, аминоацидопатии и т. д.
Широкое применение нашли биохимические методы в пренатальной диагностике. Применение биохимических исследований для диагностики заболеваний в пренатальном периоде или непосредственно после рождения позволяет своевременно выявить патологию и начать специфические медицинские мероприятия. Например, биохимические методы включают определение уровня альфа-фетопротеина, хорионического ганадотропина и эстриола в сыворотке крови беременной. Эти методы являются просеивающими для выявления женщин, имеющих повышенный риск рождения ребенка с наследственной болезнью.
Молекулярно-генетические методы (методы ДНК-диагностики)
Молекулярно-генетические методы предназначены для выявления вариаций в структуре исследуемого участка ДНК. Эти методы позволяют анализировать фрагменты ДНК, находить и изолировать отдельные гены и их сегменты, устанавливать в них последовательность нуклеотидов. В основе этих методов лежат «манипуляции» с ДНК. В целом ДНК-диагностика – это комплекс методов молекулярного анализа ДНК.
Несмотря на то, что молекулярно-генетические методы сложны, трудоемки и дорогостоящи, данные полученные в процессе ДНК-диагностики намного точнее и информативнее результатов других анализов. Эти методы позволяют: выявлять генные мутации, гетерозиготных носителей, проводить диагностику генных болезней.
Молекулярно-генетические методы проводят в несколько этапов, применяя при этом разные методические приемы. Начальным этапом любого молекулярно-генетического анализа является получение образцов ДНК. ДНК может быть получена из любого типа клеток, содержащих ядра, но чаще всего ДНК выделяют из лейкоцитов крови.
Во многих случаях для успешной ДНК-диагностики достаточно исследовать небольшие фрагменты генома. Выделение таких фрагментов стало возможным благодаря открытию ферментов-рестриктаз, которые разрезают молекулу ДНК на фрагменты в строго определенных местах. Применение этих ферментов дает возможность получить относительно короткие фрагменты ДНК, в которых легко можно проанализировать последовательность нуклеотидов. Для получения достаточного количества таких фрагментов после рестрикции осуществляют амплификацию (умножение) фрагментов ДНК при помощи полимеразной цепной реакции (ПЦР). Суть метода заключается в многократном копировании in vitro исследуемых фрагментов ДНК в процессе многократно повторяющихся циклов. Метод основан на тех же принципах репликации, которые происходят в клетке in vivo с участием ДНК-полимеразы.
На каждом цикле амплификации синтезированные ранее фрагменты вновь копируются ДНК-полимеразой. Благодаря такой цепной реакции происходит многократное увеличение количества специфического фрагмента ДНК, что значительно упрощает дальнейший анализ. Для проведения ПЦР есть аппараты, позволяющие автоматически синтезировать одноцепочечные фрагменты ДНК. При этом в лабораторных условиях можно получить в течение нескольких часов более миллиона копий исследуемого фрагмента ДНК.
После рестрикции и ПЦР проводят визуализацию и идентификацию фрагментов ДНК. Для этого фрагменты ДНК разделяют с помощью электрофореза в полиакриламидном геле. Фрагменты ДНК движутся в геле, помещенном в постоянное электрическое поле, от отрицательного полюса к положительному в зависимости от размеров. В результате каждый фрагмент ДНК будет занимать определенное положение в виде полосы в конкретном участке геля. Длину каждого фрагмента можно определить путем сравнения пройденного фрагментом расстояния с расстоянием, пройденным стандартным образцом ДНК с известным размером (маркер).
Для визуализации результатов гель обрабатывают этидия бромидом, который связывается с ДНК. Полосы, соответствующие фрагментам ДНК, выявляются при ультрафиолетовом облучении геля (свечение в красной области спектра).
Из-за больших размеров генома человека при обработке ДНК несколькими рестриктазами образуется так много фрагментов различной длины, что при обработке этидия бромидом не удается визуально идентифицировать отдельные фрагменты ДНК на электрофореграмме (получается равномерное окрашивание по всей длине). Поэтому для идентификации нужных фрагментов ДНК в таком геле используют метод гибридизации с мечеными радионуклидом или флюоресцентной меткой ДНК-зондами (блот-гибридизация по Саузерну). Нуклеотидная последовательность зонда должна быть комплементарна изучаемому участку геномной ДНК. Радиоактивно меченные участки выявляют ауторадиографией, а нерадиоактивные метки визуализируют с помощью флюоресценции.
При использовании рестрикции и ПЦР с последующим разделением фрагментов при помощи электрофореза можно обнаружить делеции и вставки нуклеотидов в исследуемом гене. В случае делеций образуются фрагменты меньшей длины по сравнению с нормальным геном, а в случае дупликаций – большей.
Замены нуклеотидов (оснований) в последовательности гена не изменяют длину фрагментов, поэтому их выявлять с помощью электрофореза не представляется возможным. Для выявления таких мутаций можно использовать метод полиморфизма длины рестрикционных фрагментов и секвенирование.
Сущность метода полиморфизма длины рестрикционных фрагментов заключается в следующем. Выделенную ДНК обрабатывают ферментами рестриктазами, которые разрезают ее на фрагменты в участках со строго специфической последовательностью оснований. В настоящее время известно более 500 различных типов рестриктаз. Рестриктазы узнают специфические последовательности из 4-6 нуклеотидов в двухцепочечной молекуле ДНК и разделяют ее на фрагменты в местах локализации этих последовательностей, получивших название сайты рестрикции. Наличие нуклеотидных замен в гене приводит к появлению в последовательности ДНК новых сайтов для различных рестриктаз. В результате нормальный фрагмент ДНК и фрагмент с заменой нуклеотида будут разрезаться одной рестриктазой на разное число фрагментов, отличающихся по длине. Разница в размерах длины фрагментов определяется при помощи элетрофореза, что позволяет легко идентифицировать мутации типа замены нуклеотидов.
Наиболее информативным молекулярно-генетическим методом является секвенирование – определение последовательности нуклеотидов в ДНК. Методики секвенирования весьма трудоемки, требуют значительных затрат материалов и времени. Секвенирование используется для определения аллельных вариантов генов, различных типов генных мутаций ( чаще при замене оснований), для определения наследственных предрасположенностей. Существуют несколько разновидностей секвенирования, которые позволяют выявить возможные генетические отклонения и редкие генетические варианты.
Метод секвенирования позволил реализовать масштабный международный проект «Геном человека», целью которого была расшифровка нуклеотидной последовательности всей геномной ДНК человека. Было определено, что геном человека составляет 3,3х109 пар нуклеотидов.
В настоящее время быстро растущей областью молекулярно-генетической технологии и медицины является индивидуальное геномное секвенирование. В ближайшем будущем пациенты смогут иметь информацию о собственном геноме, что позволит врачам оценивать риски заболеваний у человека и корректировать стратегию лечения.
Метод генетики соматических клеток
Метод генетики соматических клеток сводится к использованию в целях генетического анализа человека культур клеток, полученных из различных источников: периферическая кровь, кожа, опухолевая ткань, ткань плода, клетки плаценты, ворсинок хориона, амниотической жидкости. В зависимости от задачи исследования используют следующие приемы: простое культивирование; клонирование; селекцию; гибридизацию.
Культивирование клеток в питательной среде in vitro позволяет получить достаточное количество клеточного материала для биохимических, цитогенетических, молекулярно-генетических и других методов.
Клонирование – получение от одной клетки генетически идентичного клеточного потомства.
Селекция – отбор из клеточной массы клеток с заданной характеристикой, например, несущих определенные мутации. Клонирование и селекция клеток расширяют возможность анализа генетического материала человека и точной диагностики наследственных болезней.
Гибридизация в условиях культуры клеток дает возможность исследовать сцепление генов и их хромосомную локализацию (картирование). Например, клетки гибриды «человек-мышь» утрачивают постепенно все хромосомы человека, что дает возможность проследить с потерей каждой очередной хромосомы утрату определенных генов.
Используя метод генетики соматических клеток, можно изучать первичные продукты генной активности, механизмы регуляции экспрессии генов, межгенные взаимодействия, изучать патогенез наследственных болезней на молекулярном и клеточном уровне.
Дерматоглифический метод
Дерматоглифика – изучение рисунка гребешковой кожи ладоней. Рисунок гребешковой кожи генетически детерминирован. Его формирование происходит в эмбриогенезе параллельно с формированием тканей и органов. Мутации, которые нарушают формирование структур организма, сопровождаются изменением характера основных элементов кожных гребешковых узоров.
Для получения рисунка ладонь равномерно смазывают типографской краской и делают отпечатки на бумаге. Изучают ход основных сгибательных ладонных борозд, кожные гребешковые узоры пальцев и ладоней и ряд других показателей. На основании изучения и статистической обработки больших популяционных выборок установлены наиболее характерные признаки кожного узора здорового человека с учетом расовых и этнических особенностей.
Изменение рисунка ладоней может наблюдаться при различных генетически детерминированных заболеваниях и уродствах. Характерные изменения дерматоглифических рисунков кожи пальцев и ладоней, характера основных ладонных борозд наблюдается при хромосомных болезнях: синдромах Дауна, Клайнфельтера, Шерешевского-Тернера, синдроме «Кошачьего крика». В современной генетике человека и медицинской генетике дерматоглифика как метод генетического анализа людей утратила свои позиции, так как в сравнении с цитогенетическим, молекулярно-цитогенетическим и молекулярно-генетическим методами является менее информативным. Тем не менее, в некоторых ситуациях применение дерматоглифики целесообразно в скрининговых обследованиях больших контингентов и отбора лиц, подлежащих более углубленному генетическому анализу.
Популяционно-статистический метод
Этот метод предназначен для изучения распространения наследственных признаков (в том числе патологических) в популяциях людей в одном или ряду поколений. Особенностью метода является проведение статистической обработки результатов наблюдений. На основании данных, полученных этим методом, рассчитывают частоту встречаемости в исследуемой группе населения различных аллелей гена, разных генотипов по этим аллелям. Метод позволяет также рассчитывать степень гетерозиготности в популяции по определенным аллелям, анализировать влияние факторов среды на экспрессию генов (показатели экспрессивности и пенетрантности). При статистической обработке результатов обследования индивидов той или иной популяции по интересующему исследователей признаку, а также для обоснований особенностей генетического состава популяции используется закон Харди-Вайнберга. Согласно закона Харди-Вайнберга процесс наследственной преемственности при определенных условиях сам по себе не ведет к изменению частот аллелей и частот генотипов по определенному гену в ряду поколений. Такими определенными условиями являются: отсутствие мутаций, отбора, миграции и дрейфа генов. Этот закон утверждает также, что если скрещивание случайно, то частоты генотипов связаны с частотами генов простыми (квадратичными) соотношениями. При случайном скрещивании равновесные частоты генотипов по данному гену достигаются уже за одно поколение, если частоты аллелей одинаковы у обоих полов. Если частоты аллелей у двух полов исходно различны, то равновесные частоты генотипов достигаются за два поколения. Равновесные частоты генотипов определяются (задаются) произведениями частот соответствующих аллелей. Если имеется, например, только два аллеля, А и а с частотой p и q, то частоты трех возможных генотипов выражаются уравнением:
(p + q)2 |
= |
p2 |
+ 2pq + |
q2 |
А а |
|
АА |
Аа |
аа |
|
|
|
|
|
- где буквам во второй строчке, обозначающим аллели и генотипы, соответствуют расположенные над ними частоты в первой строчке.
Если имеется два аллеля, как показано выше, с частотами p и q, то сумма частот этих аллелей равна 1 (p + q = 1), следовательно, сумма частот генотипов тоже будет равна 1 (p2 + 2pq + q2 = 1). Последнее уравнение представляет математическое выражение закона Харди-Вайнберга. Закон Харди-Вайнберга (его математическое выражение) позволяет рассчитывать частоты генов и генотипов, частоту гетерозигот-носителей скрытого рецессивного (нередко патогенного) аллеля.
Имея данные о частоте встречаемости в популяции рецессивного фенотипа, легко рассчитать частоту встречаемости в генофонде обследуемого поколения рецессивного аллеля. На основании этого можно предсказать появление в последующих поколениях рецессивных гомозигот и гетерозиготных носителей соответствующего рецессивного аллеля.
Методы пренатальной (дородовой) диагностики наследственных болезней
В настоящее время в распоряжении специалистов имеется обширный арсенал как прямых, так и непрямых методов исследования, позволяющих установить врожденные и наследственные заболевания у плода.
Непрямые методы – это обследование беременной женщины. Непрямые методы позволяют выявить женщин, имеющих повышенный риск рождения ребенка с наследственной патологией. Женщины направляются на пренатальную диагностику по следующим показаниям: возраст женщины 35 лет и старше; повторные спонтанные прерывания беременности; рождение ребенка с врожденными пороками развития; являющихся носителями хромосомных перестроек; инфекции у беременной; воздействие тератогенного фактора (радиация, химические вещества).
К непрямым методам относятся: акушерско-гинекологическое; генеалогическое; бактериологическое; цитогенетическое; иммунологическое обследование; биохимические методы.
При использовании непрямых методов о состоянии плода важное значение имеет определение в сыворотке крови беременной веществ, получивших название маркеров матери: концентрации α-фетопротеина (АФП); уровня хорионического гонадотропина (ХГЧ); уровня неконьюгированного (несвязанного) эстриола (НЭ).
Хорошим биохимическим маркером состояния плода оказался α-фетопротеин. Это белок, который вырабатывается печенью плода во внутриутробном развитии. Содержание АФП значительно возрастает в крови беременной при открытых дефектах невральной трубки, нарушениях целостности брюшной стенки и других дефектах развития плода. При некоторых хромосомных болезнях плода, в частности при болезни Дауна, уровень α-фетопротеина в крови беременной женщины часто снижен. Указанный тест наиболее информативен на 16-18 неделе беременности.
Диагностическую ценность для выявления синдрома Дауна у плода представляет определение в крови беременной уровня гормонов: β-субъединицы хорионического гонадотропного и неконьюгированного эстриола. При вынашивании плода с синдромом Дауна в крови беременной повышен уровень ХГЧ и снижено содержание эстриола.
В случае обнаружения измененного уровня АФП, ХГЧ и эстриола в крови беременной женщины она направляется на дополнительное исследование.
Прямые методы – непосредственное исследование состояния плода. К ним относятся неинвазионные и инвазионные методы. Неинвазионные методы – это обследование плода без оперативного вмешательства. Наиболее распространенный из неинвазивных методов является ультразвуковое исследование плода (УЗИ). УЗИ позволяет выявить как врожденные пороки развития, так и функциональное состояние плода и его провизорных органов (плаценты, пуповины, оболочек). Обязательные сроки проведения УЗИ - это 10-13, 20-22 и 30-32 неделя беременности.
Практически все неинвазивные методы как прямые, так и непрямые, позволяют только выявить женщин с высоким риском рождения детей с наследственными болезнями, которым показана пренатальная диагностика состояния плода с применением инвазивных методов исследования. Установить окончательный диагноз и определить тактику ведения беременности можно только после исследования плодного материала. Все процедуры инвазивной диагностики во время беременности несут определенный риск и производятся под контролем УЗИ.
К инвазивным методам относятся: амниоцентез (получение амниотической жидкости); биопсия хориона (взятие образцов ворсин хориона); кордоцентез (взятие крови плода из пуповины); биопсия тканей плода (кожа, мышцы и др.).
Амниоцентез – прокол амниотического (плодного) пузыря с целью получения околоплодной (амниотической) жидкости, проводится на 15-20-й неделе беременности. Амниоцентез делают через переднюю брюшную стенку матери под контролем УЗИ. Из амниотической полости извлекают10-30 мл амниотической жидкости. Амниотическую жидкость центрифугируют, получают осадок клеток и надосадочную жидкость. Из показателей надосадочной жидкости только концентрация АФП является диагностически значимой (см.выше). Основным источником диагностического материала при амниоцентезе являются клетки. Эмбриональные клетки происходят из амниона плода, эмбриональной кожи, желудочно-кишечного тракта. Клетки обязательно культивируют в питательной среде в течение 2-3 недель для получения достаточного количества клеток с целью проведения картирования или анализа ДНК. Для идентификации числовых изменений хромосом используют цитогенетические методы. Культуру амниотических клеток используют и для биохимического анализа, ДНК-диагностики.
Биопсия хориона применяется для получения небольшого количества ворсин хориона в период с 7-й по 16-ю неделю беременности. Процедура сбора ворсин выполняется через шейку матки (трансцервикально) или через переднюю брюшную стенку (трансабдоминально) под контролем УЗИ. Взятие образцов через брюшную стенку предпочтительнее, поскольку меньше риск внесения инфекции. Ворсины хориона являются производными эмбриональной трофобластной ткани и могут использоваться для цитогенетического анализа, ДНК-диагностики и биохимического анализа. Биопсия хориона имеет физиологическое и практическое преимущество по сравнению с амниоцентезом, который проводят не ранее 15-й недели. Кроме того цитогенетические результаты при биопсии хориона можно получить быстрее, поскольку в ворсинах хориона имеются делящиеся клетки. Однако хромосомный анализ при биопсии хориона менее надежен и риск выкидыша после биопсии ворсин хориона выше, чем после амниоцентеза.
Кордоцентез – взятие крови из пуповины с целью выявления возможных аномалий плода. Процедуру осуществляют с 20-й недели беременности под контролем УЗИ. Прокол делают через переднюю брюшную стенку матери. Образцы крови являются объектом для цитогенетических, молекулярно-генетических и биохимических методов диагностики наследственных болезней. Кордоцентез обычно делают в тех случаях когда информацию, необходимую для диагностики, нельзя получить с помощью амниоцентеза, биопсии хориона или когда получены подозрительные результаты. Преимущество кордоцентеза по сравнению с амниоцентезом заключается в том, что кровь является более удобным объектом для исследования, чем клетки амниотической жидкости. Лимфоциты крови культивируются быстрее (2-3 дня) и они надежнее, чем амниоциты.
Биопсия тканей плода осуществляется после 12 недели беременности под контролем УЗИ. Используется для диагностики целого ряда наследственных заболеваний. Например, для диагностики наследственных болезней кожи (ихтиоз, эпидермолиз) делают биопсию кожи плода. Затем проводят патоморфологическое исследование и по морфологическим критериям исследования болезней кожи ставят точный диагноз или отвергают его.
