
- •Лекция 11.
- •Часть 1. Гальванические элементы
- •Условная схема гальванического элемента
- •Аккумуляторы
- •Часть 2. Коррозия металлов. Способы защиты металлов от коррозии
- •Механизм электрохимической коррозии
- •Электрохимическая коррозия с водородной деполяризацией
- •Электрохимическая коррозия в кислородной деполяризацией
- •Способы защиты металлов от коррозии
- •4Электрохимическая защита.
- •Контрольная работа №11 (3 балла)
- •Лекция 13. Качественный анализ.
- •Типы реакций, применяемые в аналитической химии
- •Качественный анализ
- •Условия проведения реакций
- •Определение и регулирование рН в ходе анализа
- •Способы выполнения реакций
- •Реакции “сухим” способом
- •Реакции “мокрым” способом
- •Микрокристаллоскопический метод анализа
- •Методы определения качественного состава раствора
- •Дробный метод анализа.
- •Систематический метод анализа
- •Аналитические классификации ионов
- •Фильтрование
- •Центрифугирование
- •Осаждение ( седиментация)
- •Маскирование
- •5. Хроматографическое разделение
- •Экстракция
- •Электрохимические методы разделения
- •Флотация
- •Разделение и обнаружение газов
- •Реакции обнаружения анионов
- •Качественный анализ минерала (этот материал дополнительный, приведен для ознакомления)
- •Прямые методы анализа
- •Непрямые методы анализа
- •Аппаратура, химическая посуда, материалы
- •Подготовка образца к анализу
- •Выбор растворителя
- •Растворение в воде
- •Кислотное растворение
- •Растворение в разбавленной hCl
- •Растворение в концентрированной hCl
- •Растворение в азотной кислоте и смеси кислот
- •Бескислотное растворение
- •Контроьные задания
- •Задание №1,6,11,16
- •Задание №2,7,12,17
- •Задание №3,8,13,18
- •Задание №4,9,14,19
- •Задание №5,10,15,20
- •Лекция 14.Комплексные соединения
- •1.Понятие о комплексном соединении
- •2.Структура комплексных соединений
- •3.Номенклатура комплексных соединений
- •4.Классификация комплексных соединений
- •4.1.Комплексные соединения, содержащие
- •4.2.Комплексные соединения, содержащие ионные лиганды
- •4.3. Циклические комплексные соединения
- •4.4. Многоядерные комплексные соединения
- •5.Изомерия комплексных соединений
- •6.Равновесия в растворах комплексных соединений
- •7.Квантово-механические методы трактовки химической связи в комплексных соединениях
- •7.1. Метод валентных связей
- •7.2. Теория кристаллического поля
- •9. Применение комплексных соединений
- •Лекция 10. Окислительно-восстановительные реакции (овр)
- •Правила для определения степени окисления атомов:
- •Определение степени окисления атомов в сложных соединениях и ионах
- •Основные окислители и восстановители
- •Метод электронного баланса
- •2. Метод полуреакций или ионно-электронный метод
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций Электродные потенциалы
- •Сущность возникновения электродного потенциала
- •Ряд стандартных электродных потенциалов
- •Информация, заложенная в ряду стандартных электродных потенциалов:
- •Стандартные электродные потенциалы металлов
- •Определение направления протекания овр
- •Лекция № 8 Общие свойства растворов.
- •Основные способы выражения концентрации растворов:
- •Понижение давления насыщенного пара
- •Примеры решения задач
- •Повышение температуры кипения растворов
- •Примеры решения задач
- •Понижение температуры замерзания растворов
- •Осмотическое давление раствора
- •Лекция 9 Растворы электролитов
- •Механизм электролитической диссоциации
- •1. Диссоциация веществ с ионной связью
- •2. Диссоциация соединения с полярной ковалентной связью (полярные молекулы)
- •Количественный критерий процесса диссоциации
- •Слабые электролиты
- •Сильные электролиты
- •Взаимосвязь между кд и . Закон разбавления Оствальда
- •Диссоциация воды. Водородный показатель
- •Свойства кислот, оснований и солей в свете теории электролитической диссоциации
- •Реакции ионного обмена (рио)
- •Условия необратимого протекания реакций ионного обмена (рио)
- •Гидролиз солей
- •Произведение растворимости.
- •Лекция № 7 химическая кинетика и химическое равновесие
- •Факторы, влияющие на скорость реакции
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •Особенности закона действия масс
- •Зависимость скорости реакции от температуры
- •Ограниченность правила Вант-Гоффа:
- •Катализаторы
- •Химическое равновесие
- •Механизмы химических реакций
- •Лекция 12. Электролиз
- •Электролиз водных растворов солей
- •Особенности катодных процессов в водных растворах
- •Примеры решения задач
- •Электролиз расплавов электролитов
- •Законы Фарадея
- •Практическое применение электролиза
- •Электрохимический ряд напряжений металлов
- •Стандартные электродные потенциалы металлов
- •Перенапряжение
- •Стандартные электродные потенциалы окислительно-восстановительных систем
- •Окислительно-восстановительные потенциалы некоторых систем (инертный электрод – платина)
- •Контрольная работа №12
- •Лекция № 6 основные положения химической термодинамики и основы термохимии
- •Термодинамическая система
- •Процессы
- •Первое начало термодинамики ( I н т/д )
- •Правила знаков в термодинамике
- •Основы термохимии (т/х) Закон Гесса. Термохимические расчеты
- •Второе начало термодинамики (II н т/д)
- •Свободная энергия Гиббса. Критерий направленности процесса в неизолированных системах
- •Одно из основных уравнений химической термодинамики
- •Термодинамические расчеты
- •Третье начало термодинамики
- •Приложение Примеры решения задач
Химическое равновесие
Если в основу классификации реакций положить условия их протекания, то реакции можно разделить на два основных типа:
Реакции
обратимые
необратимые

реакции, которые протекают реакции, которые одновременно
только в одном направлении протекают в двух взаимно проти
и завершаются полным воположных направлениях.
превращением исходных Заканчивается установлением
веществ в продукты реакции в системе состояния равновесия.

 FeO
+ H2SO4
= FeSO4 + H2O H2
+ Cl2
2HCl знак = знак Более
подробно рассмотрим обратимые реакции,
т.е. реакции, которые протекают как в
прямом, так и в обратном направлении.
FeO
+ H2SO4
= FeSO4 + H2O H2
+ Cl2
2HCl знак = знак Более
подробно рассмотрим обратимые реакции,
т.е. реакции, которые протекают как в
прямом, так и в обратном направлении.
H2(г) + Cl2(г) 2HCl(г)

= k · СН2 · СCl2 (для
прямой реакции)
= k · СН2 · СCl2 (для
прямой реакции)

= k · С2НCl
(для обратной реакции)
= k · С2НCl
(для обратной реакции)
Как мы показали, обратимые реакции до конца не доходят, а заканчиваются установлением в системе состояния химического равновесия.
Мы с вами уже знакомы с термодинамическим условием состояния химического равновесия в неизолированной системе : G = 0 .
Кинетическим условием химического равновесия в искомой системе является равенство:
=
Т.е. химическим равновесием является такое состояние системы, при котором скорость прямой и обратной реакции равны между собой.
Термодинамическое равновесие – это такое состояние, которое принимает система после окончания в ней всех самопроизвольных процессов и которое длительно сохраняется во времени при отсутствии вмешательства извне.

=
=
k · СН2 · СCl2 = k · С2НCl
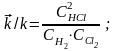
К = k / k (константа равновесия)
В состоянии равновесия реакции продолжают протекать, выравниваются только их скорости. Поэтому такое состояние равновесия называется подвижным или динамическим.
Концентрации веществ, которые устанавливаются при химическом равновесии называются равновесными и обозначаются формулой соелинения в квадратных скобках:[ ] .
Если С – исходные молярные концентрации, то
СН2 > [H2]
СНCl < [HCl]
После наступления равновесия концентрации веществ (и исходных, и продуктов) реакции остаются неизменными. Эти концентрации называются равновесными. Выражения для констант равновесия (справа выражение для реакций в газовой фазе – через парциальные давления, смотри закон действующих масс):
[HCl]2 P2 HCl
КС = ; КР = .
[Cl2] [H2] PCl2 PH2
КС и КР зависит от природы реагентов, от температуры. Она связана с изменением стандартной энергии Гиббса химической реакции (G0Т) уравнением:
G0Т = RT ln K G0Т
ln K = , отсюда
RT
 G
0т
G
0т
К = e R T зависимость К от Т
К – важная характеристика, по ее значению можно судить о направлении процесса, о выходе продукта при заданных условиях.
Если G0Т << 0 , то К >> 1 , (в равновесной системе преобладают продукты реакции) .
При G0Т >> 0 , то К << 1 , то в равновесной системе преобладают исходные вещества.
Состояние химического равновесия сохраняется лишь при данных условиях: Т , Р , С реагирующих веществ. Если изменить хотя бы один из этих параметров, то происходит нарушение (или как говорят смещение химического равновесия).
Влияние внешних воздействий на равновесную систему можно предсказать пользуясь принципом Ле-Шателье-Брауна (принцип подвижного равновесия):
“Если на систему, находящуюся в равновесии оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия” (является следствием II начала т/д) .
Рассмотрим влияние внешних факторов на примере системы:
2SO2(г) + O2(г) 2SO3(г) , ΔH = - 190 кДж .
Учтем, что при данной записи слева направо - прямая реакция, справа налево – обратная.
1. Влияние концентрации реагентов
а) увеличение концентрации исходного реагента - СSO2 .
Увеличение СSO2 приведет к смещению равновесия в том направлении, при котором концентрация SO2 уменьшится. Для этого существует единственный путь > смещение равновесия в сторону протекания прямой реакции, т.к. только в этом случае будет расходоваться тот избыток SO2 , который ввели в систему.
б) увеличение концентрации продукта - СSO3 .
Увеличение СSO3 в обратную сторону, протекание обратной реакции.
2. Влияние давления
В том случае, когда речь идет об изменении парциального давления газообразного вещества, нужно понимать, что речь идет об увеличении его концентрации (см. п.1).
Изменение общего давления влияет на состояние равновесия в тех случаях, когда:
а) в реакции участвуют хотя бы одно газообразное вещество (или одно из них находится в газообразной фазе) ;
б) если реакция сопровождается изменением объема системы (или изменением числа молей газов) ;
ΔV 0 , Δn 0 .
в) Р не влияет на состояние равновесия, если в реакции все реагенты (т.е. исходные вещества и продукты) находятся в конденсированном состоянии (жидком или твердом).
Изменение общего давления можно представить следующим образом: сосуд, в котором протекает реакция, закрыт поршнем, при сдвиге поршня вниз V↓ (P↑), подъем поршня - V↑ (P↓)
С(т) + О2(г) СО2(г) , Р не влияет
1V 1V
2СО(г) + О2(г) 2СО2(г) ; P ( равновесие сдвигается в сторону прямой реакции)
 2V 1V
2V
2V 1V
2V
3V
C(т) + СО2(г) 2СО(г) P ; CaCO3(т) CaO(т) + CO2(г)
1V 2V P 1V
Для нашей искомой системы:
2SO2(г) + O2(г) 2SO3(г)
2V 1V 2V
Р будет влиять, т.к. участвуют газовые фазы.
Объем системы меняется, т.к. ΔV = Vk –Vн = 2V – (2V + 1V) = 2V – 3V = 1V
а) при увеличении Р равновесие смещается в сторону его уменьшения, т.е. в сторону протекания прямой реакции ;
б) при уменьшении Р - в сторону протекания обратной.
а) и б) - в случае общего Р .
в) если увеличение РSO2 (одного) из продуктов – прямая.
3. Влияние температуры
Чтобы оценить влияние температуры надо знать величину теплового эффекта, т.е. величину ΔН .
Согласно принципу Ле Шателье повышение температуры вызывает смещение равновесия в направлении того процесса, который сопровождается поглощением теплоты (эндотермического). Понижение температуры вызовет смещение равновесия в сторону экзотермической реакции.
В нашем случае: прямой процесс идет с выделением теплоты, т.к. ΔН < 0 . Нужно учитывать, что тепловой эффект обратной реакции равен по величине, но противоположный по знаку, т.е. обратная реакция в нашем случае – эндотермическая.
Поэтому, при повышении температуры равновесие будет протекать в сторону обратной реакции, в сторону эндотермического процесса, для которого ΔН > 0 .
Таким образом, изучение химического равновесия имеет большое значение как для теоретического исследования, так и для решения практических задач.
Зная состояние равновесия при различных термодинамических параметрах, можно выбрать наиболее благоприятные условия проведения химического процесса.
Конечным результатом таких исследований является достижение максимально возможного выхода продукта при наибольшей скорости процесса его образования.
