
- •Лекция 11.
- •Часть 1. Гальванические элементы
- •Условная схема гальванического элемента
- •Аккумуляторы
- •Часть 2. Коррозия металлов. Способы защиты металлов от коррозии
- •Механизм электрохимической коррозии
- •Электрохимическая коррозия с водородной деполяризацией
- •Электрохимическая коррозия в кислородной деполяризацией
- •Способы защиты металлов от коррозии
- •4Электрохимическая защита.
- •Контрольная работа №11 (3 балла)
- •Лекция 13. Качественный анализ.
- •Типы реакций, применяемые в аналитической химии
- •Качественный анализ
- •Условия проведения реакций
- •Определение и регулирование рН в ходе анализа
- •Способы выполнения реакций
- •Реакции “сухим” способом
- •Реакции “мокрым” способом
- •Микрокристаллоскопический метод анализа
- •Методы определения качественного состава раствора
- •Дробный метод анализа.
- •Систематический метод анализа
- •Аналитические классификации ионов
- •Фильтрование
- •Центрифугирование
- •Осаждение ( седиментация)
- •Маскирование
- •5. Хроматографическое разделение
- •Экстракция
- •Электрохимические методы разделения
- •Флотация
- •Разделение и обнаружение газов
- •Реакции обнаружения анионов
- •Качественный анализ минерала (этот материал дополнительный, приведен для ознакомления)
- •Прямые методы анализа
- •Непрямые методы анализа
- •Аппаратура, химическая посуда, материалы
- •Подготовка образца к анализу
- •Выбор растворителя
- •Растворение в воде
- •Кислотное растворение
- •Растворение в разбавленной hCl
- •Растворение в концентрированной hCl
- •Растворение в азотной кислоте и смеси кислот
- •Бескислотное растворение
- •Контроьные задания
- •Задание №1,6,11,16
- •Задание №2,7,12,17
- •Задание №3,8,13,18
- •Задание №4,9,14,19
- •Задание №5,10,15,20
- •Лекция 14.Комплексные соединения
- •1.Понятие о комплексном соединении
- •2.Структура комплексных соединений
- •3.Номенклатура комплексных соединений
- •4.Классификация комплексных соединений
- •4.1.Комплексные соединения, содержащие
- •4.2.Комплексные соединения, содержащие ионные лиганды
- •4.3. Циклические комплексные соединения
- •4.4. Многоядерные комплексные соединения
- •5.Изомерия комплексных соединений
- •6.Равновесия в растворах комплексных соединений
- •7.Квантово-механические методы трактовки химической связи в комплексных соединениях
- •7.1. Метод валентных связей
- •7.2. Теория кристаллического поля
- •9. Применение комплексных соединений
- •Лекция 10. Окислительно-восстановительные реакции (овр)
- •Правила для определения степени окисления атомов:
- •Определение степени окисления атомов в сложных соединениях и ионах
- •Основные окислители и восстановители
- •Метод электронного баланса
- •2. Метод полуреакций или ионно-электронный метод
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций Электродные потенциалы
- •Сущность возникновения электродного потенциала
- •Ряд стандартных электродных потенциалов
- •Информация, заложенная в ряду стандартных электродных потенциалов:
- •Стандартные электродные потенциалы металлов
- •Определение направления протекания овр
- •Лекция № 8 Общие свойства растворов.
- •Основные способы выражения концентрации растворов:
- •Понижение давления насыщенного пара
- •Примеры решения задач
- •Повышение температуры кипения растворов
- •Примеры решения задач
- •Понижение температуры замерзания растворов
- •Осмотическое давление раствора
- •Лекция 9 Растворы электролитов
- •Механизм электролитической диссоциации
- •1. Диссоциация веществ с ионной связью
- •2. Диссоциация соединения с полярной ковалентной связью (полярные молекулы)
- •Количественный критерий процесса диссоциации
- •Слабые электролиты
- •Сильные электролиты
- •Взаимосвязь между кд и . Закон разбавления Оствальда
- •Диссоциация воды. Водородный показатель
- •Свойства кислот, оснований и солей в свете теории электролитической диссоциации
- •Реакции ионного обмена (рио)
- •Условия необратимого протекания реакций ионного обмена (рио)
- •Гидролиз солей
- •Произведение растворимости.
- •Лекция № 7 химическая кинетика и химическое равновесие
- •Факторы, влияющие на скорость реакции
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •Особенности закона действия масс
- •Зависимость скорости реакции от температуры
- •Ограниченность правила Вант-Гоффа:
- •Катализаторы
- •Химическое равновесие
- •Механизмы химических реакций
- •Лекция 12. Электролиз
- •Электролиз водных растворов солей
- •Особенности катодных процессов в водных растворах
- •Примеры решения задач
- •Электролиз расплавов электролитов
- •Законы Фарадея
- •Практическое применение электролиза
- •Электрохимический ряд напряжений металлов
- •Стандартные электродные потенциалы металлов
- •Перенапряжение
- •Стандартные электродные потенциалы окислительно-восстановительных систем
- •Окислительно-восстановительные потенциалы некоторых систем (инертный электрод – платина)
- •Контрольная работа №12
- •Лекция № 6 основные положения химической термодинамики и основы термохимии
- •Термодинамическая система
- •Процессы
- •Первое начало термодинамики ( I н т/д )
- •Правила знаков в термодинамике
- •Основы термохимии (т/х) Закон Гесса. Термохимические расчеты
- •Второе начало термодинамики (II н т/д)
- •Свободная энергия Гиббса. Критерий направленности процесса в неизолированных системах
- •Одно из основных уравнений химической термодинамики
- •Термодинамические расчеты
- •Третье начало термодинамики
- •Приложение Примеры решения задач
Аккумуляторы
Аккумуляторы – гальванические элементы многоразового и обратимого действия.
В отличии от гальванического элемента, в котором протекают необратимые реакции (разрядка), в аккумуляторах могут под действием внешнего источника постоянного тока происходить обратные реакции восстановления исходных веществ (аккумуляция энергии, процесс зарядки).
Наибольшее распространение получил свинцовый (или кислотный) аккумулятор. В основе его действия лежит следующая реакция:
разрядка
 Pb
+ PbO2 + 2H2SO4
2PbSO4 + 2H2O
Pb
+ PbO2 + 2H2SO4
2PbSO4 + 2H2O
Зарядка
Свинцовый аккумулятор прост в эксплуатации, обладает устойчивым режимом работы и КПД 80%. Номинальное напряжение 2В. Обычно аккумуляторы последовательно соединяют в батареи. Автомобильный аккумулятор состоит из 6 свинцовых ячеек (ЭДС 12В).
Часть 2. Коррозия металлов. Способы защиты металлов от коррозии
Коррозия ( от лат. «разъедать») - это процесс самопроизвольного разрушения металлов под воздействием окружающей среды.
Сущность коррозии – самопроизвольное окисление металлов в процессе окислительно-восстановительного взаимодействия их с окружающей средой.
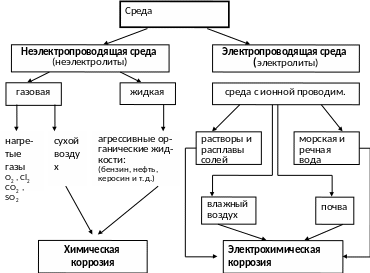
Химическая коррозия – разрушение металлов окислением его при непосредственном контакте с окислителем, окружающей среды без возникновения электрического тока. Обычно возникает при взаимодействии металлов с сухими газами (О2 воздуха, Cl2 и др.) при повышенной температуре
Например, химическая коррозия металлов в газовой атмосфере кислорода (например, резка металла «болгаркой»).
nMe + m/2 O2 = MenOm
Me0 nē Me+n
m/2 O2 + 2mē mO 2
G = RT lnK
Химическая коррозия обуславливается взаимодействием металлов с сухими газами или жидкостями, не проводящими электрический ток.
Химическая коррозия - образование окалины на Fe при высокой температуре. Оксиды FeO , Fe3O4 , Fe2 O3 не защищают металл от дальнейшего окисления, т.к. содержат трещины, поры. Наоборот, на Al и Cr образуются хорошие защитные пленки, полностью препятствующие проникновению газов к поверхности, поэтому эти металлы в атмосферных условиях коррозионно стойки, несмотря на их высокую химическую активность (Al2O3 , Cr2O3 ).
Меры защиты от химической коррозии:
- легирование металлов, т.е. введение в состав материала (металла, сплава, полупроводника) определенных примесей для изменения или улучшения физических и химических свойств металлов;
- замена агрессивной газовой среды (сварка в атмосфере инертного газа ит.п.);
- создание жаропрочных сплавов;
- насыщение поверхности изделий металлами, дающими защитные оксиды на повехности (насыщение алюминием – алитерирование, хромом – термохромирование).
Ежегодно в мире за счет коррозии теряется 10 – 15% продукции стали. Основные потери происходят за счет коррозии, протекающей по электрохимическому типу.
Электрохимическая коррозия (ЭХК) – разрушение металла при соприкосновении с электролитом, но при отсутствии прямого контакта с окислителем окружающей среды, и с возникновением вследствие этого в системе электрического тока.
При ЭХК наряду с химическими процессами (отдачей электронов) протекают и электрические – перенос электронов от одного участка металла к другому.
Для протекания коррозии по электрохимическому типу необходимы следующие условия:
Наличие разности потенциалов на поверхности металла. Она возникает при контакте 2-х различных металлов, наличии в металле примесей, неровно обработанной поверхности.
Присутствии токопроводящей среды (замыкающей разность потенциалов). Это может быть вода (влага воздуха), раствор электролита (морская вода ит.п.)
Наличие окислителя (деполяризатора). Обычно это – кислород воздуха, присутствующий также и в воде водоемов, или Н+ («кислотные дожди»).
наличие в металле примесей;
