
- •Лекция 11.
- •Часть 1. Гальванические элементы
- •Условная схема гальванического элемента
- •Аккумуляторы
- •Часть 2. Коррозия металлов. Способы защиты металлов от коррозии
- •Механизм электрохимической коррозии
- •Электрохимическая коррозия с водородной деполяризацией
- •Электрохимическая коррозия в кислородной деполяризацией
- •Способы защиты металлов от коррозии
- •4Электрохимическая защита.
- •Контрольная работа №11 (3 балла)
- •Лекция 13. Качественный анализ.
- •Типы реакций, применяемые в аналитической химии
- •Качественный анализ
- •Условия проведения реакций
- •Определение и регулирование рН в ходе анализа
- •Способы выполнения реакций
- •Реакции “сухим” способом
- •Реакции “мокрым” способом
- •Микрокристаллоскопический метод анализа
- •Методы определения качественного состава раствора
- •Дробный метод анализа.
- •Систематический метод анализа
- •Аналитические классификации ионов
- •Фильтрование
- •Центрифугирование
- •Осаждение ( седиментация)
- •Маскирование
- •5. Хроматографическое разделение
- •Экстракция
- •Электрохимические методы разделения
- •Флотация
- •Разделение и обнаружение газов
- •Реакции обнаружения анионов
- •Качественный анализ минерала (этот материал дополнительный, приведен для ознакомления)
- •Прямые методы анализа
- •Непрямые методы анализа
- •Аппаратура, химическая посуда, материалы
- •Подготовка образца к анализу
- •Выбор растворителя
- •Растворение в воде
- •Кислотное растворение
- •Растворение в разбавленной hCl
- •Растворение в концентрированной hCl
- •Растворение в азотной кислоте и смеси кислот
- •Бескислотное растворение
- •Контроьные задания
- •Задание №1,6,11,16
- •Задание №2,7,12,17
- •Задание №3,8,13,18
- •Задание №4,9,14,19
- •Задание №5,10,15,20
- •Лекция 14.Комплексные соединения
- •1.Понятие о комплексном соединении
- •2.Структура комплексных соединений
- •3.Номенклатура комплексных соединений
- •4.Классификация комплексных соединений
- •4.1.Комплексные соединения, содержащие
- •4.2.Комплексные соединения, содержащие ионные лиганды
- •4.3. Циклические комплексные соединения
- •4.4. Многоядерные комплексные соединения
- •5.Изомерия комплексных соединений
- •6.Равновесия в растворах комплексных соединений
- •7.Квантово-механические методы трактовки химической связи в комплексных соединениях
- •7.1. Метод валентных связей
- •7.2. Теория кристаллического поля
- •9. Применение комплексных соединений
- •Лекция 10. Окислительно-восстановительные реакции (овр)
- •Правила для определения степени окисления атомов:
- •Определение степени окисления атомов в сложных соединениях и ионах
- •Основные окислители и восстановители
- •Метод электронного баланса
- •2. Метод полуреакций или ионно-электронный метод
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций Электродные потенциалы
- •Сущность возникновения электродного потенциала
- •Ряд стандартных электродных потенциалов
- •Информация, заложенная в ряду стандартных электродных потенциалов:
- •Стандартные электродные потенциалы металлов
- •Определение направления протекания овр
- •Лекция № 8 Общие свойства растворов.
- •Основные способы выражения концентрации растворов:
- •Понижение давления насыщенного пара
- •Примеры решения задач
- •Повышение температуры кипения растворов
- •Примеры решения задач
- •Понижение температуры замерзания растворов
- •Осмотическое давление раствора
- •Лекция 9 Растворы электролитов
- •Механизм электролитической диссоциации
- •1. Диссоциация веществ с ионной связью
- •2. Диссоциация соединения с полярной ковалентной связью (полярные молекулы)
- •Количественный критерий процесса диссоциации
- •Слабые электролиты
- •Сильные электролиты
- •Взаимосвязь между кд и . Закон разбавления Оствальда
- •Диссоциация воды. Водородный показатель
- •Свойства кислот, оснований и солей в свете теории электролитической диссоциации
- •Реакции ионного обмена (рио)
- •Условия необратимого протекания реакций ионного обмена (рио)
- •Гидролиз солей
- •Произведение растворимости.
- •Лекция № 7 химическая кинетика и химическое равновесие
- •Факторы, влияющие на скорость реакции
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •Особенности закона действия масс
- •Зависимость скорости реакции от температуры
- •Ограниченность правила Вант-Гоффа:
- •Катализаторы
- •Химическое равновесие
- •Механизмы химических реакций
- •Лекция 12. Электролиз
- •Электролиз водных растворов солей
- •Особенности катодных процессов в водных растворах
- •Примеры решения задач
- •Электролиз расплавов электролитов
- •Законы Фарадея
- •Практическое применение электролиза
- •Электрохимический ряд напряжений металлов
- •Стандартные электродные потенциалы металлов
- •Перенапряжение
- •Стандартные электродные потенциалы окислительно-восстановительных систем
- •Окислительно-восстановительные потенциалы некоторых систем (инертный электрод – платина)
- •Контрольная работа №12
- •Лекция № 6 основные положения химической термодинамики и основы термохимии
- •Термодинамическая система
- •Процессы
- •Первое начало термодинамики ( I н т/д )
- •Правила знаков в термодинамике
- •Основы термохимии (т/х) Закон Гесса. Термохимические расчеты
- •Второе начало термодинамики (II н т/д)
- •Свободная энергия Гиббса. Критерий направленности процесса в неизолированных системах
- •Одно из основных уравнений химической термодинамики
- •Термодинамические расчеты
- •Третье начало термодинамики
- •Приложение Примеры решения задач
Механизм электрохимической коррозии
Пример: железо покрыто медью (или железо, содержащее примеси меди). В случае разрушения покрытия оно находится в контакте с медью. Если поместить эту систему в электропроводящую среду (раствор электролита), то ее можно представить в виде короткозамкнутого микрогальванического элемента (который можно рассматривать как коррозионную гальванопару):

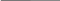 Fe
электролит Cu
Fe
электролит Cu
Рассмотрим в общем случае природу процессов, протекающих в системе. E0Fe / Fe = – 0,44 B , E0Cu / Cu = + 0,34 B
Т.к. его 0Fe / Fe < 0Cu / Cu , т.к. Fe – более активный металл.
1. Первая стадия процесса – процесс окисления (или анодный процесс).
(А) – анод – металл или участок металла с меньшим потенциалом.
Fe0 2ē Fe+2
Окислитель и восстановитель не имеют контакта, поэтому:
2. Вторая стадия процесса – перенос электронов от А к К, в результате чего (К) поляризуется (или заряжается) отрицательно (К ) .
К К –
И третий процесс, без которого немыслимо составление окислительно-восстановительных реакций:
3. Третья стадия процесса – процесс восстановления (или катодный процесс).
Окружающая среда – она поставляет окислитель!
ox + nē red
окисл. восст-ая форма
В результате катодного процесса окислитель принимает на себя электроны и тем самым снимает отрицательный заряд с катода, т.е. разряжает или деполяризует катод.
Поэтому при электрохимической коррозии окислитель называют обычно деполяризатором.
Коррозия будет протекать только в том случае, если выполняется условие:
Еокисл.(среда) > Евосст.(металл)
В зависимости от характера среды различают
Электрохимическая коррозия с водородной деполяризацией
Обратимся к тому же примеру, но зададим характер среды. Среда кислая – водный раствор HCℓ.

Fe HCl Cu
E0Мe / Ме 0,44 В + 0,34 В
Fe – восстановитель , Н+ - окислитель , E02Н / Н = 0
Еокисл. > Евосст. Процесс будет протекать.
(А) Fe 2ē Fe +2 (анодный процесс)
(К) 2H+ + 2ē H2 (катодный процесс)
Fe + 2H+ = Fe +2 + H2
Fe + 2HCl = FeCl2 + H2
Электрохимическая коррозия в кислородной деполяризацией
Опять наш пример, но среда уже – нейтральная (вода или растворы солей) или щелочная.
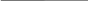
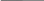
Fe влажный воздух Cu Fe NaOH Cu
O2 ; H2O O2 ; H2O
Изменение характера среды не повлияет на выбор (А) и (К) и на сам анодный процесс.
Поэтому анодный процесс тот же самый..
 (А) Fe 2ē
Fe +2 2 (анодный процесс)
(А) Fe 2ē
Fe +2 2 (анодный процесс)
Но природа окислителя изменилась, поэтому и катодный процесс будет иным.
на медном (К) O2 + 2H2O + 4ē 4ОН 1 (катодный процесс)
2Fe + O2 + 2H2O = 2Fe +2 + 4ОН
2Fe(OH) 2
Под действием окружающей среды корродирует железо, а на поверхности меди идет восстановление O2 . Следует отметить, что ионы Fe +2 могут также подвергаться окислению со стороны O2 , т.е.
4Fe(OH) 2 + O2 + 2H2O = 4Fe(OH) 3
Fe+2 ē Fe +3 4
O2 + 4ē 2О2 1
4 Fe+2 + O2 = 4Fe +3 + 2О2
2Fe(OH) 3 = Fe2O3 + 3H2O
распад ржавчина – истинный продукт коррозии, причина коррозии
Заметим, что при взаимодействии железа с кислородом, как и при химической коррозии, образуется оксид металла. Но коррозия протекает через анодные и катодные процессы с движением электронов и ионов (электрический ток), т.е. аналогично процессам в гальваническом элементе, поэтому коррозия по такому механизму называется электрохимической коррозией.
Основное отличие электрохимической коррозии от химической коррозии – стадийность процесса через анодные и катодные реакции, возможном при контакте металлов с раствором электролита. Поскольку поверхность активного металла меньше покрывается продуктами восстановления (они выделяются на катоде) скорость коррозии по этому типу возрастает.
По коррозионной устойчивости (по термодинамической нестабильности) все металлы можно разделить на 5 групп:
1 Металлы повышенной т\д нестабильности.
E0Мe / Меn+ ˂ - 0,41В
Литий, калий, натрий, барий, кальций, магний, алюминий, титан, марганец, хром, цинк и др.
Корродируют в нейтральных средах, окисляются водой (но часть из них обладает прочной оксидной оболочкой).
Металлы т\д нестабильные.
- 0,41В ˂ E0Мe / Меn+ ˂ 0,0В
Кадмий, никель, кобальт, молибден, свинец, вольфрам, железо и др..
В кислых средах окисляются Н+, в нейтральных – О2.
Металлы промежуточной т\д стабильности.
0,0В ˂ E0Мe / Меn+ ˂ +0,82В
Висмут, сурьма, медь, серебро, родий и др.
Не окисляются Н+, в нейтральных окисляются – О2.
Металлы высокой стабильности
+0,82В ˂ E0Мe / Меn+ ˂ +1,23В
Ртуть, палладий, иридий, платина.
Устойчивы во влажной атмосфере в нейтральных средах, но окисляются кислородом в кислых средах.
Металл полной стабильности: золото.
Окисляется только при снижении потенциала (см. леция по ОВР).
