- •Лекция 11.
- •Часть 1. Гальванические элементы
- •Условная схема гальванического элемента
- •Аккумуляторы
- •Часть 2. Коррозия металлов. Способы защиты металлов от коррозии
- •Механизм электрохимической коррозии
- •Электрохимическая коррозия с водородной деполяризацией
- •Электрохимическая коррозия в кислородной деполяризацией
- •Способы защиты металлов от коррозии
- •4Электрохимическая защита.
- •Контрольная работа №11 (3 балла)
- •Лекция 13. Качественный анализ.
- •Типы реакций, применяемые в аналитической химии
- •Качественный анализ
- •Условия проведения реакций
- •Определение и регулирование рН в ходе анализа
- •Способы выполнения реакций
- •Реакции “сухим” способом
- •Реакции “мокрым” способом
- •Микрокристаллоскопический метод анализа
- •Методы определения качественного состава раствора
- •Дробный метод анализа.
- •Систематический метод анализа
- •Аналитические классификации ионов
- •Фильтрование
- •Центрифугирование
- •Осаждение ( седиментация)
- •Маскирование
- •5. Хроматографическое разделение
- •Экстракция
- •Электрохимические методы разделения
- •Флотация
- •Разделение и обнаружение газов
- •Реакции обнаружения анионов
- •Качественный анализ минерала (этот материал дополнительный, приведен для ознакомления)
- •Прямые методы анализа
- •Непрямые методы анализа
- •Аппаратура, химическая посуда, материалы
- •Подготовка образца к анализу
- •Выбор растворителя
- •Растворение в воде
- •Кислотное растворение
- •Растворение в разбавленной hCl
- •Растворение в концентрированной hCl
- •Растворение в азотной кислоте и смеси кислот
- •Бескислотное растворение
- •Контроьные задания
- •Задание №1,6,11,16
- •Задание №2,7,12,17
- •Задание №3,8,13,18
- •Задание №4,9,14,19
- •Задание №5,10,15,20
- •Лекция 14.Комплексные соединения
- •1.Понятие о комплексном соединении
- •2.Структура комплексных соединений
- •3.Номенклатура комплексных соединений
- •4.Классификация комплексных соединений
- •4.1.Комплексные соединения, содержащие
- •4.2.Комплексные соединения, содержащие ионные лиганды
- •4.3. Циклические комплексные соединения
- •4.4. Многоядерные комплексные соединения
- •5.Изомерия комплексных соединений
- •6.Равновесия в растворах комплексных соединений
- •7.Квантово-механические методы трактовки химической связи в комплексных соединениях
- •7.1. Метод валентных связей
- •7.2. Теория кристаллического поля
- •9. Применение комплексных соединений
- •Лекция 10. Окислительно-восстановительные реакции (овр)
- •Правила для определения степени окисления атомов:
- •Определение степени окисления атомов в сложных соединениях и ионах
- •Основные окислители и восстановители
- •Метод электронного баланса
- •2. Метод полуреакций или ионно-электронный метод
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций Электродные потенциалы
- •Сущность возникновения электродного потенциала
- •Ряд стандартных электродных потенциалов
- •Информация, заложенная в ряду стандартных электродных потенциалов:
- •Стандартные электродные потенциалы металлов
- •Определение направления протекания овр
- •Лекция № 8 Общие свойства растворов.
- •Основные способы выражения концентрации растворов:
- •Понижение давления насыщенного пара
- •Примеры решения задач
- •Повышение температуры кипения растворов
- •Примеры решения задач
- •Понижение температуры замерзания растворов
- •Осмотическое давление раствора
- •Лекция 9 Растворы электролитов
- •Механизм электролитической диссоциации
- •1. Диссоциация веществ с ионной связью
- •2. Диссоциация соединения с полярной ковалентной связью (полярные молекулы)
- •Количественный критерий процесса диссоциации
- •Слабые электролиты
- •Сильные электролиты
- •Взаимосвязь между кд и . Закон разбавления Оствальда
- •Диссоциация воды. Водородный показатель
- •Свойства кислот, оснований и солей в свете теории электролитической диссоциации
- •Реакции ионного обмена (рио)
- •Условия необратимого протекания реакций ионного обмена (рио)
- •Гидролиз солей
- •Произведение растворимости.
- •Лекция № 7 химическая кинетика и химическое равновесие
- •Факторы, влияющие на скорость реакции
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •Особенности закона действия масс
- •Зависимость скорости реакции от температуры
- •Ограниченность правила Вант-Гоффа:
- •Катализаторы
- •Химическое равновесие
- •Механизмы химических реакций
- •Лекция 12. Электролиз
- •Электролиз водных растворов солей
- •Особенности катодных процессов в водных растворах
- •Примеры решения задач
- •Электролиз расплавов электролитов
- •Законы Фарадея
- •Практическое применение электролиза
- •Электрохимический ряд напряжений металлов
- •Стандартные электродные потенциалы металлов
- •Перенапряжение
- •Стандартные электродные потенциалы окислительно-восстановительных систем
- •Окислительно-восстановительные потенциалы некоторых систем (инертный электрод – платина)
- •Контрольная работа №12
- •Лекция № 6 основные положения химической термодинамики и основы термохимии
- •Термодинамическая система
- •Процессы
- •Первое начало термодинамики ( I н т/д )
- •Правила знаков в термодинамике
- •Основы термохимии (т/х) Закон Гесса. Термохимические расчеты
- •Второе начало термодинамики (II н т/д)
- •Свободная энергия Гиббса. Критерий направленности процесса в неизолированных системах
- •Одно из основных уравнений химической термодинамики
- •Термодинамические расчеты
- •Третье начало термодинамики
- •Приложение Примеры решения задач
Произведение растворимости.
Абсолютно нерастворимых веществ в природе не существует. Под действием молекул растворителя небольшое количество вещества в виде ионов все же переходит в раствор с поверхности трудно растворимого электролита (но могут вернуться обратно). При насыщении раствора устанавливается термодинамическое равновесие, характеризующееся константой равновесия
CaSO4(тв.) Ca2+ + SO42-
К = [Ca2+] ×[ SO42-] / [CaSO4(тв] или K × [CaSO4(тв] = [Ca2+] ×[ SO42-]
[CaSO4(тв] – величина постоянная, следовательно
[Ca2+] ×[ SO42-] = const = Пр (произведение растворимости).
Для насыщенного раствора труднорастворимого электролита произведение концентраций (точнее активностей) ионов, возведенных в степени их стехиометрических коэффициентов, есть величина постоянная при данной температуре.
Для различных труднорастворимых электролитов данные Пр можно найти в справочниках. В том случае, когда произведение концентраций соответствующих ионов будет больше Пр будет происходить выпадение осадка. Решение задач на произведение растворимости хорошо изложено в Глинка «Сборник задач по общей химии».
На это равновесие можно воздействовать (см принцип Ле Шателье). Например,
AgCl(тв.) Ag+ + Cl-
Чтобы полнее осадить ионы серебра, можно добавить к раствору одноименный ион хлора (из NaCl), чтобы увеличить растворимость хлорида серебра, можно связать ион серебра в растворе в комплексный ион с аммиаком. Именно поэтому в средства[ для чистки серебра применяют аммиак.
Введение в насыщенный раствор малорастворимого электролита другого сильного электролита, не содержащего с ним одноименных ионов, приводит к повышению растворимости. Это явление называется солевой эффект. Такой солевой эффект проявляется в морской воде.Эффект связан с тем, что при введении электролита повышается ионная сила раствора и понижается коэффициент активности (см.выше).
Лекция № 7 химическая кинетика и химическое равновесие
Ранее мы рассмотрели термодинамический метод изучения химических процессов, позволяющий осуществлять расчет химического равновесия и устанавливать направление возможного протекания процессов в тех или иных условиях. Основу термодинамического метода составляет величина G = 0 .
Однако, знание величины G не позволяет сделать никаких заключений о скорости реакции в определенных условиях. Процессы, протекающие в искомых системах зависят не только от термодинамических закономерностей, но и от кинетических закономерностей.
Химическая кинетика – раздел химии, который изучает скорость и механизм химических превращений.
Знание кинетики и механизма протекания реакций позволяет управлять химическим процессом, проводить их математическое моделирование в условиях производства.
Реакции
гомогенные
гетерогенные

(протекают в однородной (протекают в неоднородной
среде, т.е. между веществами, среде – между веществами,
которые находятся в одной фазе) которые находятся в разных
фазах)
2NO(г) + O2(г) = 2NO2(г) CaO(т) + 2HCl(ж) = CaCl2(ж) + H2O(ж )
Условия протекания
проходят равномерно проходят на границе
во всем объеме раздела фаз


Фаза – однородная часть системы, обладающая одинаковым составом, физическими и химическими свойствами и отделенная от других частей системы поверхностью раздела.
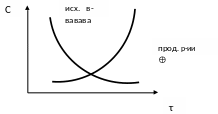
Скорость химической реакции – изменение количества реагирующих веществ за единицу времени в единице реакционного пространства.



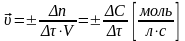
(для гомогенной реакции)
(единица реакционного пространства – единица объема (V)
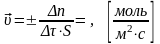
(для гетерогенной р-и)
(единица реакционного пространства – единица площади межфазной поверхности (S) .
Δn – изменение числа молей реагента по времени;
S – площадь поверхности раздела между фазами.
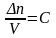
(С – молярная концентрация)
В ходе реакции изменяется концентрация как исходных веществ, так и продуктов реакции, причем они взаимосвязаны (уравнением химической реакции), поэтому в зависимости от того, о чем идет речь, берутся разные знаки:
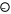 –
речь идет об убыли
концентрации исходных веществ;
–
речь идет об убыли
концентрации исходных веществ;
– об увеличении концентрации продуктов реакции.