
- •Лекция 11.
- •Часть 1. Гальванические элементы
- •Условная схема гальванического элемента
- •Аккумуляторы
- •Часть 2. Коррозия металлов. Способы защиты металлов от коррозии
- •Механизм электрохимической коррозии
- •Электрохимическая коррозия с водородной деполяризацией
- •Электрохимическая коррозия в кислородной деполяризацией
- •Способы защиты металлов от коррозии
- •4Электрохимическая защита.
- •Контрольная работа №11 (3 балла)
- •Лекция 13. Качественный анализ.
- •Типы реакций, применяемые в аналитической химии
- •Качественный анализ
- •Условия проведения реакций
- •Определение и регулирование рН в ходе анализа
- •Способы выполнения реакций
- •Реакции “сухим” способом
- •Реакции “мокрым” способом
- •Микрокристаллоскопический метод анализа
- •Методы определения качественного состава раствора
- •Дробный метод анализа.
- •Систематический метод анализа
- •Аналитические классификации ионов
- •Фильтрование
- •Центрифугирование
- •Осаждение ( седиментация)
- •Маскирование
- •5. Хроматографическое разделение
- •Экстракция
- •Электрохимические методы разделения
- •Флотация
- •Разделение и обнаружение газов
- •Реакции обнаружения анионов
- •Качественный анализ минерала (этот материал дополнительный, приведен для ознакомления)
- •Прямые методы анализа
- •Непрямые методы анализа
- •Аппаратура, химическая посуда, материалы
- •Подготовка образца к анализу
- •Выбор растворителя
- •Растворение в воде
- •Кислотное растворение
- •Растворение в разбавленной hCl
- •Растворение в концентрированной hCl
- •Растворение в азотной кислоте и смеси кислот
- •Бескислотное растворение
- •Контроьные задания
- •Задание №1,6,11,16
- •Задание №2,7,12,17
- •Задание №3,8,13,18
- •Задание №4,9,14,19
- •Задание №5,10,15,20
- •Лекция 14.Комплексные соединения
- •1.Понятие о комплексном соединении
- •2.Структура комплексных соединений
- •3.Номенклатура комплексных соединений
- •4.Классификация комплексных соединений
- •4.1.Комплексные соединения, содержащие
- •4.2.Комплексные соединения, содержащие ионные лиганды
- •4.3. Циклические комплексные соединения
- •4.4. Многоядерные комплексные соединения
- •5.Изомерия комплексных соединений
- •6.Равновесия в растворах комплексных соединений
- •7.Квантово-механические методы трактовки химической связи в комплексных соединениях
- •7.1. Метод валентных связей
- •7.2. Теория кристаллического поля
- •9. Применение комплексных соединений
- •Лекция 10. Окислительно-восстановительные реакции (овр)
- •Правила для определения степени окисления атомов:
- •Определение степени окисления атомов в сложных соединениях и ионах
- •Основные окислители и восстановители
- •Метод электронного баланса
- •2. Метод полуреакций или ионно-электронный метод
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций Электродные потенциалы
- •Сущность возникновения электродного потенциала
- •Ряд стандартных электродных потенциалов
- •Информация, заложенная в ряду стандартных электродных потенциалов:
- •Стандартные электродные потенциалы металлов
- •Определение направления протекания овр
- •Лекция № 8 Общие свойства растворов.
- •Основные способы выражения концентрации растворов:
- •Понижение давления насыщенного пара
- •Примеры решения задач
- •Повышение температуры кипения растворов
- •Примеры решения задач
- •Понижение температуры замерзания растворов
- •Осмотическое давление раствора
- •Лекция 9 Растворы электролитов
- •Механизм электролитической диссоциации
- •1. Диссоциация веществ с ионной связью
- •2. Диссоциация соединения с полярной ковалентной связью (полярные молекулы)
- •Количественный критерий процесса диссоциации
- •Слабые электролиты
- •Сильные электролиты
- •Взаимосвязь между кд и . Закон разбавления Оствальда
- •Диссоциация воды. Водородный показатель
- •Свойства кислот, оснований и солей в свете теории электролитической диссоциации
- •Реакции ионного обмена (рио)
- •Условия необратимого протекания реакций ионного обмена (рио)
- •Гидролиз солей
- •Произведение растворимости.
- •Лекция № 7 химическая кинетика и химическое равновесие
- •Факторы, влияющие на скорость реакции
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •Особенности закона действия масс
- •Зависимость скорости реакции от температуры
- •Ограниченность правила Вант-Гоффа:
- •Катализаторы
- •Химическое равновесие
- •Механизмы химических реакций
- •Лекция 12. Электролиз
- •Электролиз водных растворов солей
- •Особенности катодных процессов в водных растворах
- •Примеры решения задач
- •Электролиз расплавов электролитов
- •Законы Фарадея
- •Практическое применение электролиза
- •Электрохимический ряд напряжений металлов
- •Стандартные электродные потенциалы металлов
- •Перенапряжение
- •Стандартные электродные потенциалы окислительно-восстановительных систем
- •Окислительно-восстановительные потенциалы некоторых систем (инертный электрод – платина)
- •Контрольная работа №12
- •Лекция № 6 основные положения химической термодинамики и основы термохимии
- •Термодинамическая система
- •Процессы
- •Первое начало термодинамики ( I н т/д )
- •Правила знаков в термодинамике
- •Основы термохимии (т/х) Закон Гесса. Термохимические расчеты
- •Второе начало термодинамики (II н т/д)
- •Свободная энергия Гиббса. Критерий направленности процесса в неизолированных системах
- •Одно из основных уравнений химической термодинамики
- •Термодинамические расчеты
- •Третье начало термодинамики
- •Приложение Примеры решения задач
Типы окислительно-восстановительных реакций
1.Межмолекулярные окислительно-восстановительные реакции – реакции, в которых степень окисления изменяют атомы разных молекул.
KMnO4 + H2S + H2SO4
2.Внутримолекулярные окислительно-восстановительные реакции – реакции, при которых степень окисления изменяют разные атомы одной и той же молекулы.
Взрыв бертолетовой соли при нагревании;
+ +5 2 +
2KClO3 = 2KCl + 3O20
Cl+5 + 6e Cl 2
2O2 4e O20 3
2Cl+5 + 6O2 = 2Cl + 3O2
(т.е. степень окисления изменяют атомы разных элементов одного и того же вещества).
Реакции диспропорционирования (окислителем и восстановителем являются атомы одного и того же элемента)
3Cl2 + 6KОН = 5KCl + KClO3 + 3H2O
Cl0 + e Cl 5
2Cl0 5e Cl+5 1
5Cl0 + Cl0 = 5Cl1 + Cl+5 6Cl0 = 5Cl1 + Cl+5
3Cl2
Направление окислительно-восстановительных реакций Электродные потенциалы
Химическая активность различных окислителей и восстановителей неодинакова. Так для галогенов J2 и Br2:
2FeCl3 + 2KJ = J2 + 2FeCl2 + 2KCl, (1) но
Br2 + 2FeCl2 + 2KCl = 2FeCl3 + 2KBr (2)
О направлении окислительно-восстановительных реакций, как и любых других химических реакциях, можно судить по изменению энергии Гиббса.
Кроме того, для количественной характеристики окислительно-восстановительной активности веществ, находящихся в растворах, используют электродные или окислительно-восстановительные потенциалы (E или φ)
Связь между G и Е выражается уравнением
G = nFE ,
где F число Фарадея, F = 96500 Кл ;
n число электронов, участвующих в процессе ;
Е - электродный потенциал, В .
Таким образом, чтобы ОВР протекала самопроизвольно, ее Э.Д.С. должна быть больше 0.
Сущность возникновения электродного потенциала
(на примере металлического электрода)
Возникновение электродного потенциала легче понять, рассматривая так называемый «металлический электрод»
Если пластинку металла погрузить в раствор, содержащий его ионы, то между металлом и раствором возникнет разность потенциалов, называемая электродным потенциалом.
 Ме(тв)
+ mН2О Ме+n
mH2O
+ n ē
Ме(тв)
+ mН2О Ме+n
mH2O
+ n ē
Me(т) Me+n(р-р) + n ē
Возникновение электродного потенциала обусловлено протеканием электрохимических превращений – электродных процессов. Механизм этих процессов состоит в следующем. Кристаллическая решетка металла образована катионами, а электроны легко могут переходить в зону проводимости, быть достаточно свободными (см. Металлическая связь)
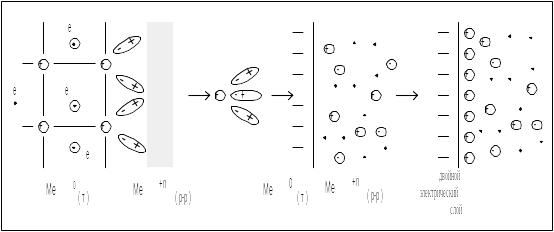
Металлическая пластинка погружена в воду. Под действием полярных молекул воды ионы металла отрываются от поверхности пластинки и переходят в жидкую фазу. Жидкая фаза при этом заряжается положительно, а на металле – пластинке появляется избыток электронов, что обеспечивает избыточный отрицательный заряд. Чем дальше протекает процесс
При погружении металла не в воду, а в раствор его соли, равновесие в соответствии с принципом Ле Шателье смещается влево. Повышение концентрации ионов в растворе облегчает процесс перехода иона из раствора в металл. Следовательно, новое состояние равновесия установится уже при другом значении Е .
Таким образом, при погружении металла в воду или в раствор его соли на поверхности раздела металл – раствор образуется двойной электрический слой и возникает разность потенциалов между металлом и раствором.
При контакте с раствором катионы кристаллической решетки притягиваются полярными молекулами воды и переходят в раствор, заряжая его положительно, а металл, в котором остался избыток электронов, заряжается отрицательно.
Катионы металла, находящиеся в растворе под действием сил электростатического притяжения концентрируются около поверхности металлов, образуя двойной электрический слой. На границе Ме/Ме+n устанавливается потенциалов или электродный потенциал. Разность потенциалов, возникающую на границе раздела Ме – раствор, называют электродным потенциалом. Этот потенциал является характеристикой окислительно-восстановительной активности металла.
Следует отметить, что процесс окисления (т.е. переход металла в раствор) вызывает обратный процесс – восстановление (или переход катионов из раствора в металл). При равновесии двух этих процессов наступает динамическое равновесие.
Ме(т) Ме+n + nē
р-р
Ме(т) Ме(m · H2O)n+ + nē
Таким образом, возникновение Е связано с протеканием на границе “металл – раствор” равновесных электрохимических реакций.
Если мы смешаем окисленную и восстановленную форму любого окислителя или восстановителя и опустим в него нейтральный платиновый электрод на нем также возникнет потенциал.
Электродный потенциал зависит от:
природы окислителя или восстановителя (для металлического электрода – природы металла);
концентрации ионов металла в растворе;
от температуры.
Окисленную форму иногда обозначают ox, а восстановленную – red. Зависимость Е от концентрации ох и red формы вещества и температуры выражается уравнением Нернста.
RT
Е = Е0 + — ln (Cox /Cred )
nF
где R = 8,31 Дж/К·моль (универсальная газовая постоянная);
F = 96500 Кл (число Фарадея);
Т = 250 С (298 К);
ln = 2,3 lg .
Е0 – стандартный электродный потенциал. Значения Е0 относится к растворам с концентрацией 1 моль/л ох и red форм вещества или к газообразным веществам с Р = 1 атм., Т = 250 С.
Если все эти значения подставить в выражение RT/nF и перейти от натурального логарифма к десятичному (ln … = 2,3 lg …), то будем иметь
0,059
Е = Е0 + — lg (Cox /Cred )
n
Для металлического электрода, в котором red – форма - металл (Ств = 1)
уравнение еще более упрощается
0,059
Е = Е0Me/Men+ + — lg (CMen+ )
n
Для реакций, протекающих в стандартных условиях
G0 = - nFE0
Е0 - стандартный электродный (окислительно-восстановительный) потенциал.
Абсолютное значение Е непосредственно определить невозможно, поэтому используют его относительную величину, определенную с помощью электрода сравнения.
При этом в качестве электрода сравнения используют стандартный водородный электрод, потенциал которого принят равным нулю.
Водородный электрод – представляет собой платиновую пластинку, покрытую тонким слоем рыхлой пористой платины и опущенную в водный раствор H2SO4 (СН = 1 моль/л). Через раствор H2SO4 пропускают Н2 при Р = 1 атм. При этом в системе протекает процесс
Ѕ Н2(г) Н+(р-р) + ē
В определенный момент в силе металла наступает состояние равновесия
G0 = 0
G0298 = G0f,298(Н ) – Ѕ G0f,298(H )
G0 = - nFE , т.е. G0298 = 0
Относительно стандартного водородного потенциала Е0 2Н / Н = 0 измерены стандартные потенциалы металлических электродов. Если металлы расположить в порядке возрастания значений их потенциалов, то получится ряд стандартных электродных потенциалов металлов или ряд напряжений. Ряд стандартных электродных потенциалов характеризует химические свойства металлов.
