
- •Лекция 11.
- •Часть 1. Гальванические элементы
- •Условная схема гальванического элемента
- •Аккумуляторы
- •Часть 2. Коррозия металлов. Способы защиты металлов от коррозии
- •Механизм электрохимической коррозии
- •Электрохимическая коррозия с водородной деполяризацией
- •Электрохимическая коррозия в кислородной деполяризацией
- •Способы защиты металлов от коррозии
- •4Электрохимическая защита.
- •Контрольная работа №11 (3 балла)
- •Лекция 13. Качественный анализ.
- •Типы реакций, применяемые в аналитической химии
- •Качественный анализ
- •Условия проведения реакций
- •Определение и регулирование рН в ходе анализа
- •Способы выполнения реакций
- •Реакции “сухим” способом
- •Реакции “мокрым” способом
- •Микрокристаллоскопический метод анализа
- •Методы определения качественного состава раствора
- •Дробный метод анализа.
- •Систематический метод анализа
- •Аналитические классификации ионов
- •Фильтрование
- •Центрифугирование
- •Осаждение ( седиментация)
- •Маскирование
- •5. Хроматографическое разделение
- •Экстракция
- •Электрохимические методы разделения
- •Флотация
- •Разделение и обнаружение газов
- •Реакции обнаружения анионов
- •Качественный анализ минерала (этот материал дополнительный, приведен для ознакомления)
- •Прямые методы анализа
- •Непрямые методы анализа
- •Аппаратура, химическая посуда, материалы
- •Подготовка образца к анализу
- •Выбор растворителя
- •Растворение в воде
- •Кислотное растворение
- •Растворение в разбавленной hCl
- •Растворение в концентрированной hCl
- •Растворение в азотной кислоте и смеси кислот
- •Бескислотное растворение
- •Контроьные задания
- •Задание №1,6,11,16
- •Задание №2,7,12,17
- •Задание №3,8,13,18
- •Задание №4,9,14,19
- •Задание №5,10,15,20
- •Лекция 14.Комплексные соединения
- •1.Понятие о комплексном соединении
- •2.Структура комплексных соединений
- •3.Номенклатура комплексных соединений
- •4.Классификация комплексных соединений
- •4.1.Комплексные соединения, содержащие
- •4.2.Комплексные соединения, содержащие ионные лиганды
- •4.3. Циклические комплексные соединения
- •4.4. Многоядерные комплексные соединения
- •5.Изомерия комплексных соединений
- •6.Равновесия в растворах комплексных соединений
- •7.Квантово-механические методы трактовки химической связи в комплексных соединениях
- •7.1. Метод валентных связей
- •7.2. Теория кристаллического поля
- •9. Применение комплексных соединений
- •Лекция 10. Окислительно-восстановительные реакции (овр)
- •Правила для определения степени окисления атомов:
- •Определение степени окисления атомов в сложных соединениях и ионах
- •Основные окислители и восстановители
- •Метод электронного баланса
- •2. Метод полуреакций или ионно-электронный метод
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций Электродные потенциалы
- •Сущность возникновения электродного потенциала
- •Ряд стандартных электродных потенциалов
- •Информация, заложенная в ряду стандартных электродных потенциалов:
- •Стандартные электродные потенциалы металлов
- •Определение направления протекания овр
- •Лекция № 8 Общие свойства растворов.
- •Основные способы выражения концентрации растворов:
- •Понижение давления насыщенного пара
- •Примеры решения задач
- •Повышение температуры кипения растворов
- •Примеры решения задач
- •Понижение температуры замерзания растворов
- •Осмотическое давление раствора
- •Лекция 9 Растворы электролитов
- •Механизм электролитической диссоциации
- •1. Диссоциация веществ с ионной связью
- •2. Диссоциация соединения с полярной ковалентной связью (полярные молекулы)
- •Количественный критерий процесса диссоциации
- •Слабые электролиты
- •Сильные электролиты
- •Взаимосвязь между кд и . Закон разбавления Оствальда
- •Диссоциация воды. Водородный показатель
- •Свойства кислот, оснований и солей в свете теории электролитической диссоциации
- •Реакции ионного обмена (рио)
- •Условия необратимого протекания реакций ионного обмена (рио)
- •Гидролиз солей
- •Произведение растворимости.
- •Лекция № 7 химическая кинетика и химическое равновесие
- •Факторы, влияющие на скорость реакции
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •Особенности закона действия масс
- •Зависимость скорости реакции от температуры
- •Ограниченность правила Вант-Гоффа:
- •Катализаторы
- •Химическое равновесие
- •Механизмы химических реакций
- •Лекция 12. Электролиз
- •Электролиз водных растворов солей
- •Особенности катодных процессов в водных растворах
- •Примеры решения задач
- •Электролиз расплавов электролитов
- •Законы Фарадея
- •Практическое применение электролиза
- •Электрохимический ряд напряжений металлов
- •Стандартные электродные потенциалы металлов
- •Перенапряжение
- •Стандартные электродные потенциалы окислительно-восстановительных систем
- •Окислительно-восстановительные потенциалы некоторых систем (инертный электрод – платина)
- •Контрольная работа №12
- •Лекция № 6 основные положения химической термодинамики и основы термохимии
- •Термодинамическая система
- •Процессы
- •Первое начало термодинамики ( I н т/д )
- •Правила знаков в термодинамике
- •Основы термохимии (т/х) Закон Гесса. Термохимические расчеты
- •Второе начало термодинамики (II н т/д)
- •Свободная энергия Гиббса. Критерий направленности процесса в неизолированных системах
- •Одно из основных уравнений химической термодинамики
- •Термодинамические расчеты
- •Третье начало термодинамики
- •Приложение Примеры решения задач
Факторы, влияющие на скорость реакции
природа реагирующих веществ;
концентрация реагирующих веществ;
внешние условия (Т , Р) ;
присутствие катализатора (ускоритель) или ингибитора (замедлитель).
Зависимость скорости реакции от концентрации реагирующих веществ
Эта зависимость от концентрации реагирующих веществ определяется законом действующих масс (закон действия масс) – 3 ДМ.
Действующими массами в XIX веке называли молярные концентрации.
Сущность закона действия масс (закона действующих масс) – скорость химической реакции пропорциональна произведению концентрации реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам, в уравнении реакции.
аА + вВ = сС + dD
υ = k · СаА · СвВ ,
где СА и СВ – концентрации реагирующих веществ;
а и в – стехиометрические коэффициенты.
k – коэффициент пропорциональности, который называется константой скорости реакции.
Физический смысл k легко понять, если принять, что СА = СВ = 1 моль/л , то υ = k . То есть, k численно равен скорости реакции, при концентрации реагирующих веществ, равной единице.
2СО + О2 = 2СО2
υ = k · С2СО · СО2
Особенности закона действия масс
1. Закон действия масс – справедлив только для достаточно простых химических реакций, для которых (а + в) 3 . аА + вВ = сС + dD
2. Для гетерогенных реакций, скорость реакции не зависит от концентрации твердых веществ, т.к. Ств. (кр.) = const = 1 .
С(т) + О2 (г) = СО2(г)
υ = k · СС · СО2 = k · СО2 , т.к. СС = 1
3. Уравнение Менделеева-Клапейрона (уравнение состояния идеального газа)
P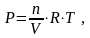 V
= nRT ,
V
= nRT ,
P = cRT ,
т.е. Р ~ с
Поэтому, если в реакции участвуют газообразные вещества, то в выражении закона действия масс вместо их концентраций можно использовать их парциальные давления.
υ = k · РаА · РвВ
Пример: во сколько раз увеличится скорость реакции, если давление СО увеличить в два раза?
2СО(г) + О2(г) = 2СО2(г)
υ1 = k1 · Р2СО · РО2 , Р1СО = 2РСО , значит
υ2 = k · (2РСО ) 2 · РО2 = 4k · Р2СО · РО2
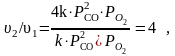
т.е. в 4 раза увеличится скорость.
Зависимость скорости реакции от температуры
Температура является одним из важных факторов, влияющих на скорость реакции. С увеличением температуры скорость реакции возрастает.
Для расчетов зависимости скорости реакции от температуры для многих процессов можно использовать эмпирическое правило, установленное голландским ученым Вант-Гоффом.
Правило Вант-Гоффа: при повышении температуры на 100С скорость химической зеакции увеличивается примерно в 2-4 раза.
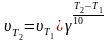
математическое выражение правила Вант-Гоффа
υТ2 и υТ1 - скорости реакции при разных температурах: начальная (Т1) и конечная (Т2 ) , причем, Т1 > Т2 .
- температурный коэффициент скорости реакции, показывает во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10 градусов.
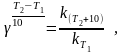

где k (Т2+10 ) и k Т2 - константы скорости реакции при t и (t+10) .
