
- •Лекция 11.
- •Часть 1. Гальванические элементы
- •Условная схема гальванического элемента
- •Аккумуляторы
- •Часть 2. Коррозия металлов. Способы защиты металлов от коррозии
- •Механизм электрохимической коррозии
- •Электрохимическая коррозия с водородной деполяризацией
- •Электрохимическая коррозия в кислородной деполяризацией
- •Способы защиты металлов от коррозии
- •4Электрохимическая защита.
- •Контрольная работа №11 (3 балла)
- •Лекция 13. Качественный анализ.
- •Типы реакций, применяемые в аналитической химии
- •Качественный анализ
- •Условия проведения реакций
- •Определение и регулирование рН в ходе анализа
- •Способы выполнения реакций
- •Реакции “сухим” способом
- •Реакции “мокрым” способом
- •Микрокристаллоскопический метод анализа
- •Методы определения качественного состава раствора
- •Дробный метод анализа.
- •Систематический метод анализа
- •Аналитические классификации ионов
- •Фильтрование
- •Центрифугирование
- •Осаждение ( седиментация)
- •Маскирование
- •5. Хроматографическое разделение
- •Экстракция
- •Электрохимические методы разделения
- •Флотация
- •Разделение и обнаружение газов
- •Реакции обнаружения анионов
- •Качественный анализ минерала (этот материал дополнительный, приведен для ознакомления)
- •Прямые методы анализа
- •Непрямые методы анализа
- •Аппаратура, химическая посуда, материалы
- •Подготовка образца к анализу
- •Выбор растворителя
- •Растворение в воде
- •Кислотное растворение
- •Растворение в разбавленной hCl
- •Растворение в концентрированной hCl
- •Растворение в азотной кислоте и смеси кислот
- •Бескислотное растворение
- •Контроьные задания
- •Задание №1,6,11,16
- •Задание №2,7,12,17
- •Задание №3,8,13,18
- •Задание №4,9,14,19
- •Задание №5,10,15,20
- •Лекция 14.Комплексные соединения
- •1.Понятие о комплексном соединении
- •2.Структура комплексных соединений
- •3.Номенклатура комплексных соединений
- •4.Классификация комплексных соединений
- •4.1.Комплексные соединения, содержащие
- •4.2.Комплексные соединения, содержащие ионные лиганды
- •4.3. Циклические комплексные соединения
- •4.4. Многоядерные комплексные соединения
- •5.Изомерия комплексных соединений
- •6.Равновесия в растворах комплексных соединений
- •7.Квантово-механические методы трактовки химической связи в комплексных соединениях
- •7.1. Метод валентных связей
- •7.2. Теория кристаллического поля
- •9. Применение комплексных соединений
- •Лекция 10. Окислительно-восстановительные реакции (овр)
- •Правила для определения степени окисления атомов:
- •Определение степени окисления атомов в сложных соединениях и ионах
- •Основные окислители и восстановители
- •Метод электронного баланса
- •2. Метод полуреакций или ионно-электронный метод
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций Электродные потенциалы
- •Сущность возникновения электродного потенциала
- •Ряд стандартных электродных потенциалов
- •Информация, заложенная в ряду стандартных электродных потенциалов:
- •Стандартные электродные потенциалы металлов
- •Определение направления протекания овр
- •Лекция № 8 Общие свойства растворов.
- •Основные способы выражения концентрации растворов:
- •Понижение давления насыщенного пара
- •Примеры решения задач
- •Повышение температуры кипения растворов
- •Примеры решения задач
- •Понижение температуры замерзания растворов
- •Осмотическое давление раствора
- •Лекция 9 Растворы электролитов
- •Механизм электролитической диссоциации
- •1. Диссоциация веществ с ионной связью
- •2. Диссоциация соединения с полярной ковалентной связью (полярные молекулы)
- •Количественный критерий процесса диссоциации
- •Слабые электролиты
- •Сильные электролиты
- •Взаимосвязь между кд и . Закон разбавления Оствальда
- •Диссоциация воды. Водородный показатель
- •Свойства кислот, оснований и солей в свете теории электролитической диссоциации
- •Реакции ионного обмена (рио)
- •Условия необратимого протекания реакций ионного обмена (рио)
- •Гидролиз солей
- •Произведение растворимости.
- •Лекция № 7 химическая кинетика и химическое равновесие
- •Факторы, влияющие на скорость реакции
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •Особенности закона действия масс
- •Зависимость скорости реакции от температуры
- •Ограниченность правила Вант-Гоффа:
- •Катализаторы
- •Химическое равновесие
- •Механизмы химических реакций
- •Лекция 12. Электролиз
- •Электролиз водных растворов солей
- •Особенности катодных процессов в водных растворах
- •Примеры решения задач
- •Электролиз расплавов электролитов
- •Законы Фарадея
- •Практическое применение электролиза
- •Электрохимический ряд напряжений металлов
- •Стандартные электродные потенциалы металлов
- •Перенапряжение
- •Стандартные электродные потенциалы окислительно-восстановительных систем
- •Окислительно-восстановительные потенциалы некоторых систем (инертный электрод – платина)
- •Контрольная работа №12
- •Лекция № 6 основные положения химической термодинамики и основы термохимии
- •Термодинамическая система
- •Процессы
- •Первое начало термодинамики ( I н т/д )
- •Правила знаков в термодинамике
- •Основы термохимии (т/х) Закон Гесса. Термохимические расчеты
- •Второе начало термодинамики (II н т/д)
- •Свободная энергия Гиббса. Критерий направленности процесса в неизолированных системах
- •Одно из основных уравнений химической термодинамики
- •Термодинамические расчеты
- •Третье начало термодинамики
- •Приложение Примеры решения задач
Способы защиты металлов от коррозии
Анализируя условия для протекания электрохимической коррозии (см. стр.5). становится понятным, что устранение даже одного из факторов замеляет коррозию. Чем меньше влажность воздуха, тем медленнее коррозия (тундра или тропики). В пресной воде коррозия медленнее, чем в морской воде (с электролитами). Часто используют различные покрытия: неметаллические (лаки, краски, полимерные покрытия, краски и т.д) и металлические. Металлические покрытия предпочтительны, т.к. вследствие ковкости металла не разрушаются при деформации, а также некоторые из них могут защищать изделие от коррозии при нарушении целостности покрытия.
Основные способы защиты от коррозии приведены ниже.
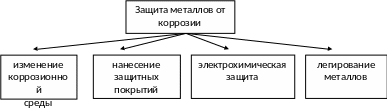
Нанесение защитных металлических покрытий
Катодные покрытия – это покрытие основного металла менее активным, защищающим его лишь при условии целостности покрытия (Е0 покр. Ме > Е0осн. Ме)
Вспомним исходный пример:железо было покрыто медью
основной Ме - Fe
покрытие - Cu
Металлическое покрытие предназначено для защиты металла от электрохимической коррозии. В данном случае это покрытие называется катодным.
Другой пример катодного покрытия: железо покрыто никелем.
 Кислая
среда:
Кислая
среда:
Fe H2SO4 Ni
Разб.
(А) Fe0 2ē Fe +2
на никелевом (К) 2H+ + 2ē H2
Fe + 2H+ = Fe +2 + H2
Fe + H2SO4 = FeSO 4 + H2
Анодное покрытие – это покрытие основного металла более активным (Еосн.. > Епокр.), защищающий металл от коррозии даже при нарушении покрытия (Е0 покр. Ме < Е0осн. Ме).
Zn влажный воздух Fe
O2 ; H2O
E0Мe / Ме 0,76 В 0,44 В
(А) Zn 2ē Zn +2 2
на железном (К) O2 + 2H2O + 4ē 4ОН 1
2Zn + O2 + 2H2O = 2Zn +2 + 4ОН
2Zn(OH) 2
Zn – анодное покрытие
2.Антикоррозионное легирование металла (введение в основу металлов, пассивирующих матрицу, чаще всего более активных Ме).
3. Защита путем изменения коррозионной среды.
а) удаление окислителя (кипячение, использование инертных газов и нейтрализующих кислых растворов;
б) понижение скорости анодных и катодных процессов – введение ингибиторов – замедлителей коррозии.
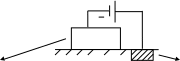
4Электрохимическая защита.
Она заключается в том, что на защищаемый металл подают электроны с целью предотвратить его окисление за счет отрицательно поляризации:
а) катодная защита – защищаемое изделие подключается к отрицательному полюсу источника постоянного тока
 ē
ē
ē
ē
+
защищаемый расходуемый металл
металл (окисляется)
б) протекторная защита – защищаемое изделие приводят в контакт с более активным металлом – протектором

ē протектор
защищаемый
металл
Легирование – это введение в металл компонентов, вызывающих его пассивирование (легирующие элементы для защиты железа от коррозии – Cr , Ni , W , Al и др.). Стали, содержащие более 14% хрома, относятся к классу коррозионно-стойких (нержавеющих).`
