
- •Лекция 11.
- •Часть 1. Гальванические элементы
- •Условная схема гальванического элемента
- •Аккумуляторы
- •Часть 2. Коррозия металлов. Способы защиты металлов от коррозии
- •Механизм электрохимической коррозии
- •Электрохимическая коррозия с водородной деполяризацией
- •Электрохимическая коррозия в кислородной деполяризацией
- •Способы защиты металлов от коррозии
- •4Электрохимическая защита.
- •Контрольная работа №11 (3 балла)
- •Лекция 13. Качественный анализ.
- •Типы реакций, применяемые в аналитической химии
- •Качественный анализ
- •Условия проведения реакций
- •Определение и регулирование рН в ходе анализа
- •Способы выполнения реакций
- •Реакции “сухим” способом
- •Реакции “мокрым” способом
- •Микрокристаллоскопический метод анализа
- •Методы определения качественного состава раствора
- •Дробный метод анализа.
- •Систематический метод анализа
- •Аналитические классификации ионов
- •Фильтрование
- •Центрифугирование
- •Осаждение ( седиментация)
- •Маскирование
- •5. Хроматографическое разделение
- •Экстракция
- •Электрохимические методы разделения
- •Флотация
- •Разделение и обнаружение газов
- •Реакции обнаружения анионов
- •Качественный анализ минерала (этот материал дополнительный, приведен для ознакомления)
- •Прямые методы анализа
- •Непрямые методы анализа
- •Аппаратура, химическая посуда, материалы
- •Подготовка образца к анализу
- •Выбор растворителя
- •Растворение в воде
- •Кислотное растворение
- •Растворение в разбавленной hCl
- •Растворение в концентрированной hCl
- •Растворение в азотной кислоте и смеси кислот
- •Бескислотное растворение
- •Контроьные задания
- •Задание №1,6,11,16
- •Задание №2,7,12,17
- •Задание №3,8,13,18
- •Задание №4,9,14,19
- •Задание №5,10,15,20
- •Лекция 14.Комплексные соединения
- •1.Понятие о комплексном соединении
- •2.Структура комплексных соединений
- •3.Номенклатура комплексных соединений
- •4.Классификация комплексных соединений
- •4.1.Комплексные соединения, содержащие
- •4.2.Комплексные соединения, содержащие ионные лиганды
- •4.3. Циклические комплексные соединения
- •4.4. Многоядерные комплексные соединения
- •5.Изомерия комплексных соединений
- •6.Равновесия в растворах комплексных соединений
- •7.Квантово-механические методы трактовки химической связи в комплексных соединениях
- •7.1. Метод валентных связей
- •7.2. Теория кристаллического поля
- •9. Применение комплексных соединений
- •Лекция 10. Окислительно-восстановительные реакции (овр)
- •Правила для определения степени окисления атомов:
- •Определение степени окисления атомов в сложных соединениях и ионах
- •Основные окислители и восстановители
- •Метод электронного баланса
- •2. Метод полуреакций или ионно-электронный метод
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций Электродные потенциалы
- •Сущность возникновения электродного потенциала
- •Ряд стандартных электродных потенциалов
- •Информация, заложенная в ряду стандартных электродных потенциалов:
- •Стандартные электродные потенциалы металлов
- •Определение направления протекания овр
- •Лекция № 8 Общие свойства растворов.
- •Основные способы выражения концентрации растворов:
- •Понижение давления насыщенного пара
- •Примеры решения задач
- •Повышение температуры кипения растворов
- •Примеры решения задач
- •Понижение температуры замерзания растворов
- •Осмотическое давление раствора
- •Лекция 9 Растворы электролитов
- •Механизм электролитической диссоциации
- •1. Диссоциация веществ с ионной связью
- •2. Диссоциация соединения с полярной ковалентной связью (полярные молекулы)
- •Количественный критерий процесса диссоциации
- •Слабые электролиты
- •Сильные электролиты
- •Взаимосвязь между кд и . Закон разбавления Оствальда
- •Диссоциация воды. Водородный показатель
- •Свойства кислот, оснований и солей в свете теории электролитической диссоциации
- •Реакции ионного обмена (рио)
- •Условия необратимого протекания реакций ионного обмена (рио)
- •Гидролиз солей
- •Произведение растворимости.
- •Лекция № 7 химическая кинетика и химическое равновесие
- •Факторы, влияющие на скорость реакции
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •Особенности закона действия масс
- •Зависимость скорости реакции от температуры
- •Ограниченность правила Вант-Гоффа:
- •Катализаторы
- •Химическое равновесие
- •Механизмы химических реакций
- •Лекция 12. Электролиз
- •Электролиз водных растворов солей
- •Особенности катодных процессов в водных растворах
- •Примеры решения задач
- •Электролиз расплавов электролитов
- •Законы Фарадея
- •Практическое применение электролиза
- •Электрохимический ряд напряжений металлов
- •Стандартные электродные потенциалы металлов
- •Перенапряжение
- •Стандартные электродные потенциалы окислительно-восстановительных систем
- •Окислительно-восстановительные потенциалы некоторых систем (инертный электрод – платина)
- •Контрольная работа №12
- •Лекция № 6 основные положения химической термодинамики и основы термохимии
- •Термодинамическая система
- •Процессы
- •Первое начало термодинамики ( I н т/д )
- •Правила знаков в термодинамике
- •Основы термохимии (т/х) Закон Гесса. Термохимические расчеты
- •Второе начало термодинамики (II н т/д)
- •Свободная энергия Гиббса. Критерий направленности процесса в неизолированных системах
- •Одно из основных уравнений химической термодинамики
- •Термодинамические расчеты
- •Третье начало термодинамики
- •Приложение Примеры решения задач
4.Классификация комплексных соединений
Комплексные соединения очень разнообразны по строению и свойствам. В связи с этим их единая и полная классификация затруднена. При классификации по координационному числу, по степени окисления комплексообразователя, по структуре, по типу координационной связи получается одностороннее описание этих соединений. Наиболее удачным считается разделение комплексных соединений на группы по характеру электрического заряда комплексного иона и по типу лигандов.
По
характеру электрического заряда
комплексного иона различают катионные,
анионные и нейтральные
комплексы.
Например:
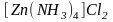 ,
,
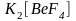 ,
,
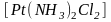 .
Есть также комплексные соединения, в
которых как катион, так и анион являются
комплексными.
Например:
.
Есть также комплексные соединения, в
которых как катион, так и анион являются
комплексными.
Например:
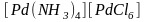 ,
,
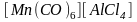 .
.
По типу лигандов различают: аквакомплексы, амминокомплексы, карбонилы, гидроксокомплексы и ацидокомплексы.
4.1.Комплексные соединения, содержащие
молекулярные монодентатные лиганды
Аквакомплексы.
Аквакомплексами
называются комплексные соединения, в
которых лигандами являются только
молекулы воды. Например:
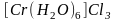 ,
,
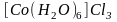 .
Аквакомплексы широко распространены.
В водных растворах каждый ион находится
в виде такого комплекса вследствие
гидратации. Аквакомплексы могут быть
настолько прочными, что при кристаллизации
сохраняются. Их называют кристаллогидратами.
В аквакомплексах молекулы воды обычно
координированы вокруг катиона. Чаще
всего координируются 6 или 4 молекулы
воды. Известны комплексы, в которых
молекулы воды координированы вокруг
аниона. Это бывает редко, так как анионы
имеют, как правило, большие размеры и
меньшую поляризующую способность по
сравнению с катионами.
.
Аквакомплексы широко распространены.
В водных растворах каждый ион находится
в виде такого комплекса вследствие
гидратации. Аквакомплексы могут быть
настолько прочными, что при кристаллизации
сохраняются. Их называют кристаллогидратами.
В аквакомплексах молекулы воды обычно
координированы вокруг катиона. Чаще
всего координируются 6 или 4 молекулы
воды. Известны комплексы, в которых
молекулы воды координированы вокруг
аниона. Это бывает редко, так как анионы
имеют, как правило, большие размеры и
меньшую поляризующую способность по
сравнению с катионами.
Амминокомплексы.
Они являются наиболее изученной группой
комплексных соединений. Это комплексы,
содержащие в качестве лигандов аммиак.
Например:
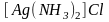 ,
,
 .
.
Амминокомплексов меньше, чем аквакомплексов, но и они тоже принадлежат к часто встречаемым комплексным соединениям.
Большинство амминокомплексов устойчиво, как в кристаллическом состоянии, так и в растворе. Часть из них при соприкосновении с водой разрушается и превращается в аквакомплексы.
Устойчивость
амминокомплексов, как и аквакомплексов,
увеличивается с увеличением заряда
комплексообразователя и с уменьшением
его размеров. Наиболее устойчивые
амминокомплексы образуют:
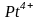 ,
,
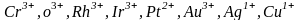 .
.
Карбонилы. Карбонилами называются комплексы, в которых лигандами являются только молекулы оксида углерода(II), а комплексо-
202
образователем
- атом металла, имеющий нулевую степень
окисления. Например:
 ,
,
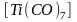 ,
,
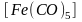 .
Карбонилы являются диамагнитными
веществами. Это говорит о том, что при
их образовании происходит спаривание
валентных электронов комплексообразователя.
Известны соединения, в которых имеется
два атома металла типа
.
Карбонилы являются диамагнитными
веществами. Это говорит о том, что при
их образовании происходит спаривание
валентных электронов комплексообразователя.
Известны соединения, в которых имеется
два атома металла типа
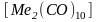 .
Так, в комплексном соединении марганца
.
Так, в комплексном соединении марганца
 содержится два атома марганца, химически
связанные между собой, и десять молекул
СО,
удерживаемых связями образованными по
донорно-акцепторному механизму. Такие
комплексные соединения называются
кластерами
(многоядерные соединения, в которых
химические связи образуются непосредственно
между атомами переходных металлов).
Наиболее типичны такие соединения для
Nb,
Ta,
Mo,
W,
Re,
находящихся в низших степенях окисления.
содержится два атома марганца, химически
связанные между собой, и десять молекул
СО,
удерживаемых связями образованными по
донорно-акцепторному механизму. Такие
комплексные соединения называются
кластерами
(многоядерные соединения, в которых
химические связи образуются непосредственно
между атомами переходных металлов).
Наиболее типичны такие соединения для
Nb,
Ta,
Mo,
W,
Re,
находящихся в низших степенях окисления.
