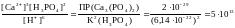- •Лекция 11.
- •Часть 1. Гальванические элементы
- •Условная схема гальванического элемента
- •Аккумуляторы
- •Часть 2. Коррозия металлов. Способы защиты металлов от коррозии
- •Механизм электрохимической коррозии
- •Электрохимическая коррозия с водородной деполяризацией
- •Электрохимическая коррозия в кислородной деполяризацией
- •Способы защиты металлов от коррозии
- •4Электрохимическая защита.
- •Контрольная работа №11 (3 балла)
- •Лекция 13. Качественный анализ.
- •Типы реакций, применяемые в аналитической химии
- •Качественный анализ
- •Условия проведения реакций
- •Определение и регулирование рН в ходе анализа
- •Способы выполнения реакций
- •Реакции “сухим” способом
- •Реакции “мокрым” способом
- •Микрокристаллоскопический метод анализа
- •Методы определения качественного состава раствора
- •Дробный метод анализа.
- •Систематический метод анализа
- •Аналитические классификации ионов
- •Фильтрование
- •Центрифугирование
- •Осаждение ( седиментация)
- •Маскирование
- •5. Хроматографическое разделение
- •Экстракция
- •Электрохимические методы разделения
- •Флотация
- •Разделение и обнаружение газов
- •Реакции обнаружения анионов
- •Качественный анализ минерала (этот материал дополнительный, приведен для ознакомления)
- •Прямые методы анализа
- •Непрямые методы анализа
- •Аппаратура, химическая посуда, материалы
- •Подготовка образца к анализу
- •Выбор растворителя
- •Растворение в воде
- •Кислотное растворение
- •Растворение в разбавленной hCl
- •Растворение в концентрированной hCl
- •Растворение в азотной кислоте и смеси кислот
- •Бескислотное растворение
- •Контроьные задания
- •Задание №1,6,11,16
- •Задание №2,7,12,17
- •Задание №3,8,13,18
- •Задание №4,9,14,19
- •Задание №5,10,15,20
- •Лекция 14.Комплексные соединения
- •1.Понятие о комплексном соединении
- •2.Структура комплексных соединений
- •3.Номенклатура комплексных соединений
- •4.Классификация комплексных соединений
- •4.1.Комплексные соединения, содержащие
- •4.2.Комплексные соединения, содержащие ионные лиганды
- •4.3. Циклические комплексные соединения
- •4.4. Многоядерные комплексные соединения
- •5.Изомерия комплексных соединений
- •6.Равновесия в растворах комплексных соединений
- •7.Квантово-механические методы трактовки химической связи в комплексных соединениях
- •7.1. Метод валентных связей
- •7.2. Теория кристаллического поля
- •9. Применение комплексных соединений
- •Лекция 10. Окислительно-восстановительные реакции (овр)
- •Правила для определения степени окисления атомов:
- •Определение степени окисления атомов в сложных соединениях и ионах
- •Основные окислители и восстановители
- •Метод электронного баланса
- •2. Метод полуреакций или ионно-электронный метод
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций Электродные потенциалы
- •Сущность возникновения электродного потенциала
- •Ряд стандартных электродных потенциалов
- •Информация, заложенная в ряду стандартных электродных потенциалов:
- •Стандартные электродные потенциалы металлов
- •Определение направления протекания овр
- •Лекция № 8 Общие свойства растворов.
- •Основные способы выражения концентрации растворов:
- •Понижение давления насыщенного пара
- •Примеры решения задач
- •Повышение температуры кипения растворов
- •Примеры решения задач
- •Понижение температуры замерзания растворов
- •Осмотическое давление раствора
- •Лекция 9 Растворы электролитов
- •Механизм электролитической диссоциации
- •1. Диссоциация веществ с ионной связью
- •2. Диссоциация соединения с полярной ковалентной связью (полярные молекулы)
- •Количественный критерий процесса диссоциации
- •Слабые электролиты
- •Сильные электролиты
- •Взаимосвязь между кд и . Закон разбавления Оствальда
- •Диссоциация воды. Водородный показатель
- •Свойства кислот, оснований и солей в свете теории электролитической диссоциации
- •Реакции ионного обмена (рио)
- •Условия необратимого протекания реакций ионного обмена (рио)
- •Гидролиз солей
- •Произведение растворимости.
- •Лекция № 7 химическая кинетика и химическое равновесие
- •Факторы, влияющие на скорость реакции
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •Особенности закона действия масс
- •Зависимость скорости реакции от температуры
- •Ограниченность правила Вант-Гоффа:
- •Катализаторы
- •Химическое равновесие
- •Механизмы химических реакций
- •Лекция 12. Электролиз
- •Электролиз водных растворов солей
- •Особенности катодных процессов в водных растворах
- •Примеры решения задач
- •Электролиз расплавов электролитов
- •Законы Фарадея
- •Практическое применение электролиза
- •Электрохимический ряд напряжений металлов
- •Стандартные электродные потенциалы металлов
- •Перенапряжение
- •Стандартные электродные потенциалы окислительно-восстановительных систем
- •Окислительно-восстановительные потенциалы некоторых систем (инертный электрод – платина)
- •Контрольная работа №12
- •Лекция № 6 основные положения химической термодинамики и основы термохимии
- •Термодинамическая система
- •Процессы
- •Первое начало термодинамики ( I н т/д )
- •Правила знаков в термодинамике
- •Основы термохимии (т/х) Закон Гесса. Термохимические расчеты
- •Второе начало термодинамики (II н т/д)
- •Свободная энергия Гиббса. Критерий направленности процесса в неизолированных системах
- •Одно из основных уравнений химической термодинамики
- •Термодинамические расчеты
- •Третье начало термодинамики
- •Приложение Примеры решения задач
Выбор растворителя
Первой стадией анализа является общий способ получения раствора исследуемого образца или пробы и при этом избежать потерь летучих элементов и иметь возможность удобно провести анализ и разделение отдельных групп. Процесс растворения включает в себя обработку исследуемого продукта растворителями. Растворитель подбирают такой, чтобы проба почти полностью растворилась. Используют растворители следующего типа: вода, сильная кислота, фтористоводородная кислота (HF) с целью разложения силикатов, не изменяющихся при действии обычных кислот и удаления кремниевой кислоты в виде летучего фторида кремния SiF4 . Разложение сплавлением. Обычно проводят в небольшом тигле из материала с более высокой химической стойкостью относительно используемого плавня.
Растворение в воде
В воде растворимы почти все соединения щелочных металлов, все нитраты, хлориды, кроме хлоридов PbCl2, AgCl, Hg2Cl2 (I), сульфаты, кроме сульфатов щелочноземельных металлов и свинца. Если проба растворяется в воде, то это могут быть минералы следующего , например, типа: NaCl - галит, KCl - сильвин, NaCL KCl - сильвинит, MgCl2 KCl 6 H2O -карналлит.
NaCl + H2O Na+(aq.) + Cl- (aq.)
гидратированные ионы
Растворенную пробу анализируют на катионы и анионы дробным методом.
Кислотное растворение
Продолжительность действия кислоты зависит от природы минерала, температуры и природы кислоты.
Растворение в разбавленной hCl
Соляная кислота растворяет большинство оксидов, все карбонаты, фосфаты, некоторые сульфиды. CaCO3 - кальцит, MgCO3 - магнезит, MgCa(CO3)2 - доломит, Cu2O -куприт, FeS-пирротин, ZnS - сфалерит, Ca5(PO4)3 ( F,Cl) - апатит. При растворении минерала в кислотах могут выделяться газы.
Выделение бесцветного газа без запаха - признак минерала карбонатной породы. Например, растворение кальцита CaCO3 в разбавленной соляной кислоте:
CaCO3 + 2 H+ Ca2+ + H2CO3 H2O + CO2
Запишем выражение константы равновесия для этого уравнения реакции растворения кальцита и вычислим ее, подставив справочные значения произведения растворимости карбоната кальция и константу диссоциации угольной кислоты :
Kp
=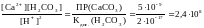
Вывод: карбонаты, у которых значение ПР больше или равно 2х10-17, растворяются в разбавленной соляной кислоте. Кальцит CaCO3 растворяется легко и быстро, а сидерит FeCO3 требует концентрированной соляной кислоты при нагревании и растворение идет медленно. Выделяется газ с неприятным запахом (H2S), минерал может содержать сульфиды. Например. Сфалерит ZnS.
ZnS + 2 HCl ZnCl2 + H2S
ZnS + 2 H+ Zn2+ + H2S
Запишем для этого уравнения реакции выражение константы равновесия и вычислим ее, подставив справочные значения произведения растворимости сульфида цинка и константу диссоциации сероводородной кислоты :
Kp
=
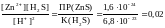
Согласно правилу , если Kp меньше 10-4, то можно растворить в разбавленной HCl, изменяя стандартные условия, изменяя температуру ( нагревая ), удаляя газ.
Вывод: сульфиды, у которых значение ПР больше или равно 6х10-23, будут растворяться в разбавленной соляной кислоте.
Фосфаты также можно растворить в HCl :
Ca3(PO4)2 + 6 H+ 3 Ca2+ + 2 H3PO4
Запишем выражение константы равновесия для этого уравнения реакции растворения фосфата кальция и вычислим ее, подставив в выражение табличные значения произведения растворимости фосфата кальция и константу диссоциации ортофосфорной кислоты :
Kp
=