
- •I. Механика
- •Система отсчета. Радиус-вектор, перемещение, путь, скорость.
- •Ускорение материальной точки (нормальное и тангенциальное). Движение точки по окружности.
- •Равноускоренное прямолинейное движение материальной точки.
- •Инерциальные системы отсчета. Первый закон Ньютона. Принцип относительности Галилея. Закон сложения скоростей.
- •Сила. Второй закон Ньютона. Масса. Третий закон Ньютона.
- •Импульс. Закон сохранения импульса.
- •Работа и мощность. Теорема о кинетической энергии.
- •Потенциальные и непотенциальные силы. Механическая энергия. Закон сохранения и изменения механической энергии.
- •Векторы угловой скорости и углового ускорения. Связь между линейными и угловыми величинами.
- •Момент силы, момент импульса, закон изменения момента импульса. Уравнение моментов.
- •Основной закон динамики вращательного движения твердого тела.
- •Момент инерции. Кинетическая энергия вращения.
- •Гармонические колебания. Смещение, скорость, ускорение при гармонических колебаниях. Дифференциальное уравнение гармонических колебаний.
- •Гармонические колебания груза на пружине. Период колебаний.
- •Превращения энергии при гармонических колебаниях груза на пружине.
- •Затухающие колебания. Логарифмический декремент затухания.
- •Вынужденные колебания. Резонанс.
- •Физический и математический маятник. Период колебаний маятника.
- •Моль вещества, молярная масса. Число Авогадро. Законы идеальных газов (изопроцессы). Уравнение Менделеева-Клапейрона.
- •Распределение Максвелла. Средняя квадратичная скорость молекул.
- •Основное уравнение молекулярно-кинетической теории идеального газа.
- •Внутренняя энергия идеального газа. Закон равномерного распределения энергии по степеням свободы.
- •Работа в термодинамике. Выражения для работы при изопроцессах идеального газа.
- •Первое начало термодинамики. Количество теплоты. Теплоемкость идеального газа. Уравнение Майера.
- •Адиабатический процесс. Уравнение Пуассона.
- •Принцип действия теплового двигателя и его к.П.Д.
- •Цикл Карно и его к.П.Д.
- •Обратимые и необратимые процессы. Энтропия идеального газа. Статистический смысл энтропии.
Первое начало термодинамики. Количество теплоты. Теплоемкость идеального газа. Уравнение Майера.
Теплообменом называется процесс передачи энергии от одного тела другому без совершения работы. Различают следующие виды теплообмена: теплопроводность, конвекция, лучистый теплообмен.
Количеством теплоты Q называется энергия, переданная телу в результате теплообмена. При теплообмене часть внутренней энергии одного тела переходит во внутреннюю энергию другого.
Теплоемкостью тела называется величина, численно равная количеству теплоты, которое необходимо сообщить телу, чтобы изменить его температуру на один градус:
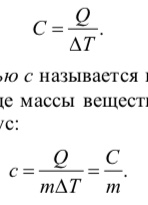
Удельной теплоемкостью с называется количество теплоты, которое необходимо сообщить единице массы вещества для того, чтобы изменить его температуру на один градус:
Молярной теплоемкостью называется количество теплоты, которое необходимо сообщить одному молю вещества для того, чтобы изменить его температуру на один градус.
Молярная и удельная теплоемкость связаны между собой соотношением С с. Количество теплоты, необходимое для нагревания вещества массой т (или числом молей ) на Т градусов, можно определить по формуле QcmT CT.
Если система тел изолирована, то в соответствии с законом сохранения энергии энергия такой системы не изменяется, т. е. U = const. Если в такой системе происходят процессы, при которых работа не совершается, то изменение внутренней энергии любого тела системы равно количеству теплоты, отданной или полученной этим телом: Ui Qi. Суммируя подобные выражения для всех тел системы, получаем
 Уравнение
называется
уравнением теплового баланса.
Уравнение
называется
уравнением теплового баланса.
Если в изолированной системе тел не происходит никаких превращений энергии кроме теплообмена, то количество теплоты, отданное телами, внутренняя энергия которых уменьшается, равно количеству теплоты, полученному телами, внутренняя энергия которых увеличивается.
Закон сохранения энергии, распространяемый как на механические, так и на тепловые явления, называется первым законом (началом) термодинамики: изменение внутренней энергии системы равно сумме работы, совершаемой над системой внешними силами, и количества теплоты, полученного системой: U A Q. Так как работа внешних сил А и работа, совершаемая системой над другими телами А, равны и противоположны по знаку ( A A) , имеем Q U A, т. е. количество теплоты, сообщенное системе, идет на приращение внутренней энергии системы и на совершение этой системой работы над внешними телами.
Необходимо подчеркнуть, что совершенная работа А и переданное количество теплоты Q в отличие от U зависят не только от начального и конечного состояний системы, но и от процесса, с помощью которого происходило изменение состояния.
В этой связи следует отметить, что теплоемкость вещества также зависит от процесса, в котором происходит передача теплоты. Различают теплоемкость при постоянном объеме СV и постоянном давлении Cp, если в процессе нагревания вещества его объем или давление постоянны.
Согласно первому началу термодинамики для 1 моля идеального газа получаем

так как в изохорном процессе работа газа A = 0, и поэтому Q = ΔU.
В изобарном процессе
поскольку в этом процессе согласно уравнению Менделеева–Клайперона
pVμ = RT, и, следовательно, для 1 моля идеального газа,
pdVμ = RdT.
Уравнение, связывающее Сp, CV и R, называется уравнением Майера.
Отметим, что для любых веществ Cp > CV, так как в процессе при постоянном давлении часть подводимой теплоты дополнительно расходуется на совершение работы по расширению тела (газа).
При изохорном процессе (V = const) газ работу не совершает, и все количество теплоты Q расходуется только на увеличение внутренней энергии газа:

При изобарном процессе (р = const) количество теплоты, подводимое к газу, Q 0 , расходуется как на увеличение внутренней энергии (U 0), так и на работу расширения ( A 0) , которую совершает газ против внешнего давления: Q U A. Поскольку A pV RT , а изменение внутренней энергии газа
![]() ,
имеем
При
изотермическом процессе (Т =
const) температура остается постоянной
(T
0) , внутренняя энергия газа при этом не
меняется (U
0) , поэтому вся подводимая теплота идет
на работу, совершаемую газом: Q = A.
,
имеем
При
изотермическом процессе (Т =
const) температура остается постоянной
(T
0) , внутренняя энергия газа при этом не
меняется (U
0) , поэтому вся подводимая теплота идет
на работу, совершаемую газом: Q = A.
