
- •Основные обозначения
- •Введение
- •СПЕКТРАЛЬНЫЕ (ОПТИЧЕСКИЕ) МЕТОДЫ АНАЛИЗА
- •Основные характеристики электромагнитного излучения
- •Спектр электромагнитных колебаний
- •Глава 1. Абсорбционная спектроскопия
- •1.1. Законы поглощения света
- •1.2.2. Спектры поглощения
- •1.2.3. Устройство приборов
- •1.2.4. Практическое применение
- •1. Определение фенолов.
- •2. Определение аминов.
- •3. Определение кетонов.
- •1.2.5. Практические работы
- •Работа 1. Определение хрома дифенилкарбазидным методом
- •Выполнение работы
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •1.3. Инфракрасная (колебательная) спектроскопия
- •1.3.1. Элементарная теория колебательных спектров
- •1.3.2. Спектры поглощения
- •Количественный анализ по инфракрасным спектрам.
- •1.3.4. Устройство приборов
- •1.3.5. Практические работы
- •Выполнение работы
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •Глава 2. Эмиссионная спектроскопия
- •2.3. Практические работы
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- •Глава 3. Кондуктометрия
- •3.1. Электропроводность растворов электролитов
- •3.1.1. Удельная электропроводность
- •3.1.2. Эквивалентная электропроводность
- •3.2. Электропроводность природных вод
- •3.3. Кондуктометрическое титрование
- •Титрование сильной кислоты сильным основанием
- •Титрование слабой кислоты сильным основанием
- •3.4. Практические работы
- •Кондуктометр ОК 102/1
- •Порядок работы на приборе
- •Выполнение работы
- •Работа 2. Определение удельной электропроводности воды
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •Глава 4. Потенциометрия
- •4.1. Электродный потенциал
- •4.2. Электроды сравнения
- •4.3. Диффузионный потенциал
- •4.4. Прямая потенциометрия
- •4.4.2. Ионоселективные электроды
- •4.5. Потенциометрическое титрование
- •4.7. Практические работы
- •Порядок работы
- •Ход работы
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •Глава 5. Вольтамперометрия
- •5.1. Кривая ток-потенциал
- •5.2. Полярографический фон
- •5.3. Диффузионный ток
- •5.4. Количественный полярографический анализ
- •5.5. Качественный полярографический анализ
- •5.6. Полярографическая установка
- •5.7. Хроноамперометрия с линейной разверткой потенциала
- •5.8. Инверсионная вольтамперометрия
- •5.9. Практическое применение
- •5.10. Практические работы
- •Работа 1. Обнаружение ионов Cu2+, Cd2+, Zn2+, Mn2+
- •Выполнение работы
- •Работа 2. Обнаружение ионов Pb2+ и Tl+
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •Глава 6. Электрофорез
- •6.1. Общие принципы электрофореза
- •1. Форма и величина белковой молекулы.
- •2. Электрическое поле.
- •3. Характер буфера и его ионная сила.
- •4. Природа носителя.
- •6.2. Электрофорез на бумаге и ацетате целлюлозы
- •6.3. Электрофорез в гелях
- •6.4. Диск-электрофорез
- •6.5. Применение метода диск-электрофореза
- •6.6. Практические работы
- •Выполнение работы
- •Проведение электрофореза
- •Обнаружение белковых фракций
- •Хранение и реставрация гелей
- •Техника безопасности при работе методом электрофореза
- •Контрольные вопросы
- •Литература
- •6.8. Практические работы
- •Выполнение работы
- •Контрольные вопросы
- •Выполнение работы
- •Контрольные вопросы
- •Контрольные вопросы
- •Литература
- •ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- •Глава 7. Общие принципы хроматографии
- •7.2. Классификация хроматографических методов
- •7.3. Применение методов хроматографии
- •Контрольные вопросы
- •Литература
- •Глава 8. Жидкостная хроматография
- •8.1.1. Хроматография на колонке
- •8.1.2. Тонкослойная хроматография (ТСХ)
- •8.1.3. Практические работы
- •Выполнение работы
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •8.2. Жидкостно-жидкостная (распределительная) хроматография
- •8.2.1. Теоретические основы метода
- •8.2.2. Хроматография на бумаге
- •8.2.3. Практические работы
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •8.3. Ионообменная хроматография
- •8.3.1. Теоретические основы метода
- •Контрольные вопросы
- •Литература
- •8.4. Проникающая или эксклюзионная хроматорафия
- •8.4.1. Теоретические основы метода
- •8.4.2. Практические работы
- •Выполнение работы
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •8.5. Высокоэффективная жидкостная хроматография (ВЭЖХ)
- •8.5.1. Теоретические основы метода
- •8.5.2. Практические работы
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •8.6. Понятие об аффинной или биоспецифической хроматографии
- •Контрольные вопросы
- •Литература
- •Глава 9. Газовая хроматография
- •9.1. Теоретические основы метода
- •9.2. Аппаратурное оформление газовой хроматографии
- •9.3. Качественный и количественный анализ
- •9.4. Применение газовой хроматографии
- •9.5. Практические работы
- •Контрольные вопросы
- •Литература
рометрии. Электрохимические методы анализа позволяют определять концентрацию вещества в широком интервале (1 - 10-9 моль/л) с достаточной точностью и воспроизводимостью, могут быть легко автоматизированы.
Глава 3. Кондуктометрия
Кондуктометрия – это метод определения различных физикохимических величин, основанный на измерении электрической проводимости (электропроводности).
3.1. Электропроводность растворов электролитов
Электропроводностью называют способность растворов электролитов проводить электрический ток под действием внешнего электрического поля.
Величину, обратную электрическому сопротивлению (1/R), называют электропроводностью. Единицей электропроводности является сименс (См). Таким образом, 1 См = 1 Ом-1.
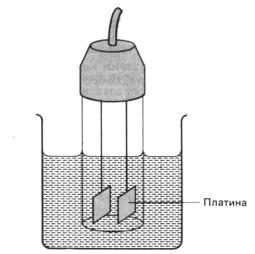
Для определения электропроводности может использоваться кондуктометрическая ячейка – стеклянный сосуд без дна с двумя электродами известной площади (S), прочно укрепленными на фиксированном расстоянии друг от друга (L). Электроды выполнены из платиновой черни. Ячейку погружают в раствор электролита, как показано на рис. 3.1.
Рис. 3.1. Кондуктометрическая ячейка
49
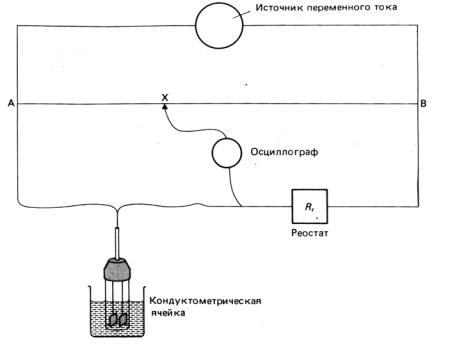
Сопротивление кондуктометрической ячейки измеряют при помощи специального устройства – мостика Уитстона (рис. 3.2). Скользящий контакт перемещается по проволочному сопротивлению до тех пор, пока осциллограф не зарегистрирует минимальный сигнал. В этом положении контакта (точка Х) сопротивление ячейки определяется соотношением:
Rя =BX Rр/AX,
где Rр – сопротивление реостата.
Рис. 3.2. Мостик Уитстона
После того, как найдено сопротивление ячейки, можно вычислить электропроводность раствора. Для измерения электропроводности необходимо использовать высокочастотный источник переменного тока. Использование источника постоянного тока невозможно из-за того, что это вызовет электролиз раствора.
Отношение (L/S) представляет собой постоянную величину, характерную для данной ячейки. Она называется постоянной или константой ячейки (сосуда.). Ее можно определить, измеряя с помощью данной ячейки сопротивление какого-либо раствора с известной электролитической проводимостью.
Постоянная сосуда является очень важной характеристикой ячейки. Она зависит от площади электродов, расстояния между ними, от формы сосуда и объема раствора, проводящего ток. Вследствие того, что в переносе электричества участвует заметно больший объем раствора, чем тот, который заключен между электродами (рис. 3.1.), уровень жидкости, которая заливается в сосуд для измерения электропроводности (из-
50
мерительную ячейку), должен превышать край электродов примерно на два расстояния между электродами.
Постоянную сосуда находят экспериментально по электрической проводимости стандартных растворов с хорошо известными значениями удельной электропроводности (“χ”) в широкой области температур и концентраций. Обычно в качестве стандартных используют водные растворы хлорида калия. Для определения константы сосуда измеряют сопротивление раствора хлорида калия. Удельная электропроводность хлорида калия приведена в таблице.
Таблица
Удельная электропроводность раствора хлорида калия [C(KCl) = 0,02 моль/л] при различных температурах
|
|
|
|
Температура, 0С |
Χχ, См см-1 |
Температура, 0С |
χχ, См см-1 |
0 |
0,001521 |
20 |
0,002606 |
10 |
0,001994 |
25 |
0,002765 |
14 |
0,003193 |
30 |
0,003036 |
18 |
0,002397 |
35 |
0,003320 |
Различают удельную и эквивалентную электропроводности.
3.1.1. Удельная электропроводность
Удельная электропроводность является величиной, обратной удельному сопротивлению, и обозначается символом χ (каппа). Таким образом,
χ =1/ρ,
где ρ - удельное сопротивление (измеряется в единицах Ом м).
Если R=ρL/S,
где R – сопротивление проводника (Ом); L – длина проводника (м); S – площадь поперечного сечения (м2), то
ρ= R S/L,
χ =L/R S.
Удельная электропроводность измеряется в единицах Ом-1 м-1 либо Ом-1 см-1. Вместо этого для нее могут использоваться См м-1 либо
См см-1. Нетрудно видеть, что 1 Ом-1 см-1 =1 См см-1.
Удельной электропроводностью называют электропроводность
столбика раствора электролита длиной 1 см и поперечным сечением
1 см2.
Если К=L/S,
51
где К [см-1] – постоянная (константа) сосуда, то
χ =К/R.
Электропроводность растворов электролитов зависит от скорости движения ионов, концентрации ионов и температуры.
Зависимость удельной электропроводности от скорости движения ионов определяется соотношением:
χ = F С α (V+ + V-)/1000,
где F - число Фарадея, С – концентрация раствора, α - степень диссоциации, V+ , V- - абсолютные скорости движения катионов и анионов.
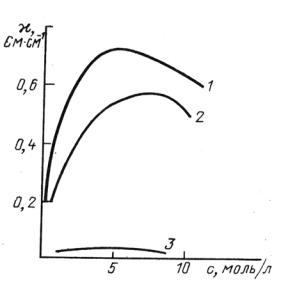
В разбавленных растворах слабых и сильных электролитов удельная электропроводность с увеличением концентрации растет, но при некоторой достаточно высокой концентрации достигает максимума и затем падает. На рис. 3.3. приведены типичные примеры этой зависимости. Электрическая проводимость слабого электролита (CH3COOH, кривая 3) значительно ниже соответствующей величины для растворов HCl (кривая 1) или KOH (кривая 2).
Рис. 3.3. Изменение удельной электропроводности с концентрацией
Возрастание электрической проводимости с ростом концентрации в растворах происходит вследствие увеличения числа ионов. Однако в концентрированных растворах возникают и другие эффекты, приводящие к уменьшению электропроводности.
В концентрированных растворах сильных электролитов (α=1) возрастают силы межионного взаимодействия, вследствие чего происходит образование межионных ассоциатов или ионных пар, что приводит к снижению скорости движения ионов и, следовательно, уменьшению электрической проводимости. Для слабых электролитов в концентрированных растворах удельная электропроводность падает, т.к. уменьшается степень диссоциации (чем больше концентрация, тем ниже α).
52
