
- •Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •Определение молекулярных масс газообразных веществ
- •Основные стехиометрические законы.
- •Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •Волновые свойства электрона. Квантовые числа s-, p-, d-, f-состояния электрона. Электронные орбитали. Проскок электрона.
- •Принцип Паули. Определение электронной емкости уровней, подуровней и орбиталей. Правило Хунда.
- •Порядок заполнения подуровней электронами. Правила Клечковского, электронные и электронографические формулы.
- •Периодический закон д.И. Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер. Электронные аналоги.
- •Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •Оксиды. Классификация, способы получения, химические свойства.
- •Кислоты. Классификация, способы получения, химические свойства.
- •Основания. Классификация, способы получения, химические свойства.
- •Соли. Классификация, способы получения, химические свойства.
- •Образование химической связи. Энергия связи и длина связи. Типы химической связи. Межмолекулярное взаимодействие. Водородная связь.
- •Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов.
- •Валентность и степень окисления. Способы определения степени окисления. Основные окислители и восстановители. Уравнять окислительно-восстановительную реакцию ионно-электронным методом.
- •Направленность ковалентной связи. Σ и π-связи. Гибридизация атомных орбиталей.
- •Полярность связи. Ионная (электронная) связь. Полярность молекул и их дипольный момент.
- •Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •Основные положения метода молекулярных орбиталей. Связывающие и разрыхляющие орбитали. Энергетические диаграммы.
- •Металлическая связь. Роль металлической связи в формировании физических и химических свойств металлов.
- •Система. Фаза. Компонент. Параметры системы. Правило фаз Гиббса.
- •Функции состояния: внутренняя энергия и стандартная энтальпия образования химических веществ
- •Первое начало термодинамики. Теплота, работа. Закон Гесса. Следствия из закона Гесса. Термохимические расчеты.
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа). Теплоемкость.
- •Второе начало термодинамики. Понятие об энтропии. Расчет энтропии. Изменение энтропии при химических процессах и фазовых переходах.
- •Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •Третий закон термодинамики. Постулат Планка.
- •Постулат Планка
- •Условия самопроизвольного протекания химических реакций.
- •Константа химического равновесия. Расчет кр и кс.
- •Скорость химической реакции. Закон действующих масс. Константы скорости гомогенной и гетерогенной химических реакций. Связь константа скорости с константой равновесия
- •Закон действующих масс (з.Д.М.)
- •Кинетическая классификация по степени сложности. Молекулярность и порядок реакции. Обратимые и необратимые реакции. Классификация реакций по степени сложности
- •Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса. Зависимость скорости реакции от температуры.
- •Энергия активации химической реакции. Аналитический и графический метод расчета энергии активации.
- •Катализ. Сущность гомогенного и гетерогенного катализа. Стадии гетерогенного катализа.
- •Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Способы выражения концентраций растворов.
- •Способы выражения концентрации растворов
- •Растворимость. Произведение растворимости. Изменение энтальпии и энтропии при растворении.
- •Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях. Физические и химические процессы при растворении.
- •Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •Законы Рауля.
- •Э лектролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •Константа диссоциации. Закон разведения Оствальда.
- •Сильные электролиты. Понятие активности и коэффициента активности. Ионная сила раствора.
- •Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Гидролиз солей. Константа и степень гидролиза.
- •Окислительно-восстановительные реакции. Ионно-электродный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •Возникновение скачка потенциала на границе раздела "металл-раствор".
- •Равновесный электродный потенциал.
- •Медно-цинковый гальванический элемент Якоби-Даниеля. Процессы на электродах. Понятие об эдс.
- •Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •Стандартный водородный электрод. Формула Нерста. Стандартный потенциал. Ряд напряжений металла.
- •Типы электродов. Стеклянный электрод.
- •Электролиз. Последовательность разряда ионов на катоде и аноде.
- •Законы Фарадея. Выход по току
- •Коррозия металлов. Химическая и электрохимическая коррозия
- •Основные методы борьбы с коррозией. Почвенная коррозия.
- •Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •Сущность термографического анализа. Основные принципы построения диаграммы плавкости бинарных систем.
- •Диаграмма состояния однокомпонентной системы на примере воды.
- •Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •Диаграмма плавкости непрерывных твердых растворов. Правило рычага.
- •Диаграмма плавкости бинарной системы с ограниченными твердыми растворами.
- •Диаграммы плавкости бинарных систем с образованием химических соединений.
- •Адсорбция и абсорбция. Хемосорбция.
- •Агрегатные состояния вещества. Стеклообразное и жидкокристаллическое состояния вещества.
Функции состояния: внутренняя энергия и стандартная энтальпия образования химических веществ
Функция состояния
– это термодинамические функции,
значение которых зависит только от
состояния системы, но не зависит от
пути, по которому система пришла в данное
состояние. Для них ![]() ,
где
,
где ![]() – значение данного параметра в начале
процесса, а
– значение данного параметра в начале
процесса, а ![]() – значение в конце.
– значение в конце.
Наиболее важными функциями состояния в термодинамике являются внутренняя энергия U и энтальпия H (теплосодержание)
H=U+PV, где P – давление, а V – объем.
![]() ,
,
![]() .
.
Стандартная энтальпия (теплота) образования вещества – это тепловой эффект реакции образования 1моль химического соединения из простых веществ в стандартных условиях: Т=289 К, Р=1 атм=101325 Па.
Внутренняя энергия представляет собой общий запас энергии системы: энергию поступательного и вращательного движения молекул, энергию колебания атомов, энергию вращения электронов, внутриядерную энергию и так далее, за исключением кинетической энергии системы в целом и потенциальной энергии положения системы.
Теплота q и работа A не являются функциями состояния и их бесконечно малые изменения обозначаются как δq и δA в отличие от полных дифференциалов dU и dH.
Если внутренняя энергия является функцией двух переменных U=f(V,T), то:
![]()
Первое начало термодинамики. Теплота, работа. Закон Гесса. Следствия из закона Гесса. Термохимические расчеты.
Первое начало термодинамики:
В изолированной системе
общий запас энергии сохраняется
постоянным. Поскольку работа является
одной из форм перехода энергии, то,
следовательно, невозможно создание
вечного двигателя первого рода (машины,
совершающей работу без затраты энергии).
Математическая формулировка: ![]()
Различные виды механической работы различного идеального газа
В идеальном газе все виды взаимодействия – это упругие соударения друг с другом (взаимодействия с сохранением импульса)
Уравнения Менделеева – Клайперона: pV=nRT, где R=8,31 Дж/К
p=const (Изобара)
dA=pdV => A=p(V2-V1)
T=const (Изотерма)
![]()
δ-Q=0(Адиабата)
dA=dU ![]() Дж/К
Дж/К
![]()
V=const (Изохора)
A=0
p=const T=const (Изотерма-Изобара)
![]()
![]() ,
где
,
где ![]()
![]() нтальпия.
Закон Гесса
нтальпия.
Закон Гесса
H=U+pV (Энтропия)
Идеальный газ: ![]() ,
где RT=2,47 кДж
,
где RT=2,47 кДж
Закон Гесса
В условиях постоянства давления или постоянства объема, теплота процесса становится функцией составляющей и не зависит от процесса
p=const
δQ=dU+pdV=d(U+pV) =dH, Q=H (становится функцией составляющей)
V=const
δQ=dU, Q=U
Следствия законов Гесса
Если реакция является суммой или разностью других реакций. По тепловой эффективности этой реакции будет суммой или разностью тепловых эффектов.
Стандартной теплотой i-го вещества
![]()
Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа). Теплоемкость.
Теплоемкость
С – количество
теплоты, которое нужно передать, чтобы
нагреть 1 градус Цельсия. ![]() Дж/К
Дж/К
Закон Кирхгоффа
Пересчитывать тепловые эффекты с одной температуры на другую
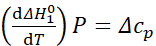 1з.к.г.
1з.к.г.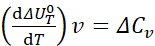 2з.к.г.
2з.к.г.
Температурный коэффициент теплового эффекта процесса равен изменению теплоемкости системы, происходящему в результате процесса
Проинтегрировав вышеприведенные диф. уравнения получим:
![]()
![]()
Для того, чтобы
подсчитать тепловой эффект процесса
при некоторой температуре ![]() ,
нужно знать тепловой эффект этого
процесса при
,
нужно знать тепловой эффект этого
процесса при ![]() ,
а также характер изменения теплоемкости
системы в интервале температур
,
а также характер изменения теплоемкости
системы в интервале температур ![]() .
.
В небольшом температурном интервале можно в степенных рядах для теплоемкостей ограничиться только первым членом
![]() и тогда
и тогда![]() будет величиной постоянной:
будет величиной постоянной:
![]() .
.
Обычно в роли выступает стандартная температура 298К( 25 градусов Цельсия):
![]() .
.
В некоторых случаях данные по теплоемкости участников процесса отсутствуют, и тогда приходится идти на очень грубое приближение:
![]() .
.
